Polychlorinated Biphenyl의 토양 미생물 Aspergillus niger에 의한 생분해 경로
초록
Polychlorinated biphenyl은 현재 대부분의 사용 금지된 염소계 농약과 함께, 대부분의 환경 매질에서 매우 일반적으로 검출되는 잔류성 유기물로서, 209종의 이성질체가 존재하며, 내생호르몬 교란 효과 등, 다양한 생리 독성을 나타내는 것으로 알려져 있다. 해당 물질군의 환경 중, 분해소실과 관련된 연구는 주로 토양 등의 복잡한 매질을 주요 대상으로 수행되었으며, 또한 개별 이성질체에 관한 연구보다는 Aroclor 등, 혼합물 위주의 연구가 수행되었다. 한편 개별 이성질체에 관한 연구는 매우 제한적으로 수행되었다. 본 연구에서는 이와 같은 점을 고려하여, polychlorinated biphenyl 이성질체 중, 구조적 특성이 상이한 5종의 이성질체를 합성하여, 토양 중 일반적으로 분포하고 있는 미생물인 Aspergillus niger에 의한 대사과정을 밝히고자 하였다. Biphenyl 및 polychlorinated biphenyl 이성질체 중, biphenyl, PCB-1, 및 PCB-3은 A. niger에 의하여 매우 빠른 속도로 대사되어 배양 7일 후, 38-65% 내외의 모화합물이 수용성 대사물로 전환되었으나, PCB-38의 경우, 극소량의 대사물이 형성되었고(2%), PCB-126은 모화합물의 대사가 전혀 관찰되지 않았다. 한편 염소 치환기가 ortho-위치에 존재하는 PCB-1과 para-위치에 존재하는 PCB-3의 대사속도를 비교한 결과, PCB-3의 대사 속도가 현저히 큰 값을 보였으며, 이는 biphenyl ring의 3차원 형태와 관련된 것으로 생각된다. 미생물 반응 중, 형성된 주요 대사물은 mono- 및 di-hydroxy PCB로 사료되며, 해당 물질의 독성화학적 성상은 지속적 연구가 필요할 것으로 사료되었다.
Abstract
As of many organochlorine pesticides, polychlorinated biphenyls are ubiquitous organic contaminants, which can be found in the most environmental matrices. Their toxic effects include endocrine-disrupting activity. Most researches with these toxicants performed with mixtures of congeners, namely Aroclor and related study has been done in complex environmental matrix, rather than single biosystems or pure congeners. 5 congeners were synthesized and their fates in pure microbial culture (Aspergillus niger) were determined in this study. Among biphenyl and synthetic congeners, biphenyl, PCB-1 (2-chlorobiphenyl), and PCB-3 (4-chlorobiphenyl) were rapidly transformed to hydrophilic metabolites, followed by PCB-38 (3,4,5-trichlorobiphenyl), while the degradation of PCB-126 (3,3',4,4',5-pentachlorobiphenyl) was not observed. The amounts of transformation for biphenyl, PCB-1, PCB-3, and PCB-38 were 65, 38, 52, and 2% respectively. The major metabolites of the above congeners were identified as mono- and di-hydroxy biphenyls, which are known to give adverse endocrinological effects.
Keywords:
Polychlorinated biphenyl, soil, microorganism, biodegradation, Aspergillus niger서 론
Polychlorinated biphenyls (PCBs)은 다핵방향족 탄화수소 및 유기염소계 농약과 더불어 자연환경 중 매우 광범위하게 검출되는 잔류성 유기오염물이다. PCBs의 산업적 응용은 1930년대부터 시작되어, 전기 절연제 및 불연제로서 특히 북미권 국가에서 장기간 사용되었다(George et al. 1988; Ross 2004). 그러나 생물독성 및 환경 잔류성 등의 문제점은 1960년대 후반부터 지적되어 왔으며, 일본 및 타이완 등의 아시아권 국가에서도 인축 독성, 특히 생식관련 독성에 대한 문제가 비슷한 시기에 제기되었다(Rogan et al. 1988). PCBs는 염소의 치환갯수 및 위치에 따라 209종의 이성질체가 존재하며, 종류에 따라 다수의 상이한 독성을 나타내는 것이 알려져 있다(Giesey and Kannan 1998; Ross 2004). 예를 들면 PCB-126 (3,3',4,4',5-pentachlorobiphenyl)과 같은 PCB 이성질체는 두 phenyl ring이 동일 평면에 존재하며(Co-planar PCB), 이와 같은 이성질체의 경우, tetrachlorodibenzo-p-dioxin (TCDD)과 유사한 내분비장애 및 발암성 등의 독성을 나타내는 것이 보고되었다(Ross 2004). PCB는 상기한 포유동물의 내생 호르몬계 교란 작용 이외에도 다양한 생물독성을 나타내는 것으로 알려져 있다. Aroclor 1254는 토양 및 작물 재배 환경 중 광범위하게 발견되는 Aspergillus속 진균의 생장을 억제하는 것으로 알려져 있다(Murado et al. 1976). Weber 등은 동일한 PCB 혼합물을 처리한 대두 및 화본과 목초식물에서 생육억제 효과를 보고하였으며, 활성탄 처리에 의하여 PCB의 생육저해 효과를 감소시킬 수 있다고 보고하였다(Weber and Mrozek 1979).
토양을 비롯한 환경 매체에 함유된 PCB는 생물학적 또는 화학적 반응을 통하여 관련 대사산물로 전환되는 데, 생물학적 분해의 경우, 세균, 진균 및 식물에 의한 다양한 사례가 보고되어 있다(Abramowicz 1990; Mousa et al. 1998; Pieper and Seeger 2008; Ruiz-Aguilar et al. 2002; Wilken et al. 1995). 이와 같은 대사 중, 혐기성 환경에서도 진행되는 환원적 탈염소화과정(reductive dechlorination)의 경우, 치환 염소의 개수의 감소와 함께, 생물학적 분해가 비교적 용이한 이성질체로 전환되는 것으로 알려져 있다(Wiegel and Wu 2000). PCB 이성질체의 호기적 대사에 의하여 형성되는 대사물로는 hydroxy PCB 및 methoxy PCB 등이 대표적이며, 일부 hydroxy PCB 이성질체의 경우, estrogen 유사활성을 나타내어 내분비계 장애를 유발할 수 있는 것으로 보고되었다(Machala et al. 2004). 이와 같은 hydroxylation 반응 산물은 모화합물과 비교하여 수용해도 등의 환경 중 이동에 관련된 물성에 영향을 미치며, 목본 식물을 이용한 최근 연구에 따르면 다수의 대사물이 모화합물과 비교하여, 용이하게 식물에 의하여 흡수-이행됨이 확인되었다(Zhai et al. 2014). 식물 및 미생물을 대상으로 수행된 PCB 관련 연구는 대부분 토양/저니토 등의 환경 매질 중 PCB 혼합물인 Aroclor를 이용하여 이루어졌으며, 개별 미생물 또는 이성질체를 활용한 실험은 제한적으로 실시되었다. 따라서 환경 중, 특정 생물군에 의한 PCB의 분해/소실에 대한 체계적 평가를 위한 자료가 부족하다고 사료된다.
본 연구에서는 다양한 polychlorinated biphenyl 이성질체 중, 구조적 특성이 상이한 5종의 이성질체를 Suzuki coupling법을 활용하여 합성하고, 토양 미생물의 일종으로서 토양 및 식품 전반에 광범위하게 검출되는 것으로 알려진 Aspergillus niger에 의한 대사과정을 밝히고자 하였다.
재료 및 방법
재료 및 시약
Biphenyl 표준품(>98%) 및 bromobenzene 유도체(1-bromo-2-chlorobenzene, 1-bromo-4-chlorobenzene, 4-bromo-1,2-dichlorobenzene, 5-Bromo-1,2,3-trichloro-benzene)는 Alfa Aesar Korea (서울)에서 구입하였고, palladium tetrakis(triphenylphosphine) (Pd (PPh3)4)및 PCB 합성 관련 유기용매는 HPLC급으로 Sigma-Aldrich Korea 및 Fisher Scientific(USA)에서 구입하여 사용하였다. 기타 시약으로 크로마토 그래피용 silica gel은 Merck사의 제품을 사용하였으며, ethyl acetate 등 대사물 추출용 용매는 대정사의(Korea) 제품을 구입, 사용하였다. 대사물의 trimethylsilyl (TMS) 유도체화는 Sigma-Aldrich 사의 N,O-bis (trimethylsilyl) trifluoroacetamide-trimethylchlorosilane (BSTFA-TMCS) 용액을 사용하였다.
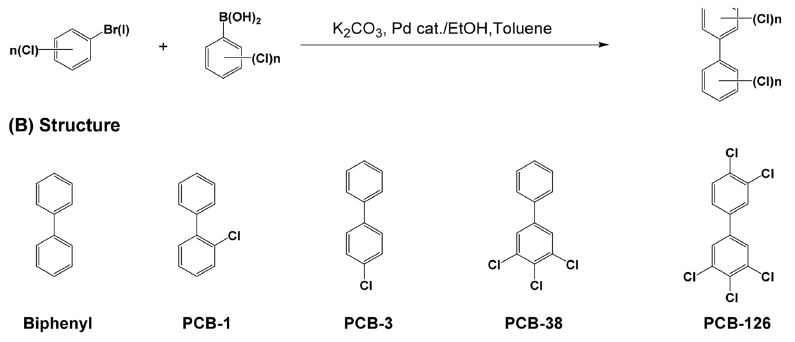
PCB 이성질체의 합성
PCB 이성질체별 미생물 분해 연구를 위하여 소요된 PCB 이성질체는 chlorophenylboronic acid 및 bromo-chlorobenzene을 기초로 하여, Suzuki coupling 법을 이용하여 합성하였다(Fig. 1) (Lehmler and Robertson 2001). 대표적 합성법으로 PCB-126 (3,3',4,4',5-pentachlorobiphenyl)은 아래의 방법으로 수행하였다. 5-Bromo-1,2,3-trichlorobenzene (2mmole) 및 촉매(50 mg, Pd (PPh3)4의 toluene 용액(20 mL)에 K2CO3 수용액(2 M, 2 mL)을 가하고, 질소 환경 중에서 3,4-dichlorobenzeneboronic acid (2 mmole, ethanol, 4 mL) 용액을 첨가하였다. 혼합물을 질소로 5분 내외 처리하여, 용액 중 산소를 제거한 다음, 80-100°C에서 8시간 동안 교반하였다. 반응물에 과산화수소(38%, 5 mL)을 가하여 2시간 동안 교반 후, 증류수(200 mL) 및 ethyl acetate (300 mL)을 가하여 합성 PCB를 추출하였다. Ethyl acetate 추출물을 silica gel 컬럼에 가하고 hexane, hexane/ethyl acetate 혼합물을 이용하여 PCB-126을 순수분리하였다.
PCB 이성질체의 미생물 처리 및 배양
실험에 사용한 Aspergillus niger는 건국대학교 미생물학 연구실에서 분양받아 사용하였다. 해당 균주는 potato dextrose agar (Difco Laboratories) 배지를 이용, 27°C에서 5일간 고체상 배양을 실시하였다. 고상 배지에서 직경 1 cm 내외의 2-3개의 균사체 disk를 채취하여 potato dextrose broth (120 mL, Difco Laboratories)에 가한 다음, 3일간 추가 배양한 다음, PCB 표준품 용액(2000 ppm, 0.5mL, dimethyl sulfoxide)을 가하여 27°C, 200 rpm 조건에서 진탕배양을 실시하였다. 실험구는 PCB 이성질체별로 3반복으로 수행하였다.
PCB 및 대사물의 추출 및 유도체화
균사체가 포함된 상기의 배양액에 묽은 염산(1 N, 15 mL) 및 포화식염수(100 mL)를 가하고 Waring blendor를 이용, 2분간 마쇄하였다. 배양액을 감압여과 후, 잔사는 ethyl acetate (200 mL)를 가하여 세정하고 여액을 합하였다. PCB 및 대사물은 상기의 여액에 ethyl acetate (200 mL*2)를 추가하여, 진탕 추출하였다. Ethyl acetate 추출물을 합한 다음, 무수 Na2SO4를 통과시키고, 여액을 감압 건고하였다. 잔사는 ethyl acetate (10 mL)에 용해하고, 이 가운데 1 mL를 취하여 아래와 같이 trimethylsilyl 유도체화를 실시하였다. 감압하에서 ethyl acetate를 제거하고, 잔사는 pyridine (0.9 mL)에 녹이고, BSTFA-TMCS (0.1 mL)를 가하였다. 상기 혼합물을 75°C에서 1.5시간 동안 가열하여 유도체화를 수행하였다. 배양 후 7일차 시료의 경우, 균사체에 의한 PCB의 흡착효과 검정을 위하여, 배양액과 균사체를 분리하여 상기의 추출을 실시하고, 각 분획에 대하여 분석을 수행하였다.
분석기기 및 분석조건
PCB 및 대사물의 분석은 Shimadzu GC-2010/SE GC-MS로 수행하였으며, Restek사의 Rtx-5MS (30 m, 0.25 mm i.d., 0.25 μm thickness) column을 사용하였다. Column 온도조건은 초기온도 170°C로 10분간 유지 후, 2°C/분로 승온하여 290°C에서 20분간 유지하였으며, injector 온도는 250°C, interface 온도는 275°C로 설정하였고, Helium carrier gas는 1 mL/분으로 유지하였다.
PCB congener의 물성 예측
Biphenyl 및 PCB congener의 logP 및 기타 계산화학적 물성은(예: dipolemoment, charge 등) Hypercube사의 HyperChem (ver. 8.0, USA)을 이용하여 구하였다.
결과 및 고찰
Biphenyl 및 PCB congener의 소실속도
Biphenyl을 비롯한 방향족 물질의 생물학적 대사는 다양한 물리화학적 성상에 의하여 결정되며, 이와 같은 성상으로는 화합물의 유기물 흡착 및 수용성과 관련한 logP, 수용해도, 가수분해 안정성 등이 있다. LogP 및 Koc 등으로 대표되는 물질의 용해도 및 흡착 관련 인자는 미생물에 의한 유기물의 분해속도의 주요한 결정인자로 알려져 있다(Sabjic and Nakagawa 2014).
PCB의 미생물 대사와 관련된 연구는 대부분 세균을 대상으로 실시되었으며, Pseudomonas 및 Alicaligenes 속 미생물을 이용한 기내 실험의 경우, 상기한 바와 같이 congener의 지용성이 증가할수록 생분해 속도가 감소됨이 보고되었다(Dercova et al. 1996). PCB의 지용성은 치환 염소의 수가 증가할수록 증대되며, 관련 물질의 logP는 4.0 (biphenyl)-10.1 (PCB209)로 알려져 있다(Shiu and Mackay 1986).
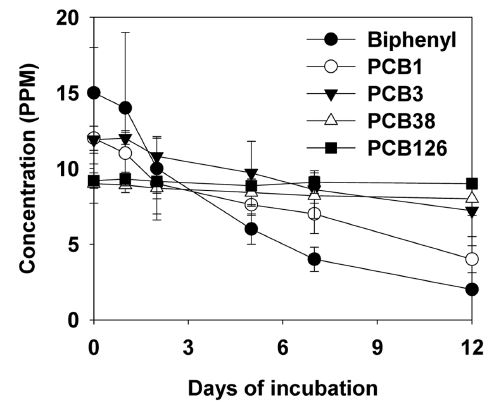
본 연구에서의 biphenyl 및 4종 PCB congener의 A. niger에 대한 경과시간별 소실 연구결과는 아래와 같았다(Fig. 2 및 Table 1). 다양한 기질물질의 분해 속도는 biphenyl > PCB1 > PCB3 > PCB38 > PCB126의 순으로 나타났다. 개별 물질의 logP는 3.73 (biphenyl), 4.25 (PCB1 및 3), 5.29 (PCB38) 및 6.32 (PCB126)로 예측되었으며, PCB congener의 분해속도는 logP가 증가할수록 감소하는 것으로 나타났다. 배양시간에 따른 biphenyl 및 PCB congener의 분해는 농약을 비롯한 유기물의 환경 중 분해에서 일반적으로 관찰되는 일차반응을 따르는 것으로 나타났다(Table 1). 배양 과정 중 반감기는 3.7 (biphenyl)-67.3일 (PCB38)로 관찰되었으며, PCB126의 경우, 뚜렷한 감소현상이 나타나지 않았다.
한편 계산 화학적 방법으로 동일한 logP를 지닌 것으로 예측된 PCB1 및 3의 대사속도는 현저하게 차이가 있는 것으로 나타났는데, 이와 같은 차이는 PCB의 생분해와 관련된 효소군에(예: cytochrome P450) 대한 친화도와 관련 있는 것으로 추정되고 있다(Inui et al. 2014). 그러나 미생물의 관련 효소에 대한 상세 연구는 미비하며, 이에 대한 추가 연구가 필요하다고 하겠다.
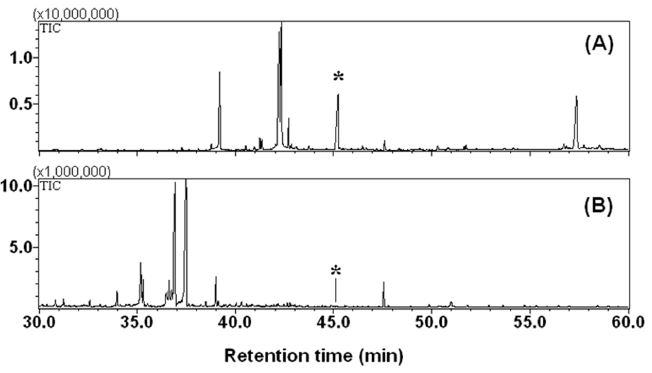
토양환경 중, 유기물의 생분해는 해당 물질의 토양흡착계수(Koc)와 상관관계가 있는데, 흡착계수가 지나치게 높은 물질의 경우, 미생물의 분해에 사용할 수 있는 용액 중 물질 농도가 매우 낮으며, 따라서 생분해 역시 지연된다(Weissenfels et al. 1991). 이와 같은 생물 유효도(bioavailability)와 관련하여 본 연구에서는 비교적 지용성이 높은 PCB38 및 PCB126의 배양액 및 균사체중 농도를 분석하였다. 그 결과, PCB126의 경우, 대부분의 화합물이 균사체에 흡착된 형태로 존재함을 알 수 있었다(Fig. 3).
Biphenyl 및 PCB congener의 대사경로
Biphenyl 및 PCB congener 배양액 및 균사체 추출물을 GC-MS로 분석한 결과, 다양한 대사물의 형성을 확인할 수 있었다. 주요 대사물로서 biphenyl ring에 수산기(hydroxy)가 1-3개 치환된 물질이 확인되었으며, 배양 경과시간에 따라 다수의 수산기를 보유한 대사물이 생성되었다(Fig. 4, 5 및 Table 2).
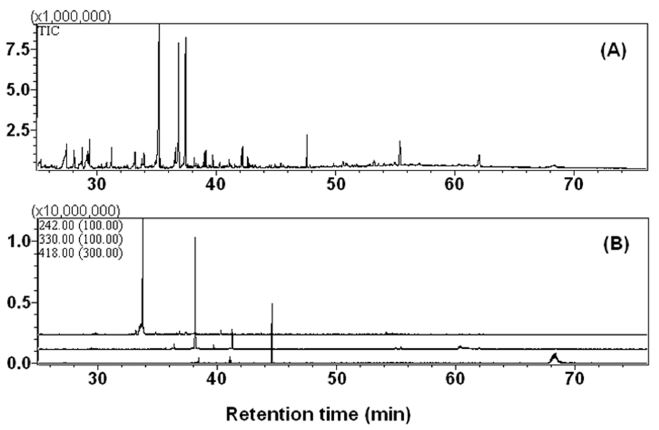
Total ion chromatograms (A) and multiple ion chromatograms (B) of culture medium of Aspergillus niger, treated with biphenyl after 5 days of incubation. m/z 242 (top), 330 (middle), and 418 (bottom) for mono-, di-, and tri-hydroxybiphenyl TMS derivatives.
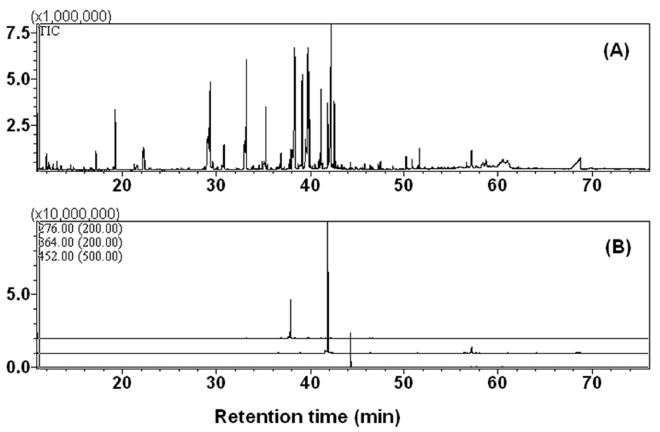
5. Total ion chromatograms (A) and multiple ion chromatograms (B) of culture medium of Aspergillus niger, treated with PCB3 after 7 days of incubation. m/z 276 (top), 364 (middle), and 452 (bottom) for mono-, di-, and tri-hydroxy PCB3 TMS derivatives.
Biphenyl의 경우, 4종의 대사물이 형성되었으며, 최대 3개의 수산기가 도입된 대사물이 확인되었다(Table 2). 이 가운데 대사물 1 및 3은 표준물질을 이용하여, 각각 4-hydroxybiphenyl 및 4,4'-dihydroxybiphenyl로 최종 확인되었다. Biphenyl을 비롯한 일부 PCB 이성질체의 경우, 2개의 수산기가 도입된 대사물이 다수 발견되었다. Paecilomyces를 이용한 기존 연구에서도 biphenyl의 대사물로 3,4-dihydroxybiphenyl 및 4,4'-dihydroxybiphenyl이 발견된 바 있다(Gesell et al. 2001). 한편 PCB1을 비롯한 PCB congener의 수산화 대사물의 확인은 대사물의 mass spectrum 중 염소동위원소에 의한 동위원소 peak의 존재 유무 및 상대비, trimethylsilyl기 도입에 의하여 증가된 분자량(M+72) 등으로 확인하였다. 주요한 분해산물로 1-3개의 수산기가 도입된 대사물을 확인할 수 있었으며, 1-2개의 수산화물이 대부분이었다 (Table 2). PCB의 토양 미생물에 의한 생분해 연구 중, 진균에 의한 연구는 주로 백색부후균(white-rot fungi)을 대상으로 수행되었으며, 수산화 대사물과 함께, 다수의 chlorobenzoic acid계 대사물이 보고되었다(Cvancarova et al. 2012). Pleurotus 등의 백색부후균은 다양한 peroxidase 및 활성 산소 기반의 유기물 분해 효소군을 분비하는 것이 알려져 있으며, Aspergillus 등과 같이 토양 중에 다량 존재하는 일반적인 진균과는 생리-생화학적으로 큰 차이가 있다. 본 연구의 경우, 균사체 및 배양액 전반에 대한 세부적 분석을 수행하였으나, 백색부후균에서 일반적으로 검출된 chlorobenzoic acid 유사체는 검출되지 않았다. 이상의 결과에 따라 A. niger에 의한 PCB의 대사는 수산기 도입 반응을 통하여 주로 진행되며, congener의 지용성 및 염소의 치환위치에 따라 상이한 대사속도를 나타냄을 알 수 있었다.
결 론
본 연구는 토양 환경 중, PCB의 식물로의 흡수/이행 관련 연구의 일환으로 다양한 PCB 이성질체의 식물에 대한 흡수/이행에 영향을 미칠 수 있는 주요 인자 중 하나인 미생물 대사에 관한 연구를 수행하였다. 세부 연구에 소요되는 표준품인 PCB-1, 3, 38 및 126을 개선된 Suzuki coupling법으로 합성하였으며, GC-MS 등의 기기 분석 및 유도체화 반응을 통하여 적절한 정량 및 정성 분석법을 확립하였으며, 이를 활용하여 토양 환경 중 일반적으로 검출되는 것으로 알려진 A. niger 중 대사 속도 및 대사 경로를 규명하고자 하였다. Biphenyl 및 PCB 이성질체의 대사속도는 치환 염소의 개수가 증가할수록 감소되어, TCDD-관련 독성이 가장 높은 것으로 알려진 PCB-126은 A. niger에 의한 분해가 관찰되지 않았다. 주요 대사물로서 1-3개의 수산기가 도입된 hydroxy PCB가 검출되었다. 한편 PCB-1 및 PCB-3의 소실 속도의 차이로 볼 때, PCB 이성질체의 생분해는 PCB의 3차원 구조와 상관관계가 있는 것으로 사료되었다.
Acknowledgments
본 연구는 농촌진흥청의 연구개발비(작물 재배환경 중 유해화학물질의 안전관리기준 설정 연구, 과제번호 PJ011435)로 수행되었으며 이에 감사드립니다.
References
-
Abramowicz, D. A., (1990), Aerobic and anaerobic biodegradation of PCBs: a review, Crit. Rev. Biotechnol, 10, p241-251.
[https://doi.org/10.3109/07388559009038210]

-
Cvancarova, M., Z. Kresinova, A. Filipova, S. Covinoa, and T. Cajthaml, (2012), Biodegradation of PCBs by ligninolytic fungi and characterization of the degradation products, Chemosphere, 88, p1317-1323.
[https://doi.org/10.1016/j.chemosphere.2012.03.107]

-
Dercova, K., B. Vrana, S. Balaz, and A. Sandorova, (1996), Biodegradation and evaporation of polychiorinated biphenyls (PCBs) in liquid media, J. Ind. Microbiol, 16, p325-329.
[https://doi.org/10.1007/BF01570042]

-
George, C. J., G. F. Bennet, D. Simoneaux, and W. J. George, (1988), Polychlorinated biphenyls a toxicological review, J. Hazard. Mater, 18, p113-144.
[https://doi.org/10.1016/0304-3894(88)85018-0]

-
Gesell, M., E. Hammer, M. Specht, W. Francke, and F. Schauer, (2001), Biotransformation of biphenyl by Paecilomyces lilacinus and characterization of ring cleavage products, Appl. Environ. Microbiol, 67, p1551-1557.
[https://doi.org/10.1128/AEM.67.4.1551-1557.2001]

-
Giesey, J. P., and K. Kannan, (1998), Dioxin-like and non-dioxinlike toxic effects of polychlorinated biphenyls (PCBs): implications for risk assessment, Crit. Rev. Toxicol, 28, p511-569.
[https://doi.org/10.1080/10408449891344263]

-
Inui, H., T. Itoh, K. Yamamoto, S. Ikushiro, and T. Sakaki, (2014), Mammalian cytochrome P450-dependent metabolism of polychlorinated dibenzo-p-dioxins and coplanar polychlorinated biphenyls, Int. J. Mol. Sci, 15, p14044-14057.
[https://doi.org/10.3390/ijms150814044]

-
Lehmler, H. J., and L. W. Robertson, (2001), Synthesis of hydroxylated PCB metabolites with the Suzuki-coupling, Chemosphere, 45, p1119-1127.
[https://doi.org/10.1016/S0045-6535(01)00052-2]

-
Machala, M., L. Blaha, H. J. Lehmler, M. Pliskova, Z. Majkova, P. Kapplova, I. Sovadinova, J. Vondracek, T. Malmberg, and L. W. Robertson, (2004), Toxicity of hydroxylated and quinoid PCB metabolites: inhibition of gap junctional intercellular communication and activation of aryl hydrocarbon and estrogen receptors in hepatic and mammary cells, Chem. Res. Toxicol, 17, p340-347.
[https://doi.org/10.1021/tx030034v]

- Mousa, M. A., P. E. Ganey, J. F. Quensen, B. V. Madhukar, K. Chou, J. P. Giesey, L. J. Fischer, and S. A. Boyd, (1998), Altered biologic activities of commercial polychlorinated biphenyl mixtures after microbial reductive dechlorination, Environ. Health Perspect, 106(S6), p1409-1418.
-
Murado, M. A., M. C. Tejedor, and G. Baluja, (1976), Interactions between polychlorinated biphenyls (PCBs) and soil microfungi. Effects of Aroclor 1254 and other PCBs on Aspergillus flavus cultures, Bull. Environ. Contam. Toxicol, 15, p768-774.
[https://doi.org/10.1007/BF01685631]

-
Pieper, D. H., and M. Seeger, (2008), Bacterial metabolism of polychlorinated biphenyls, J. Mol. Microbiol. Biotechnol, 15, p121-138.
[https://doi.org/10.1159/000121325]

-
Rogan, W. J., B. C. Gladen, K. L. Hung, S. L. Koong, L. Y. Shih, J. S. Taylor, Y. C. Wu, D. Yang, N. B. Ragan, and C. C. Hsu, (1988), Congenital poisoning by polychlorinated biphenyls and their contaminants in Taiwan, Science, 241, p334-336.
[https://doi.org/10.1126/science.3133768]

-
Ross, G., (2004), The public health implications of polychlorinated biphenyls (PCBs) in the environment, Ecotoxicol. Environ. Safe, 59, p275-291.
[https://doi.org/10.1016/j.ecoenv.2004.06.003]

-
Ruiz-Aguilar, G. M. L., J. M. Fernandez-Sanchez, J. Rodriguez-Vazquez, and H. Poggi-Varaldo, (2002), Degradation by white-rot fungi of high concentrations of PCB extracted from a contaminated soil, Adv. Environ. Res, 6, p559-568.
[https://doi.org/10.1016/S1093-0191(01)00102-2]

-
Sabljic, A., and Y. Nakagawa, (2014), Biodegradation and quantitative structure-activity relationship (QSAR), In Chen, W., Sabljic, A., Cryer, S.A., Kookana, R.S. (eds), ACS symposium series vol 1174 Non-first order degradation and time-dependent sorption of organic chemicals in soil, Washington DC, American Chemical Society, p57-84.
[https://doi.org/10.1021/bk-2014-1174.ch004]

-
Shiu, W. Y., and D. Mackay, (1986), A critical review of aqueous solubilities, vapor pressures, Henry's law constants, and octanol-water partition coefficients of polychlorinated biphenyls, J. Phys. Chem. Ref. Data, 15, p911-929.
[https://doi.org/10.1063/1.555755]

-
Weber, J. B., and E. Mrozek, (1979), Polychlorinated biphenyls: phytotoxicity, absorption and translocation by plants, and inactivation by activated carbon, Bull. Environ. Contam. Toxicol, 23, p412-417.
[https://doi.org/10.1007/BF01769980]

-
Weissenfels, W. D., H. J. Klewer, and J. Langhoff, (1991), Adsorption of polycyclic aromatic hydrocarbons (PAHs) by soil particles: influence on biodegradability and biotoxicity, Appl. Microbiol. Biotechnol, 36, p689-696.
[https://doi.org/10.1007/BF00183251]

-
Wiegel, J., and Q. Wu, (2000), Microbial reductive dehalogenation of polychlorinated biphenyls, FEMS Microbiol. Ecol, 32, p1-15.
[https://doi.org/10.1111/j.1574-6941.2000.tb00693.x]

-
Wilken, A., C. Bock, M. Bokern, and H. Harms, (1995), Metabolism of different PCB congeners in plant cell cultures, Environ. Toxicol. Chem, 14, p2017-2022.
[https://doi.org/10.1002/etc.5620141203]

-
Zhai, G., S. M. Gutowski, H. J. Lehmler, and J. L. Schnoor, (2014), Enantioselective transport and biotransformation of chiral hydroxylated metabolites of polychlorinated biphenyls in whole poplar plants, Environ. Sci. Technol, 48, p12213-12220.
[https://doi.org/10.1021/es503443e]