
커피박 퇴비와 벨벳콩을 이용한 호박의 고구마 뿌리혹선충 방제효과
초록
본 연구는 커피박 퇴비와 벨벳콩 식물체 분말 처리에 따른 고구마뿌리혹선충 살충효과를 평가하였다. 커피박 퇴비와 벨벳콩 식물체 분말 처리중, 1% 벨벳콩 식물체 분말 처리가 뿌리혹선충의 살충율이 83.2%로 가장 높게 나타났다. 또한 실내에서 호피무늬 벨벳콩 추출물 농도별로 처리한 시간의 경과에 따라 뿌리혹선충 유충의 치사율이 증가하였다. 호피무늬 벨벳콩 추출물 처리 24시간 후, 1.2%와 2.4% 농도에서 뿌리혹선충 유충의 치사율이 가장 높게 나타났다. 커피박 퇴비와 벨벳콩 식물체 분말 처리가 호박유묘의 생육에 미치는 영향을 조사하였더니 20% 커피박 퇴비 처리구는 호박 유묘의 생육을 억제하였으나 1% 호피무늬 벨벳콩 분말 처리구가 호박 유묘의 생육촉진효과가 가장 뛰어났다. 하지만 유기성 자원인 벨벳콩과 커피박 퇴비를 이용하여 유기농 호박 재배토양에서 발생하는 고구마뿌리혹선충을 효과적으로 방제하기 위한 재료로 사용하기 위해서는 처리농도와 방법에 대한 추가적인 연구가 필요할 것으로 생각한다.
Abstract
The purpose of this study was to control root-knot nematode, Meloidogyne incognita on pumpkin seedling with 10%, 20% coffee ground compost and 1% plant velvet bean powder (plain skin bean, leopard skin bean, hole plant, bean pod). Among the root-knot nematode insecticide treatments, the velvet bean plant powder was the highest mortality rate with 83.2% in greenhouse condition. In addition, the root-knot nematode second juvenile mortality significantly increased with the lapse of processing time for each concentration of leopard skin velvet bean extract in vivo. After 24 hours, the mortality rate of root-knot nematode showed the highest at 1.2% and 2.4% of leopard skin velvet bean extract. The growth promoting effect of seedlings pumpkin, 20% of coffee ground compost treatments inhibited the growth of pumpkin seedlings and 1% the tiger pattern velvet beans powder was the most to promote the growth of pumpkin seedlings. However, the results indicated that the organic materials of velvet beans and coffee ground compost are expected to be able to effectively control the root-knot nematode and further studies will be needed for the concentration and application methods.
Keywords:
coffee ground compost, Mucuna pruriens, Meloidogyne incognita키워드:
커피박 퇴비, 벨벳콩, 뿌리혹선충서 론
뿌리혹선충류(Meloidogyne spp.)는 세계적으로 78종이 분포하며 국내에는 M. arenaria (Choi, 1978; Choi and Choo, 1978), M. crucianai (Choo, 1985), M. hapla (Choi, 1978; Choi and Choi, 1982), M. hispanica (Hirschmann, 1986), M. incognita (Choi, 1978; Choi and Choi, 1982), and M. javanica (Choi, 1978; Choi and Choo, 1978) 등 6종의 뿌리혹선충이 서식하며, 고추, 땅콩, 참외, 당근, 들깨, 토마토, 오이, 호박 등 2,000여종의 식물을 기주로 감염이 가능하며, 식물기생성 선충 감염으로 인한 작물 피해의 절반을 야기하는 것으로 알려져 있다(Cho et al., 2000; Choi and Choi,1982; Gowen et al., 2005; Kim et al., 2001; Taylor and Sasser, 1978). 최근 국내에서는 54%의 시설재배 지역이 뿌리혹선충이 오염되어 있으며(Cho et al., 2000; Kim, 2001), 중요한 원인은 연중 작물을 재배함으로써 과채류, 엽채류, 화훼류 등 다양한 작물재배지에서 연작장해의 주요 요인으로 뿌리혹선충의 경제적 피해가 증가하고 있다(Choo et al., 1990; Kim and Lee, 2008; Park et al., 1995; Shin et al., 1998).
뿌리혹선충의 침입에 의한 전형적인 피해증상은 작물의 생육이 불량하고, 낮에 시들음증상이 나타나며 심할 때는 잎이 황화되어 진전되면 죽는 경우도 있다(Yeon et al., 1996). 특히 호박을 포함한 과채류의 경우 감염시 외부로는 뚜렷한 증상이 나타나지 않으나 생육 중기부터 갑자기 시들기 시작하여 뿌리에 구형 또는 타원형의 혹을 형성하고, 여기에 식물성 병원균이 침입하여 뿌리가 부패하면서 고사한다(Choo et al., 1990). 뿌리혹선충은 식물의 뿌리 세포들로부터 직접 양분을 흡수하는데 토양 내 선충 밀도의 증가와 식물에 나타나는 피해 정도는 높은 상관관계를 가지는 것으로 알려져 있다(Kim and Choi, 2001; Kim et al., 2001).
현재 시설재배지에서 뿌리혹선충을 방제하기 위하여 저항성 품종(Baek, 2004; Kim et al., 2010), 작부체계 변경(Bridge, 1996), 토양 개량(Park et al., 1995), 태양열소독(Chon et al., 1996), 화학적 방제(Kim et al., 2015), 생물학적 방제(Ha et al., 2014; Liang et al., 2010; Park et al., 2004; Radwan et al., 2013), 식물추출물(Bawa et al., 2014; Elbadri, et al., 2014; Kim et al., 1998; Kim et al., 2014) 등의 방제기술들이 개발되고 있다(Kim and Choi, 2001). 화학합성 농약은 적은 양으로도 효과가 좋고 가격이 저렴하여 소득증대에 큰 역할을 했지만, 계속 문제가 되어 왔던 환경오염, 농작물의 잔류 독성 등의 문제가 사회적으로 부각되었다(Chitwood, 2002). 또한 소비자들의 농약 사용에 대한 부정적인 인식이 증가함에 따라 유기농산물에 대한 수요가 증가하고 있다(Kim and Lee, 2008; Washira et al., 2009).
관행농업에서는 뿌리혹선충을 방제하기 위해 Aldicarb, Cadusafos, Carbosulfan, Imicyafos, 등 다양한 선충 방제용 화학농약들이 개발되어 왔으나 친환경 유기농업에서는 이러한 화학농약을 대신할 수 있는 식물성 물질을 이용한 친환경적인 식물기생성 선충을 방제하기 위해 많은 연구들이 진행되어 오고 있다. 남아프리카는 무환자나무과의 Hippobromus pauciflorus (McGaw et al., 2007), 이스라엘은 은매화(Myrtus communis, Oka et al., 2012), 인도는 개박하(Nepeta cataria, Pavaraj et al., 2012)와 후추류(Piper betle) (Wiratno et al., 2009), 일본은 국화과 초본류인 흰도깨비비늘(Bidens piloda var. radiata, Satoshi et al., 2008), 수단은 가시아카시아(Acacia nilotica), (Elbadri et al., 2008) 등의 식물이 살선충 효과가 있는 것으로 보고하였다. 국내에서는 소나무재선충(Bursaphelenchus xylophilus)에 대하여 석창포(Acorus gramineus), 족도리풀(Asiasarum sieboldi), 팔각향(Illicium verum), 산내자(Kaempferia galanga)에서 살선충 효과를 보고한 바 있다(Choi et al., 2006). 또한 당근뿌리혹선충(M. hapla)의 난낭 발생을 억제하는 것으로 만수국(Tagetes patula), 잔디(Zoysia japonica), 산검양옻나무(Rhus sylvestris), 붉나무(Rhus chinensis), 양파(Allium cepa) 추출액을 토양에 처리하면 된다고 보고 하였다(Kim et al., 1998).
벨벳콩(Mucuna spp.)은 농업적 활용성이 높은 일년생 콩과식물로 20세기 초 미국에서 사료용과 녹비용 피복작물로 널리 사용되어왔다. 특히, 벨벳콩은 토양 피복에 의한 토양침식 경감, 질소 고정, 경쟁과 타감물질 분비에 의한 잡초억제 효과 외에 식물기생성 선충의 밀도를 감소시키는 효과가 있는 것으로 보고되어 있다(Chavarría and Rodríguez, 1998; Fujii, 1999; Vargas and Rodríguez., 2001; Zasada et al., 2006). 3종의 선충(M. arenaria, M. incognita, M. javanica)이 혼재되어 있는 토양에 콩과 피복작물인 벨벳콩(M. pruriens)과 크로타라리아(Crotalaria spectabilis)를 토양에 혼화 처리하였을 경우 전혀 증식하지 못하였으며 뿌리혹선충의 부화율이 20% 이하로 매우 낮게 조사되었다(Osei et al., 2010).
유기성 폐기물인 커피박의 생성은 세계적으로 연간 6백만 톤 이상으로 추산됨으로써(Tokimoto et al., 2005) 재활용 연구가 한창이며 연료소재, 사료 또는 비료 첨가물(Saenger et al., 2001; Silva et al., 1998), 기능성 물질 소재원, 바이오디젤 원료(Franca et al., 2009) 또는 버섯재배용 배양토 혼합물 (Machado et al., 2012)로서의 이용이 연구되고 있다.
본 연구의 목적은 유기농 호박재배시 문제가 되는 고구마뿌리혹선충을 방제하기 위해 벨벳콩과 커피박 등을 포함한 식물성 유기자원을 이용한 방제기술을 개발하여 토양 건전성을 증진시키고, 토양 내 뿌리혹선충의 밀도를 점진적으로 줄여 경제적 피해를 지속적으로 경감시킬 수 있는 방법을 적용해보기 위하여 수행하였다.
재료 및 방법
커피박 퇴비 및 벨벳콩 식물체 준비
벨벳콩(Mucuna pruriens)은 경상북도농업기술원 유기농업연구소로부터 2014년 분양받아 온실에서 증식하여 종자와 콩꼬투리를 확보하였고, 2015년 전북 완주군의 국립농업과학원 유기농업과 유기농격리포장에 5월 말경 벨벳콩 유묘를 정식하여 벨벳콩의 지상부와 지하부 부위별로 개화기에 예취하여 그늘에서 풍건하여 건조시켰으며, 균일한 시험을 위하여 농업용 분쇄기로 절단 후 식물분쇄기를 이용하여 고운 분말(< 0.1 mm)로 분쇄하여 이용하였다. 벨벳콩 식물체는 크게 벨벳콩(아이보리색 민무늬(plain pattern)콩, 호피무늬(tiger pattern)콩), 벨벳콩의 줄기와 잎을 포함한 식물체전체(plant of velvet bean)와 벨벳콩을 감싸고 있는 콩꼬투리(sprout of velvet bean) 등 4가지로 나누어 처리하였다.
커피박 퇴비는 커피전문점으로부터 커피박 추출 후 버려지는 커피박을 수거한 후 풍건하여 수분을 제거한 후 사용하였으며, 질소원으로 사용한 깻묵은 충북 영동군 재래시장에서 확보하여 커피박과 7:3의 비율로 혼합한 후, 수분함량을 30%로 조절하여 50 L의 플라스틱 원통에 넣고 공기를 주입하고 2주간격으로 1회 정도 뒤집기를 하여 커피박 퇴비의 부속온도를 50°C 이상 2개월간 유지하면서 부숙시켜 제조하였다. 커피박 퇴비의 완성도는 커피박 퇴비의 온도가 더 이상 올라가지 않은 시점에서 다시 최소 30일 간 후숙과정을 거쳐 커피박 퇴비를 제조하여 시험에 사용할 수 있도록 결정하였다.
4종류의 벨벳콩 식물체 부위별 분말 재료와 커피박 퇴비의 처리농도는 처리하고자 하는 토양의 작토층을 10 cm로 추정하고 부피로 환산하여 벨벳콩 식물체는 1% 농도로, 커피박 퇴비는 10%와 20% 농도로 개량한 후, 소량의 토양에 혼화 처리한 후 다시 토양의 양을 증가시켜 혼화하여 처리하였다.
뿌리혹선충의 증식
실내 포트 검정에 이용된 고구마뿌리혹선충(Meloidogyne incognita)은 국립원예특작과학원 원예특작환경과에서 토마토 유묘를 이용하여 증식한 자원을 분양 받아 증식하였다. 고구마뿌리혹선충의 증식은 직경 16.0 cm 높이 13.5 cm 플라스틱 포트에 45~50일된 토마토(서광, 흥농) 유묘를 정식하여 40~45일 동안 뿌리혹이 형성되도록 하였다. 그리고 뿌리혹이 형성된 뿌리를 1 cm 길이로 잘라서 새로운 토마토 유묘를 심을 포트에 상토(바로크, 서울바이오)와 함께 섞은 후 토마토 유묘를 정식한 다음 누대 증식하였다. 포트 검정에 사용된 뿌리혹선충은 누대 증식 중이던 고구마뿌리혹선충유충을 사용하였다. 온실에서 (온도 26 ± 5°C) 선충을 접종한 토양과 새로운 상토를 1:1비율로 혼합한 뒤 포트에 채워 넣고, 30일 된 방울토마토 유묘를 포트당 4주씩 파종하였다.
Microplate에서 선충 살충효과 검정
대부분의 식물추출물은 지용성 물질을 추출하고자 메탄올이나 에탄올을 사용하지만(Kim et al., 2014), 유기농업에서 사용되는 농업자재들은 유기용매로 추출하여 사용하는 것을 제한하고 있어 본 실험에서는 커피박 퇴비와 벨벳콩 식물체 분말 수용성 추출물을 시험재료를 희석액 농도(0, 0.15, 0.3, 0.6, 1.2, 2.4%)별로 500 ml 삼각플라스크에 넣고 멸균증류수 200 ml을 부어 진탕교반기(EYELA, MMV-100W, JAPAN)에서 200 rpm에서 4시간 동안 교반 후 여과지(Advantec No.2, JAPAN)에 걸러 4°C 냉장보고하면서 실험에 사용하였다. 커피박 퇴비와 벨벳콩 식물체 분말 수용성 추출물의 농도별 뿌리혹선충에 대한 살충율을 확인하기 위해 Kim et al. (2014)이 사용한 96-wel microplate법을 개량하여 12well microplate에 고구마뿌리혹선충 유충 50마리를 넣고 3시간 간격으로 각 처리별로 광학현미경을 통해 선충의 생존수를 확인하여 살충율을 구하였다.
포트 뿌리혹선충 방제효과 및 호박 생육촉진효과 검정
실내 포트에서 커피박 퇴비와 벨벳콩 식물체 분말의 고구마뿌리혹선충에 대한 처리별 방제효과에 대한 시험은 직경 16.0 cm 높이 13.5 cm 플라스틱 포트에 4~5엽기의 호박(제일애호박, 제일종묘) 유묘를 상토(바로크, 서울바이오)가 담겨 있는 포트에 심었다. 그리고 처리방법에 관계없이 정식과 함께 각각의 증식된 뿌리혹선충의 유충을 분리하여 포트 당 1,000마리를 접종하였다. 뿌리혹선충의 알 분리는 누대 증식 중이던 토마토 뿌리를 수거하여 깨끗이 씻어서 뿌리속의 알을 분리하기 위하여 개량된 sodium hypochloride 방법(Baker et al., 1985)을 사용하였다. 분리방법은 깨끗이 씻은 뿌리를 1 cm 간격으로 잘라서 200 ml의 1% NaOCl 용액이 들어있는 믹서기에 넣고 고속으로 1분간 회전시켰다(Kim and Lee, 2008). 그리고 믹서기 내의 뿌리 찌꺼기, 알은 75 μm와 28 μm 체를 통과시키고, 28 μm 체에 거른 알이 부화할 때까지 상온(25 ± 2°C)에서 보관하였다. 건전한 유충을 시험에 활용하기 위하여 일별 부화율을 현미경하에서 관찰하면서 대부분의 알이 부화하는 날에 1차 체에 거른 후 2차 깔때기법으로 거른 후 획득한 유충을 시험에 이용하였다. 실험은 처리별로 뿌리혹선충 종에 따라 3개의 포트를 1반복으로 하여 10반복으로 조사하였다. 조사는 커피박 퇴비와 벨벳콩 식물체 분말 농도별 처리 후 15일과 30일째 포트내의 상토 중 100 g을 개량깔때기법(Kaya and Stock, 1997)으로 선충의 밀도를 조사하여 살충효과를 처리간 비교, 분석하였다.
식물성 유기물인 커피박 퇴비와 벨벳콩 식물체 분말이 호박 생육에 미치는 효과를 알아보고자 커피박 퇴비(10%, 20%)와 1% 벨벳콩 식물체 부위별 분말을 처리한 후 30일째에 호박 유묘의 뿌리길이, 뿌리 생체중, 지상부 생체중을 조사하였다.
통계분석
커피박 퇴비와 벨벳콩 식물체 분말의 뿌리혹선충에 대한 방제효과 및 생육촉진 효과에 대한 비교는 Duncan test로 처리평균간 차이로 분산분석 하였다(SAS Institute, 2008).
결과 및 고찰
Microplate에서 뿌리혹선충 살충효과 검정
12셀 세포배양플레이트에서 1/2씩 희석한 호피무늬 벨벳콩 추출물의 농도별(0.15, 0.3, 0.6, 1.2, 2.4%)로 고구마뿌리혹선충의 유충 치사율에 미치는 영향을 조사하였더니, 처리 후 시간의 경과에 따라 무처리에 비해 벨벳콩 추출물 처리에서 급격히 치사율이 증가하였다. 벨벳콩 추출물 처리 3시간 후에는 치사율이 27% 이하로 낮게 나타났으나 6시간 후에는 1.2%와 2.4% 벨벳콩 추출물 처리에서 각각 40.0%, 42.0%로 점차 증가하여 12시간이 경과한 후에는 가장 낮은 농도의 벨벳콩 추출물(0.15%)에서 뿌리혹선충 2령충의 치사율이 56.0%를 나타냈다. 특히, 벨벳콩 추출물 처리 24시간 후에는 뿌리혹선충 2령충의 치사율이 97% 이상으로 나타나 1.2%와 2.4% 벨벳콩 추출물 처리가 가장 높게 나타났다(Table 2, Fig. 1).

Effect of coffee ground compost and velvet bean plant powder on mortality of root knot nematode, Meloidogyne incognita in pumpkin seedling in green house

Effect of velvet bean (VB), Mucuna pruriens extracts with water on mortality (Mean ± SDa, %) of Meloidogyne incognita
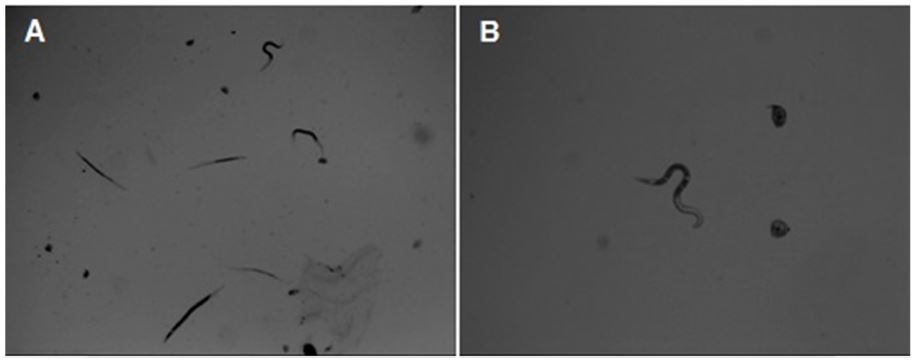
Observation of mortality of sweet potato root-knot nematode, Meloidogyne incognita after treatment of velvet bean, Mucuna pruriens extracts. A: control efficacy of 1% Plant powder of Velvet bean, B: survived nematodes of 2nd juvenile.
녹비나 유기성 식물 잔재물의 식물기생성 선충에 대한 살충효과를 일으키는 작용기작으로 크로타라리아(C. spectabilis)의 경우 Meloidogyne spp.의 유충 운동성을 저해하는 monocrotaline이란 물질이 작용하는 것으로 알려져 있다(Fassuliotis and Skuca, 1969). 작두콩(Canavalia ensifomis)의 경우 렉틴(lectins)의 일종인 concanavalin이 기주탐색과 같은 행동을 저해하는 것으로 알려져 있다(Marban-Mendoza et al., 1989). 시험재료로 사용한 벨벳콩(M. aterrima)의 뿌리와 잎으로부터 2종류의 알코올성분인 triacontanol과 tricontanyl tetracosanoate 성분이 뿌리혹선충의 부화를 억제하는 것으로 보고되었다(Nogueira et al., 1996). 따라서 벨벳콩 분말뿐만 아니라 수용성 추출물에서도 뿌리혹선충 2령충에 대한 살충효과가 뛰어난 점을 감안한다면 벨벳콩을 별도의 추출과정을 거치지 않아도 식물체를 재배 작물의 토양에 환원하여 처리하는 것만으로도 뿌리혹선충을 방제할 수 있을 것으로 사료된다.
온실 포트 토양 속 뿌리혹선충 살충효과
커피박 퇴비(10%, 20%)와 1% 벨벳콩 식물체분말(민무늬콩, 호피무늬 콩, 식물체, 콩꼬투리)처리에 따른 고구마뿌리혹선충 유충의 살충률을 조사한 바, 처리 15일 후 모든 처리구가 52.4% 이상의 높은 살충률을 나타내었으며 그 중에서도 20% 커피박 퇴비의 뿌리혹선충의 살충률이 61.0%로 가장 높게 나타났다. 처리 30일 후, 커피박 퇴비(10%, 20%)의 살충률은 크게 증가하지 않았으나, 1% 벨벳콩 처리구는 뿌리혹선충의 살충률이 83.2%로 가장 높게 나타났다(Table 1, Fig. 2).

Effect of Velvet bean, Mucuna pruriens plant powders on root-knot nematode, Meloidogyne incognita in greenhouse. A: affected pumpkin plant with wilt symptom, B: 1% velvet bean powder, C: observation of 1% Plant of Velvet bean with microscope, D: observation of survived nematodes 2nd juvenile.
일반적으로 박과류 시설재배지에서 발견되는 뿌리혹선충 밀도가 10마리 이상일 때 수량은 약 39% 이상 감소하는 것으로 보고하였으며(Cho et al., 2000; Kim, 2001) 토양 중 초기 선충 밀도가 높을수록 토양 및 뿌리속의 최종 밀도가 높은 경향을 보이는 것으로 보고하였다(Kim and Lee, 2008). 따라서 작물 정식 전후로 토양 내 뿌리혹선충의 밀도를 경감할 수 있는 방제기술의 개발이 필요하다. 토마토 재배기간 중 선충 방제를 위해 퇴비, 토탄, 커피과육, 우분, 액비, 지렁이분변토와 같은 유기물 토양개량제에 대한 효과를 검정한 바, 여름재배 기간 중 커피과육 토양처리에 의해 토마토의 뿌리혹 발생이 감소되었으며 가을재배 기간에는 여름재배보다 뿌리혹 생성뿐만 아니라 선충의 난낭수도 86% 감소하는 것으로 보고하였다. 전통적으로 녹비나 유기성 식물의 잔재물을 토양에 처리하면 식물기생성 선충의 발생을 억제하는 것으로 알려져 있으나 유채종자, 갈퀴류, 수단그라스 처리는 효과가 불확실한 것으로 보고하였다(Johnson et al., 1992; MacGuidwin and Layne, 1995).
Zasada et al. (2006)은 벨벳 식물체로부터 추출한 수용성 물질이 뿌리혹선충의 난낭 상태보다 유충에 더 효과가 있으며 벨벳콩의 식물부위 중 줄기로부터 추출한 수용성 물질이 더욱 뿌리혹선충에 대한 살충효과가 뛰어난 것으로 보고하였다. 또한 벨벳콩은 미국 플로리다와 마르티니크에서 고구마뿌리혹선충의 밀도를 효과적으로 낮춘 것으로 보고한 바있다(McSorley and Dickson, 1995; Quénéhervé et al., 1998).
페놀성 물질을 다량 함유한 커피박 퇴비는 오히려 뿌리혹선충에 대한 살충 효과가 낮은 편이나 벨벳콩은 식물체 부위별로 살선충 효과가 나타남으로 호박 정식 전 벨벳콩 식물을 녹비작물로 재배하거나 식물체를 직접 유기물로서 처리하면 토양내 뿌리혹선충 초기 밀도를 낮출 수 있어 매우 중요한 방제기술이 될 수 있을 것으로 사료된다.
식물성 유기물 처리에 따른 호박유묘 생육 촉진효과
호박 뿌리혹선충 방제에 유용한 유기물 자원을 선발하고자 처리한 커피박 퇴비(10%, 20%)와 벨벳콩 식물체 분말(민무늬 콩, 호피무늬 콩, 식물체, 콩꼬투리)에 따른 호박유묘의 생육을 조사한 바, 무처리에 비해 10% 커피박 퇴비와 1% 벨벳콩 분말(민무늬 콩, 호피무늬 콩, 식물체, 콩꼬투리) 처리구 호박유묘의 뿌리 길이(22.2% 이상), 뿌리 생체중(22.7% 이상), 지상부 생체중(33.8% 이상)이 증가하였으나 20% 커피박 퇴비 처리구의 호박유묘 뿌리와 지상부 생체중 등 호박유묘의 생육이 감소하는 것으로 나타났다. 커피박 퇴비와 벨벳콩 식물체 분말 처리중에서 1% 호피무늬 벨벳콩 분말 처리구의 생육이 가장 우수한 것으로 조사되었다(Table 3).

Estimation of coffee ground compost and velvet bean plant powder on pumpkin seedling growth in green house
커피박 폐기물에는 일반적인 가축분, 농업부산물 퇴비, 계분, 퇴비보다 질소와 칼륨함량이 훨씬 높은 것으로 보고되었으며(Braham, 1987; Pandey et al., 2000) 열대지방이나 토양수분이 높은 지역의 토양에 유기물 퇴비로 매우 효과적으로 사용할 수 있다고 보고하였다(Tenaw and Kelsa, 1998; Zake et al., 2000). 파인애플 재배 시 커피박을 유기물로 피복하였을 때 가뭄이 심한 시기에, 파인애플의 영양생육이 뚜렷하게 증진되는 것으로 보고하였다(Eshetu et al., 2007).
국내 과채류 시설재배지 내에서 박과류 작물은 대부분 5년 이상 연작재배되고 있는 현실을 감안한다면 저항성 대목이나 품종을 이용하는 방법이 장기적으로 매우 바람직한 방제대책일 수 있다. 하지만, 과채류 작물의 뿌리혹선충 저항성에 대한 연구가 오랜 동안 이루어져 왔으나 뿌리혹선충에 대한 박과류의 저항성 품종이 없는 것으로 보고되고 있다(Kim and Do, 2006; Kim et al., 2012; Park et al., 1995; Cho et al., 1997).
이상의 결과를 종합해 보면 호박 뿌리혹선충을 방제하기 위해 적용한 커피박 퇴비(10%, 20%)와 벨벳콩 식물체 분말(민무늬 콩, 호피무늬 콩, 식물체, 콩꼬투리)은 토양 및 실내 시험에서 살선충 효과가 있는 것으로 나타났으나, 금후 농가포장에서 보다 효과적으로 이용되기 위해서는 살선충 효과를 증진시킬 수 있는 처리방법에 대한 연구가 필요할 것 으로 사료된다.
Acknowledgments
본 연구성과물은 농촌진흥청 공동연구사업(PJ00999702)의 지원에 의해 이루어진 것입니다.
References
- Baek, J. Y., (2004), Study on the applications of nematode and phytophthora resistance of cucurbit genetic resources and rootstock of oriental melon, The thesis of Master degree of Paichai University, Daejeon, Rep. of Korea.
- Barker, K. R., D. P. Schmitt, and J. L. Imbriani, (1985), Nematode population dynamics with emphasis on determining damage potential to crops, In: An advanced treatise on Meloidogyne Barker, K. R., C. C. Carter, and J. N. Sasser (Eds), North Carolina State University, Raleigh, North Carolina, USA, p135-148.
- Bawa, J. A., I. Mohammed, and S. Liadi, (2014), Nematicidal effect of some plants extracts on root-knot nematodes (Meloidogyne incognita) of Tomato (Lycopersicon esculentum), World J. Life Sci. and Medical Res, 3, p81-87.
- Braham, J. E., (1987), Coffee pulp in other species, In: Coffee pulp: composition, technology, and utilization Brahan, J.E., and Bressani, R. (eds), Institute of Nutrition of Central America and Panama, Guatemala, p51-54.
-
Bridge, J., (1996), Nematode management in sustainable and subsistence agriculture, Annu. Rev. Phytopathol, 34, p201-225.
[https://doi.org/10.1146/annurev.phyto.34.1.201]

- Chavarría, C. J. A., and K. R. Rodríguez, (1998), Changes in soil enzymatic activity and control of Meloidogyne incognita using four organic amendments, Nematropica, 28, p7-18.
-
Chitwood, D., (2002), Phytochemical based strategies for nematode control, The Annual Review of Phytopathology, 40, p221-249.
[https://doi.org/10.1146/annurev.phyto.40.032602.130045]

- Cho, M. R., H. Y. Jeon, K. D. Ko, D. S. Kim, S. Y. Na, and M S. Yiem, (1997), Screening of oriental melon rootstock cultivars for resistance to Meloidogyne incognita, R.D.A. J. Crop Protec, 39, p47-51.
- Cho, M. R., B. C. Lee, D. S. Kim, H. Y. Jeon, M. S. Yiem, and J. O. Lee, (2000), Distribution of plant-parasitic nematodes in fruit vegetable production areas in Korea and identification of root-knot nematodes by enzyme phenotypes, Korean J. Appl. Entomol, 39, p123-129.
- Choi, D. R., and Y. E. Choi, (1982), Survey on plant parasitic nematodes in cropping by controlled horticulture, Korean J. Plant Protec, 21, p8-14.
- Choi, D. R., and Y. E. Choi, (1982), Survey on plant parasitic nematodes in cropping by controlled horticulture, The Korean J. Plant Protec, 21, p8-14.
- Choi, Y. E., (1978), Studies on root-knot nematodes in Korea, The Kasetsart J, 12, p31-35.
- Chon, H. S., H. J. Park, S. G. Yeo, S. D. Park, and Y. E. Choi, (1996), Technical development for control on soil nematodes (Meloidogyne spp.) of oriental melon in plastic film house, RDA J. Agri. Sci, 38, p401-407.
- Choo, H. Y., (1985), A note on root-knot nematodes from Chinese gooseberry, Korean J. Plant Protec, 24, p115.
- Choo, H. Y., S. M. Lee, J. B. Kim, and Y. D. Park, (1990), Relationship of root-knot nematode, Meloidogyne incognita to pathogenesis of Rhizoctonia solani on cucumber, pepper, and tomato, Korean J. Plant Pathol, 6, p409-411, (In Korean).
-
Elbadri, G. A., D. W. Lee, J. C. Park, H. B. Yu, and H. Y. Choo, (2008), Evaluation of various plant extracts for their nematicidal efficacies against juveniles of Meloidogyne incognita, J. Asia-Pacific Entomol, 11, p99-102.
[https://doi.org/10.1016/j.aspen.2008.04.004]

- Fassuliotis, G., and G. P. Skucas, (1969), The effect of a pyrrolizidine alkaloid ester and plants containing pyrrolizidine on Meloidogyne incognita acrita, J. Nematology, 1, p287-288, (abstr.).
-
Franca, A.S., L. S. Oliveira, R. C. S. Oliveira, P. C. Mancha Agresti, and R. Augusti, (2009), A preliminary evaluation of the effect of processing temperature on coffee roasting degree assessment, J. Food Engineering, 92, p345-352.
[https://doi.org/10.1016/j.jfoodeng.2008.12.012]

- Fujii, Y., (1999), Allelopathy of hairy vetch and mucuna: their application for sustainable agriculture, In: Biodiversity and Allelopathgy from organisms to ecosystem in the pacific Chou, C. H., Waller, G. R., and Reinhardt, C. (eds), Academia Sinica, Taipei, p289-300.
- Growen, S. R., T. K. Ruabete, and J. G. Wright, (2005), Root-knot nematodes, Pest advisory leaflet no. 9. Secretariat of the Pacific Community.
-
Ha, W. J., Y. C. Kim, H. C. Jung, and S. K. Park, (2014), Control of the root-knot nematode (Meloidogyne spp.) on cucumber by a liquid bio-formulation containing chitinolytic bacteria, chitin and their products, Res. Plant Dis, 20, p112-118.
[https://doi.org/10.5423/RPD.2014.20.2.112]

- Hirschmnn, H., (1986), Meloidogyne hispanica n. sp. (Nematoda: Meloidogynidae), the ‘Seville root-knot nematode’, J. Nematol, 18, p520-532.
- Johnson, A. W., A. M. Golden, D. L. Auld, and D. R. Sumner, (1992), Effects of rapeseed and vetch as green manure crops and fallow on nematodes and soil-borne pathogens, J. Nematol, 24, p117-126.
-
Kaya, H. K., and S. P. Stock, (1997), Techniques in insect nematology, In: lacey, L. A. (ed.), Manual of Techniques in insect pathology, Academic Press, New York, p281-324.
[https://doi.org/10.1016/B978-012432555-5/50016-6]

- Kim, D. G., and H. W. Do, (2001), Resistance to root-knot nematodes in Cucumis species, Korean Soc. Hort. Sci, 42, p279-283, (In Korean).
- Kim, D. G., (2001), Occurrence of root-knot nematodes on fruit vegetables under greenhouse conditions in Korea, Res. Plant Pathol, 7, p69-79.
-
Kim, D. G., and J. H. Lee, (2008), Economic threshold of Meloidogyne incognita for greenhouse grown cucumber in Korea, Res. Plant Dis, 14, p117-121.
[https://doi.org/10.5423/RPD.2008.14.2.117]

- Kim, D. G., and S. K. Choi, (2001), Effects of incoporation method of nematicides on reproduction of Meloidogyne arenaria, Korean J. Appl. Entomol, 40, p89-95.
- Kim, D. G., D. R. Choi, and S. B. Lee, (2001), Effects of control methods on yields oriental melon in fields infested with Meloidogyne arenaria, Res. Plant Dis, 7, p42-48.
-
Kim, D. G., Y. H. Ryu, C. S. Huh, J. A. Ryu, I. K. Yeon, and Y. S. Lee, (2014), Screening of plant extracts for nemastatic activity, Res. Plant Dis, 20, p37-49.
[https://doi.org/10.5423/RPD.2014.20.1.037]

- Kim, D. G., Y. K. Lee, and B. Y. Park, (2001), Root-knot nematode species distributing in greenhouses and their simple identification scheme, Res. Plant Dis, 7, p49-55.
-
Kim, H. H., M. R. Cho, T. J. Kang, J. A. Jung, and Y. K. Han, (2010), Screening of tomato cultivars resistant to root-knot nematode, Meloidogyne incognita, Res. Plant Dis, 16, p294-298.
[https://doi.org/10.5423/RPD.2010.16.3.294]

-
Kim, H. H., Y. H. Jung, D. H. Kim, T. K. Ha, J. B. Yoon, C. G. Park, and H. Y. Choo, (2015), Control effects of imicyafos GR against two species of the root-knot nematodes (Meloidogyne incognita and Meloidogyne hapla), Korean J. Pestic. Sci, 19, p101-105.
[https://doi.org/10.7585/kjps.2015.19.2.101]

- Kim, H. J., H. Y. Choo, C. G. Park, S. M. Lee, and J. B. Kim, (1998), Bio-logical control of northern root-knot nematodes, Meloidogyne hapla with plant extract, Korean J. Appl. Entomol, 37, p199-206.
-
Kim, S. H., J. E. Shin, K. J. Lee, S. J. Xu, and B. S. Kim, (2012), Evaluation of disease resistance of cucurbit cultivars to powdery mildew and root-Knot nematode, Res. Plant Dis, 18, p29-34, (In Korean).
[https://doi.org/10.5423/RPD.2012.18.1.029]

-
Liang, L. Z., F. Meng, J. Ye, S. Yang, Y. Liu, Y. Sun, Q. Guo, X. Mi, C. Huang, Z. Zou, Z. Rao, Lou, and K. Q. Zhang, (2010), The crystal structures of two cuticle-degrading proteases from nematophagous fungi and their contribution to infection against nematodes, FASEB J, 24, p1391-1400.
[https://doi.org/10.1096/fj.09-136408]

- MacGuidwin, A. E., and T. L. Layne, (1995), Response of nematode communities to sudangrass and sorghumsudangrass hybrids grown as green manure crops, J. Nematol, 27, p609-616.
-
Machado, E. M. S., R. M. Rodriguez-Jasso, J. A. Teixeira, and S. I. Mussatto, (2012), Growth of fungal strains on coffee industry residues with removal of polyphenolic compounds, Biochem. Eng. J, 60, p87-90.
[https://doi.org/10.1016/j.bej.2011.10.007]

- Marban-Mendoza, N., A. Jeyaprakash, and H. B. Jansson, (1987), Control of root-knot nematodes on tomato by lectins, J. Nematol, 19, p331-335.
-
McGaw, L. J., D. Van der Merwe, and J. N. Eloff, (2007), In vitro anthelmintic, antibacterial and cytotoxic effects of extracts from plants used in South African ethnoveterinary medicine, The Veterinary J, 173, p366-372.
[https://doi.org/10.1016/j.tvjl.2005.09.004]

- McSorley, R., and D. W. Dickson, (1995), Effect of tropical rotation crops on Meloidogyne incognita and other plant parasitic nematodes, J. Nematology, 27, p535-544.
- Nogueira, M. A., J. S. de Oliveira, S. Ferraz, and M. A. dos Santos, (1996), Nematicidal constituents in Mucuna aterrima and its activity on Meloidogyne incognita race 3, Nematologia Mediterranea, 24, p249-252.
-
Oka, Y., B. Ben-Daniel, and Y. Cohen, (2012), Nematicidal activity of the leaf powder and extracts of Myrtus communis against the root-knot nematode Meloidogyne javanica, Plant Pathol, 61, p1012-1020.
[https://doi.org/10.1111/j.1365-3059.2011.02587.x]

- Osei, K., S. R. Gowen, B. Pemeroke, R. L. Brandenbugs, and D. L. Jordan, (2010), Potential of leguminous cover crops in management of a mixed population of root-knot nematodes (Meoidogyne spp.), J. Nematology, 42, p173-178.
-
Pandey, A., C. R. Soccol, P. Nigam, D. Brand, R. Mohan, and S. Roussos, (2000), Biotechnological potential of coffee pulp and coffee husk for bioprocesses, Biochemical Engineering J, 6, p153-162.
[https://doi.org/10.1016/S1369-703X(00)00084-X]

-
Park, J. O., J. R. Hargreaves, E. J. Mc Conville, G. R. Stirling, E. L. Ghisalberti, and K. Sivasithamparam, (2004), Production of leucinostatins and nematicidal activity of Australian isolates of Paecilomyces lilacinus (Thom) Samson, Lett. Appl. Microbiol, 38, p271-276.
[https://doi.org/10.1111/j.1472-765X.2004.01488.x]

- Park, S. D., S. D. Park, T. Y. Kwon, B. S. Choi, W. S. Lee, and Y. E. Choi, (1995), Study on intergrated control against root knot nematode of fruit vegetables (Oriental melon and cucumber) in vinyl house, Korea J. Appl. Entomol, 34, p75-81.
- Pavaraj, M., G. Bakavathiappan, and S. Baskaran, (2012), Evaluation of some plant extracts for their nematicidal properties against root-knot nematode, Meloidogyne incognita, J. Biopest, 5, p106-110.
- Quénéhervé, P., P. Topart, and B. Martiny, (1998), Mucuna pruriens and other rotaional crops for control of Meloidogyne incognita and Rotylenchulus renifomis in vegetables in polytunnels in Matinique, Nematropica, 28, p19-30.
-
Radwan, M. A., S. A. Farrag, M. M. Abu-Elamayem, and N. S. Ahmed, (2013), Biological control of the root-knot nematode, Meloidogyne incognita on tomato using bioproducts of microbial origin, Appl. Soil Ecol, 56, p58-62.
[https://doi.org/10.1016/j.apsoil.2012.02.008]

-
Saenger, M., E. Hartge, J. Werther, T. Ogada, and Z. Siagi, (2001), Combustion of coffee husks, Renew. Energ, 23, p103-121.
[https://doi.org/10.1016/S0960-1481(00)00106-3]

-
Satoshi, T., J. Sawada, and Z. Moromizato, (2008), Nematicidal activity of Okinawa Island plants on the root-knot nematode Meloidogyne incognita (Kofoid and White) Chitwood, Plant Soil, 303, p207-216.
[https://doi.org/10.1007/s11104-007-9499-7]

- Shin, Y. S., I. K. Yeon, S. K. Choi, B. S. Choi, and W. S. Lee, (1998), Control of root-knot nematode (Meloidogyne incognita Chitwood) by root zone warming system, J. Bio. Fac. Env, 7, p139-143.
-
Silva, M. A., S. A. Nebra, M. J. Machado, and C. G. Sanchez, (1998), The use of biomass residues in the Brazilian soluble coffee industry, Biomass Bioenerg, 14, p457-467.
[https://doi.org/10.1016/S0961-9534(97)10034-4]

-
Simes, P., J. Santos, and M. Matos, (2009), Experimental evolutionary domestication, In:Concepts.
[https://doi.org/10.1525/california/9780520247666.003.0005]

- Taylor, A. L., and J. N. Sasser, (1978), Biology, identification and control of root knot nematode (Meloidogyne spp.), North California State University graphs, Releigh, N.C, p111.
- Tenaw, W., and K. Kelsa, (1998), Residual effect of coffee husk pulp on grain yield of maize, In: Proceedings of the 6th Eastern and Southern Africa Maize Regional Conference, p21-25, Addis Ababa, Ethiopia, 21-25 September 1998.
-
Tokimoto, T., N. Kawasaki, T. Nakamura, J. Akutagawa, and S. Tanada, (2005), Removal of lead ions in drinking water by coffee grounds as vegetable biomass, J. Colloid Interf. Sci, 281, p56-61.
[https://doi.org/10.1016/j.jcis.2004.08.083]

- Vargas, A. R., and K. R. Rodríguez, (2001), Bioremediative management of soybean nematode population densities in crop rotations with velvetbean, cowpea, and winter crops, Nematopica, 31, p37-46.
-
Vilanova, M., and M. A. Coimbra, (2009), Immunostimulatory properties of coffee mannans, Mol. Nut. Food Res, 53, p1036-1043.
[https://doi.org/10.1002/mnfr.200800385]

- Washira, P. M., J. W. Kimenju, S. A. Okoth, and R. K. Miley, (2009), Stimulation of nematode destroying fungi by organic amendments applied in management of plant parasitic nematode, Asian J. Plant Sciences, 3, p153-159.
-
Wiratno, D. T., H. Van den Bergb, J. A. G. Riksend, I. M. C. M. Rietjensb, S. R. Djiwantia, J. E. Kammengad, and A. J. Murkb, (2009), Nematicidal activity of plant extracts against the root-knot nematode, Meloidogyne incognita, The Open Nat. Prod. J, 2, p77-85.
[https://doi.org/10.2174/1874848100902010077]

- Yeon, I. G., H. W. Do, Y. S. Shin, and S. C. Han, (1996), Survey of injury of nematodes according to the continuous cultivation year in oriental melon greenhouse cultivation, Experimental Report of Gyeongsangbuk-do Province.
-
Zasada, I. A., W. Klassen, S. L. F. Meyer, M. Codallo, and A. A. Abdul-Baki, (2006), Velvetbean (Mucuna puriens) extracts: impact on Meloidogyne incognita survival and on Lycopersicon esculentum and Lactuca sativa germination and growth, Pest Manag. Sci, 62, p1122-1127.
[https://doi.org/10.1002/ps.1281]

- Zhang, C. M., and Wu, X., and X. H. Cai, (2009), Effect of chitinases produced by Pochonia chlamydosporia on egghatching of Meloidogyne incognita, Scientia Agricultura Sinica, 42, p3509-3515.