
화랑곡나방(Plodia interpunctella)의 페놀옥시데이즈 활성화에 대한 이산화염소의 억제 효과
초록
페놀옥시데이즈(phenoloxidase: PO)는 산화효소로서 곤충의 면역 및 표피층 경화 반응에 중요한 생리적 기능을 담당한다. 이산화염소는 높은 산화력을 바탕으로 미생물 및 곤충에 이르기까지 다양한 살균 및 살충효과를 갖고 있다. 본 연구는 곤충의 면역계에 중요한 역할을 수행하는 PO를 대상으로 이산화염소의 억제작용을 분석하였다. 화랑곡나방의 PO 활성은 혈구 및 혈장 모두에서 검출되었다. 이 PO 활성은 세균 침입에 따라 특히 혈장에서 뚜렷한 증가를 나타냈다. 그러나 세균 처리와 함께 이산화염소가 동시에 처리되면 이러한 PO 활성 증가는 나타나지 않았다. 반면에 면역 처리로 활성화된 PO에 대해서 대해서는 억제효과를 주지 못했다. 본 연구는 이산화염소가 PO의 활성을 억제하며, 이러한 억제는 PO의 활성화 단계에서 일어나는 것으로 나타내고 있다.
Abstract
Phenoloxidase (PO) is an oxidizing enzyme and plays crucial roles in insect immunity and cuticle sclerotization. High oxidizing activity of chlorine dioxide gives effective control activities against microbes and insect pests. These allowed us to assess any inhibitory activity of chlorine dioxide against PO with respect to insect immunity. PO activities of the Indeanmeal moth, Plodia interpunctella, was detected in both hemocytes and plasma. Upon bacterial challenge, PO activity was significantly increased especially in plasma. However, the immune challenge coupled with chlorine dioxide treatment did not enhance PO activity. When different chlorine dioxide concentrations were incubated with activated PO by immune challenge, they did not inhibit the activated PO. These results indicate that chlorine dioxide suppresses PO activity by inhibiting PO activation.
Keywords:
chlorine dioxide, immunity, phenoloxidase, Plodia interpunctella키워드:
이산화염소, 페놀옥시데이즈, 면역작용, 화랑곡나방서 론
페놀옥시데이즈(phenoloxidase: PO) (EC: 1.14.18.1)는 산소 원자 하나를 기질에 첨가시키는 과정을 촉매하는 단일산화효소이다(Sugumaran 2002). 기질로는 monophenol로서 이 효소의 촉매 작용에 의해 산소를 추가로 받으면 diphenol로 전환된다. 또한 PO는 diphenol의 산화 반응을 촉매하여 퀴논(quinone) 분자로 전환시킨다. 이 퀴논 분자들의 폴리머형성 과정을 통해 표피층과 면역반응에서 보는 암화(=멜라닌화)가 진행된다. 이 멜라닌 과정을 통해 나타나는 카테콜(catechol) 물질은 세포독성이 높아 체내로 침입한 세균을 비롯한 병원미생물을 치사시킬 수 있다(Zhao et al. 2007). 따라서 조절 한계를 넘은 PO의 활성은 오히려 곤충에게 불리하여 이 효소는 주로 활성이 없는 prophenoloxidase (proPO)로 존재하게 된다(Cerenius and Söderhäll 2004). 면역 과정동안 외래인자의 인식 반응에 따라 proPO는 PO로 활성화 과정을 밟게 되는 데, 이는 척추동물의 보체 활성화 또는 혈액응고 반응과 유사하게 단백질분해과정을 통해 일어나게 된다(Cerenius et al. 2008). 따라서 proPO를 PO로 전환하는데 일련의 세린계 단백질분해효소(serine protease: SP)가 관여하며, 이 SP의 활성을 억제하는 serpin (serine protease inhibitor)이 전체적 조절 중추를 이루고 있다.
이산화염소(ClO2)는 염소 산화물의 일종으로 음용수의 소독 처리 및 표백제로 널리 사용되고 있다(Volk et al. 2002). 특별히 이산화염소는 일반 소독제로 사용되는 염소와 달리 암을 유발하는 trihalomethane을 생성하지 않아 비교적 안전하며(Don 1998), 물에 대한 용해도가 높고, 액상 및 기체 상태의 제제화가 가능하여 여러 용도의 소독제로 사용 가능성을 넓히고 있다. 최근 기체 상태로 훈증 처리가 가능한 이산화염소는 위생해충 및 저곡해충에 대한 살충력을 나타낼 수 있다. 병원 시설에 발생하는 빈대류(Cimex lectularius, Cimex hemipterus)에 대해서 비교적 높은 농도(약 1,000 ppm)의 이산화염소 노출에 대해서 속효성의 방제 효과를 나타냈으며(Gibbs et al. 2012), 저곡류를 가해하는 화랑곡나방(Plodia interpunctella)에 대해서도 비교적 낮은 농도(200 ppm)의 노출에서 완전방제 효과를 나타냈다(Kumar et al. 2015). 이러한 이산화염소의 살충효과는 이 물질로 인하여 곤충 체내에서 발생하는 활성산소(reactive oxygen species: ROS)에서 기인하였다(Kumar et al. 2015). ROS는 비교적 다양한 생체분자에 영향을 줄 수 있다. 따라서 ROS로 인하여 궁극적으로 살충작용을 나타내는 것은 생체 내 다양한 기능 단백질의 변형 유발에 기인될 수 있다.
화랑곡나방은 어린 유충기에 낮은 온도와 짧은 일장 조건에 접하면 전용 단계로 휴면을 유기하는 곤충이다(Prevett 1971, Bell and Walker 1973, Wijayaratne and Fields 2012). 전 세계에 분포하는 이 곤충은 가정, 상가 또는 창고에 저장된 음식물을 섭식하는 주요 저장 곡물 해충이다(Ress 2004). 특별히 유충기에 발달된 큰턱을 이용하여 비닐 또는 폴리프로필렌 필름도 뚫고 저장식품을 가해하여 상품성을 떨어뜨리는 해충으로도 알려지고 있다(Cline 1978). 더욱이 이들 유충이 생성하는 실샘 분비물은 분말 곡식류의 덩어리를 유발하며, 이들의 분비물은 인체의 면역계에 영향을 주어 천식 또는 피부 알레르기를 유발하기도 한다(Binder et al. 2001). 이 해충을 방제하기 위해 신경독성을 지닌 합성 살충제가 처리되었다. 훈증제로서는 methyl bromide (MB)가 처리되었다. 그러나 오존층을 파괴할 수 있는 MB 처리는 현재 사용 규제 대상이다. 대체 훈증제로서 포스핀이 검토되었으나, 효과를 발휘하기 위해서는 추가 산소의 투입을 요구되기에 현장에 적용하기에는 무리가 있다(Liu 2011). 방사능 처리도 검토되었으나, 효과적 방제를 이루기 위해서는 비교적 높은 선량을 요구하고 있어 적용에 어려움을 주고 있다(Hallman and Phillips 2008). 친환경적 방제기술로서 성페로몬을 이용한 교미교란기술이 검토되었고 작은 규모에서는 방제에 성공을 거두기도 하였다(Ryne et al. 2001). 곤충성장조절제가 독성이 높은 신경독 살충제를 대체하기 위해 화랑곡나방 방제에 검토되었다(Fontenot et al. 2013). 생물농약인 비티 살충제가 처리되었으나, 이 해충이 이 세균독소단백질에 대해서 저항성을 발달시켜 방제 효과를 둔화시켰다(Herrero et al. 2001). 천적류로서 유충에 기생하는 Brecon hebetor와 알에 기생하는 Trichogramma류 난기생봉이 적용되기도 하였다(Grieshop et al. 2010; Nam et al. 2011). 식물정유 가운데 cinnamon oil이 화랑곡나방에 대해서 높은 기피효과를 유발하여 포장재에 적용하는 기술이 개발되었다(Kim et al. 2014). 또한 비교적 낮은 농도 처리 조건에서 살충효과를 주는 이산화염소 훈증 처리 기술은 기존의 MB를 대체할 가능이 높아지고 있다(Kumar et al. 2015).
본 연구는 기존의 이산화염소의 ROS 유발에 따라 살충효과를 주는 사실에 기반을 두고 치사에 관련 화랑곡나방의 분자 종말점을 찾는 데 목표를 두었다. 이 가운데 곤충의 면역억제를 유발할 수 있는 이산화염소의 기능을 설명하기 위해 곤충 면역의 중추적 역할을 담당하는 분자 종말점으로서 PO를 대상으로 이 효소 활성의 이산화염소에 대한 민감성을 분석하였다.
재료 및 방법
화랑곡나방 사육
본 연구에 이용된 공시충은 1994년 경상북도 대구시에 위치한 건조채소류 저장창고에서 채집된 유충을 실내에서 인공사료(800 g rice bran, 200 g yeast extract, 500mL glycerol, 2 g sorbic acid, 2 g methyl p-hydroxybenzoate)를 먹이로 누대 사육한 집단이다. 사육 조건은 온도 25 ± 1oC, 광조건 16:8 (L:D) h 그리고 상대습도는 60 ± 10%이었다. 성충은 10% 설탕물을 먹이로 제공하였다. 교미는 임의 유전적 부동(random genetic drift)을 줄이기 위해 100쌍 이상의 암수를 대상으로 실시하였고, 교미된 암컷은 유충 먹이를 제공하여 산란을 유도하였다.
세균 배양 및 면역 처리
화랑곡나방의 면역반응을 유도하기 위해 대장균(Escherichia coli Top10)을 Luria-Berthani 배양액을 이용하여 증식하였다. 약 16시간 동안 증식된 세균은 약 107 cells/mL 밀도의 세균 용액 1 μL를 화랑곡나방 5령 유충 혈강에 주입하였다. 혈강 주입 이후 25oC에서 2시간 처리 후 혈림프를 추출하여 효소 활성 분석에 이용하였다.
이산화염소
본 연구에 이용된 이산화염소는 800 ppm의 저장 용액이었다. 이 시약은 푸르고팜(화성시, 한국)에서 제공되었다. 이산화염소 저장 용액의 희석은 멸균된 100 mM 인산완충용액(pH 7.4)을 이용하였다.
proPO 생성 혈구 탐색
화랑곡나방 5령충으로부터 복부 다리를 제거하고 혈림프를 수거하였다. 추출된 혈림프를 1,000 × g의 속도로 3 분간 원심분리하여 혈장을 제거하고 가라앉은 혈구를 혈림프와 동일한 부피의 인산완충용액으로 재현탁하였다. 이 혈구 용액(10 μL)을 glass slide에 올려놓고 과습처리된 용기에서 20 분간 반응하여 혈구가 유리판위에 활착하게 하였다. 이 후 상등액을 제거하고 35% 에탄올을 포함한 PO의 기질용액(1 mg/mL의 L-dihydroxyphenylalanine (DOPA)이 포함된 인산완충용액)을 10 μL 처리하고 30분간 상온에서 반응한 후 광학현미경으로 암화된 혈구를 탐색했다.
PO 활성 측정
혈림프 및 충체 전체에서 PO 활성을 분석하였다. PO 분석은 DOPA를 기질로 흡광도 405 nm에서 측정하였다. 각 반응용액은 200 μl로서 20 μl의 효소 시료와 180 μl의 기질용액으로 구성되었다. 기질용액은 인산완충용액에 1 μg/ μl의 농도로 L-DOPA를 함유하였다. 각 처리는 3반복으로 PO효소 활성을 분석하려는 곤충을 3마리로 하여 반복하였다. 효소활성은 혈장 또는 혈구의 경우는 단위시간과 단위부피 당 흡광도변화(ΔABS/min/μl)로 산출하였고, 충체 전체인 경우는 단위 단백질량을 기준으로 산출하였다(ΔABS/min/μg). 단백질량은 Bradford (1976) 방법으로 측정하였으며 이 때 사용된 표준 단백질은 bovine serum albumin (Sigma-Aldrich Korea, Seoul, Korea)을 이용하였다.
세균 처리가 혈림프 PO 활성에 미치는 영향
화랑곡나방 5령충에 대장균 용액 1 μl (104 cells)를 주입하였다. 처리 후 2시간 경과 시점에서 충체로부터 혈림프를 추출하였다. 추출된 혈림프는 4oC 조건에서 800 × g의 속도로 3분간 원심분리하여 혈장과 혈구를 분리하였다. 가라앉은 혈구는 인산완충용액으로 제거된 혈장의 부피만큼 부여하여 현탁액으로 제조하였다. 분리된 혈장과 혈구 용액은 PO 활성 분석에 이용되었다. 각 처리는 3반복으로 실시되었다.
이산화염소가 몸 전체 PO 활성에 미치는 영향
화랑곡나방 5령충을 대상으로 이산화염소(800 ppm) 1 μl와 대장균(104 cells/μl) 1 μl를 함께 주입하였다. 비교하여 이산화염소 또는 대장균 단독 처리를 실시하였다. 또한 무처리로서 인산완충용액 주입을 실시하였다. 처리 후 2시간 경과하였을 때 몸 전체를 대상으로 PO 활성을 분석하였다. 각 처리는 3반복으로 실시되었다.
이산화염소가 혈구와 혈장 PO 활성에 미치는 영향
상기의 방법으로 면역 처리된 화랑곡나방 혈림프를 추출하여 혈구와 혈장에 존재하는 PO에 대해서 이산화염소를 기내 조건에서 노출하였다. 각 반응용액은 200 μl로서 20 μl의 혈장 또는 혈구 시료에 1 μl의 이산화염소(0-400 ppm)를 혼합하여 25oC에서 10분간 반응시켰다. 이후 상기의 PO 기질 용액 179 μl를 첨가하여 흡광도 변화를 추적하였다. 각 처리는 3반복으로 실시되었다.
통계처리
PO 활성 결과는 SAS의 PROC GLM (SAS Institute 1989)을 이용하여 one-way ANOVA 분석 및 LSD 처리 평균 간 비교를 실시하였다. 처리 사이에 차이는 제I형 오류의 확률 0.05를 기준하여 판별하였다.
결 과
편도혈구의 proPO 생성
화랑곡나방의 혈구세포 가운데 proPO를 생산하는 종류를 탐색하였다(Fig. 1). 세포 내에 존재하는 형태이기에 에탄올을 이용하여 활성화를 유도하고 여기에 기질인 DOPA를 처리하여 암화된 혈구세포를 추적하였다. 이 결과 편도혈구만 암화 현상을 나타냈다. 반면에 과립혈구와 부정형혈구는 암화 현상을 나타내지 않았다.
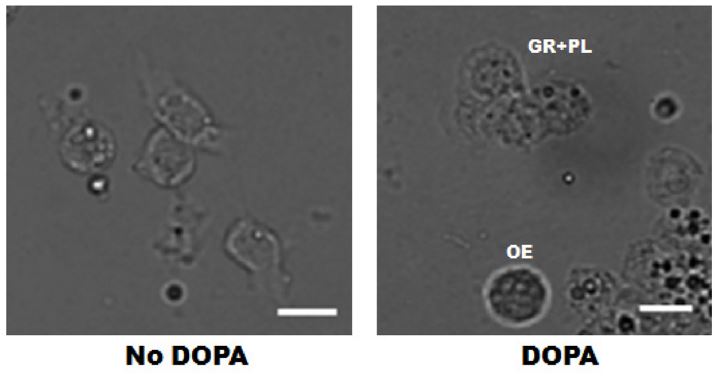
Localization of prophenoloxidase (proPO) among hemocytes of P. interpunctella 5th instar larvae. proPO was activated with 35% ethanol and reacted with L-dihydroxyphenylalanine (DOPA). Most granulocyte (GR) and plasmatocyte (PL) hemocytes were spread and aggregated during incubation for 30 min at room temperature. Oenocytoid (OE) hemocyte only exhibited melanization. Scale bar indicate 10 μm.
PO 활성과 면역반응
화랑곡나방 유충 면역과 PO 활성 변화 사이에 관계를 분석하기 위해 대장균을 이용하여 면역 처리하였다(Fig. 2). 무처리 유충의 경우는 낮은 PO 활성이 각각 혈구와 혈장에서 나타났다. 그러나 면역처리 이후에 혈장에서 PO 활성이 약 3.5 배 이상 증가하였다. 반면에 혈구에서는 큰 차이를 보이지 않았다.
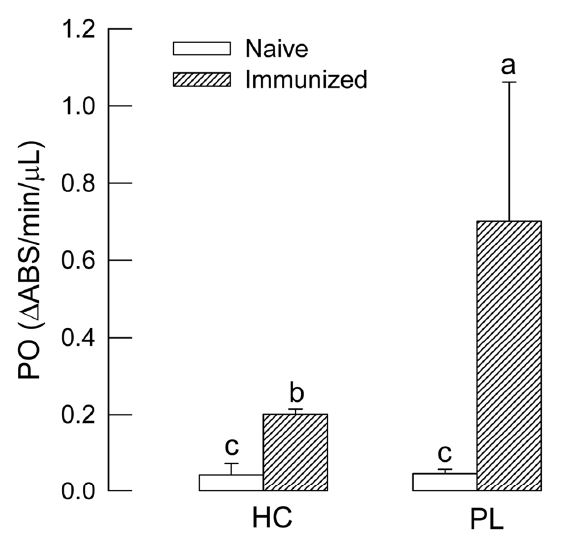
Influence of immune challenge on phenoloxidase (PO) activity in hemocyte (HC) and plasma (PL) in fifth instar larvae of P. interpunctella. Immune challenge was performed by injecting 5 × 104 cells of E. coli in 5 μl volume to hemocoel. Each treatment was replicated three times. Different letters above standard deviation bars indicate significant difference among means at Type I error = 0.05.
PO 활성에 미치는 이산화염소 처리효과(충체 실험)
이산화염소 처리가 화랑곡나방의 PO 면역반응을 억제할 수 있는 지를 분석하였다(Fig. 3). 위와 동일한 방법으로 면역처리를 실시하되 동시에 이산화염소도 함께 주입되었다. 대장균 처리구에서는 뚜렷한 PO 활성 증가를 관찰하였지만, 이산화염소와 함께 처리할 경우 PO 활성 증가는 나타나지 않았다.
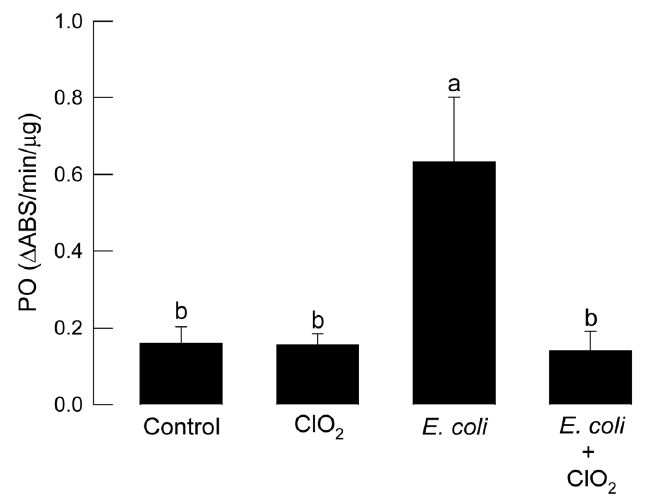
Influence of chlorine dioxide (ClO2) on activation of phenoloxidase (PO) activity of fifth instar larvae of P. interpunctella. Chlorine dioxide (0.8 μg) was injected to larval hemocoel. Immune challenge was performed by injecting 5 × 104 cells of E. coli in 5 μl volume to hemocoel. PO activity change was monitored at 2 h after injection. Each treatment was replicated three times. Different letters above standard deviation bars indicate significant difference among means at Type I error = 0.05.
PO 활성에 미치는 이산화염소 처리효과(기내 실험)
충체 실험에서 나타난 이산화염소의 PO 억제효과를 규명하기 위해 혈구와 혈장을 분리하고 시험관 조건에서 이산화염소를 직접 노출시켰다(Fig. 4). 4 ppm 이상의 높은 이산화염소 처리는 고농도 충격 현상으로 효소 반응에 따라 흡광도를 크게 저하시키는 이상 반응을 보였다. 따라서 이산화염소 처리 농도는 0-2 ppm을 이용하였다. 면역처리를 받지 않은 개체들에서는 PO 활성화가 일어나기 전 단계(Fig. 4A)로서 이산화염소를 처리하면 PO 활성의 변화를 유발하였으나 통계적으로 차이를 나타내지 못했다. 대장균을 이용하여 면역처리를 실시한 개체들은 높은 PO 활성을 보였으나, 이렇게 활성화된 PO에 대해서 서로 다른 농도의 이산화염소 처리는 억제효과를 주지 못했다(Fig. 4B).
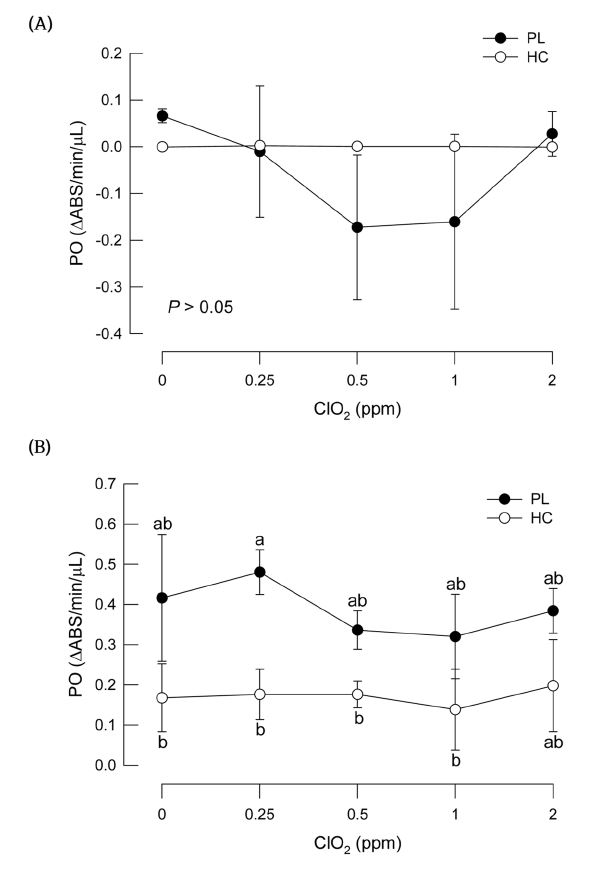
Effect of chlorine dioxide on activated phenoloxidase (PO) on hemocyte (HC) or in plasma (PL) of fifth instar larvae of P. interpunctella. (A) Naive larvae (B) Immune-challenged larvae. Immune challenge was performed by injecting 5 × 104 cells of E. coli in 5 μl volume to hemocoel. After 2 h at 25oC, hemolymph was collected and used to separate HC and PL samples. Each treatment was replicated three times. Different letters above standard deviation bars indicate significant difference among means at Type I error = 0.05.
고 찰
곤충의 면역과 체벽의 경화반응을 촉매하는 PO는 생존전략에 필수적인 단백질 도구이다. PO는 활성부위에 구리이온을 갖고 이 주위에 3개의 히스티딘 아미노산이 안정화시켜주는 tyrosinase의 일종이다(Jaenicke and Decker 2003). 이 효소는 페놀류를 산화시켜 퀴논물질로 전환시키며, 이 퀴논은 멜라닌 색소물질을 형성하게 된다. 멜라닌화는 크게 두 가지로서 dopaquinone 물질을 중심으로 검정색을 띠게하는 유멜라닌(eumelanin)과 황물질을 함유하는 benzothiazine 물질을 중심으로 적색을 이루는 페오멜라닌(pheomelanin)으로 나뉠 수 있다(Nappi and Christensen 2005). 전구물질인 proPO는 구리를 함유하는 단백질로서 산소와 결합하는 데 유사한 단백질이 갑각류에서 체내 산소운반을 담당하는 hemocyanin에 해당된다(Decker and Terwilliger 2000). 더불어 곤충류에서 저장단백질로 발현되는 hexamerin 단백질과 더불어 동일 계통이 단백질군을 이루는 데 한편 분자 계통분류학적 분석은 proPO가 가장 조상형의 물질이고 여기에서 hemocyanin이 파생되었고, 이후 구리와 결합력을 잃은 hexamerin이 파생된 것으로 추정하고 있다(Burmester 2002). 본 연구는 PO 활성 변화를 대상으로 이산화염소가 화랑곡나방의 면역계에 미치는 효과를 분석하였다. PO 활성은 화랑곡나방 유충의 혈장과 혈구에서 모두 검출되었다. 세균 처리에 따라 화랑곡나방 유충의 혈장에서는 PO 활성이 현격하게 증가되었으나 혈구에서는 이러한 PO 활성 증가가 나타나지 않았다. PO 활성 증가는 활성이 없는 proPO (70-80 kDa)가 PO (50-60 kDa)로 활성화되는 것을 의미한다(González-Santoyo and Córdoba-Aguilar 2011). 이러한 PO 활성화는 크게 두 단계에서 진행된다. 첫째로 혈구세포 내에서 생합성된 proPO가 혈장으로 방출되는 단계이다. 둘째로 방출된 proPO가 혈장의 세린계 단백질분해효소에 의해 활성화되는 단계이다. proPO 단백질은 나비목 곤충의 경우 특정 혈구세포인 편도혈구(oenocytoid)에서 합성된다(Jiang et al. 1997). 본 연구에서도 화랑곡나방의 편도혈구가 proPO를 합성하는 것을 보여주었다. proPO 단백질은 아미노기 말단에 signal peptide를 지니고 있지 않다. 따라서 이 단백질은 소포체에서 합성되고 골지체를 거쳐 세포밖으로 분비되는 signal peptide의 부재로 세포질에서 합성되게 된다. 활성화를 위해 이 proPO를 세포 밖으로 방출하는 전략은 세포붕괴(cell lysis)이다(Kanost et al. 2004). 파밤나방(Spodoptera exigua)의 경우 proPO가 편도혈구에서 합성되어 저장되어 있다가 면역신호에 따라 이 혈구세포의 붕괴가 일어난다(Shrestha and Kim 2008). 면역신호는 프로스타글란딘(prostaglandins: PG)으로 밝혀졌으며, 유사한 아이코사 노이드류인 류코트리엔(leukotriene)은 이 세포붕괴 과정을 중개하지 않았다(Shrestha and Kim 2009). 따라서 본 연구에서 관찰된 면역 처리구에서 PO 활성의 증가는 PG의 면역 중개 작용으로 proPO가 혈장으로 방출이 유도되었을 것으로 추정된다. 둘째로 proPO가 PO로 전환되기 위해서는 proPO-activating protease (PAP)의 단백질 분해 반응에 의해 이뤄진다(Jiang et al., 1998). 이 PAP의 활성화는 일련의 세린계 단백질분해효소의 활성조절에 의해 결정된다. 이들 단백질분해효소의 활성은 억제자인 serpin의 조절을 받게된다(Kanost, 1998). 즉, 패턴인식단백질에 의해 외래인자의 인식 신호가 PAP 효소 활성 조절계를 활성화하게 된다(Kan et al., 2008). 따라서 본 연구에서 나타난 PO의 활성증가는 이들 PAP 활성화 단계의 조절 변화를 수반하게 된다.
이산화염소를 충체에 직접 주입한 결과 면역반응에 의해 증가되어야 할 PO 활성화가 억제되었다. 본 연구는 이러한 PO 활성에 미치는 이산화염소 처리 효과를 두 가지로 나누어 분석하였다. 하나는 충체에 직접 주사하여 몸 전체에서 일어난 PO 활성 분석을 조사하였다. 결과로 이산화염소는 PO의 활성을 억제시켰다. 그러나 면역처리 이후에 증가된 PO에 기내조건에서 이산화염소를 다양한 농도로 처리한 결과 전혀 변화를 주지 못했다. 이러한 사실은 이산화염소가 PO 단백질에 직접 억제 영향을 주었다기 보다는 proPO에서 PO로 진행되는 과정에서 이산화염소의 억제 작용이 작용했을 것으로 추정된다. 앞에서 기술하였듯이 proPO에서 PO로 진행되는 과정은 PAP, 세린계 단백질분해효소, serpin 등 다양한 인자가 포함된다. 또한 혈구세포에서 생합성된 proPO를 방출하는 단계에서도 이러한 억제 작용이 존재했을 수 있다. 이산화염소의 살충작용은 ROS에 기인된다(Kumar et al. 2015). 따라서 proPO에서 PO로 진행되는 과정에서 이산화염소가 생성하게 하는 ROS에 의해 억제를 이룰수 있다는 주장이 설득력을 갖게 된다. 본 연구는 혈장에 주로 존재하는 PAP이나 세린계 단백질분해효소들이 ROS에 의해 구조적 이상이 유발될 수 있다는 점에 이산화염소의 PO 억제가설을 세우게 된다. 이러한 이유는 PO 활성화에 관여하는 단백질들이 혈장에 존재하고 처리된 이산화염소의 영향을 직접 받을 수 있다는 사실에 기인된다. 즉, 이산화염소 노출은 방향성 아미노산류를 산화시켜 단백질의 변성을 유도하고 이를 통해 기능을 상실하게 한다(Ogata 2007). 예를 들어, 감기 바이러스인 influenza virus에 대해서 이산화염소는 이 바이러스가 기주의 수용체에 결합하는 데 중요한 아미노산인 153째 트립토판을 N-formylkynurenine으로 산화시켜 기능을 잃게 한다(Ogata 2012). 따라서 이산화염소의 처리에 따라 ROS가 유발되고 이는 혈장에 존재하는 세린계 단백질분해효소들의 구조적 변형을 유발할 수 있다는 점이다. 이러한 변화는 비록 면역신호가 PG에 의해 중개되고 proPO가 혈장으로 빠져나와도 PO로의 전환을 시키지 못하여 전체적 PO 활성 증가를 억제시키는 이산화염소 처리 효과를 유발하게 된다.
이상의 결과를 이산화염소가 곤충의 세포성 및 체액성 면역에 중심적 역할을 하는 PO 활성을 억제하며 이러한 억제 기작은 proPO에서 PO로 전환되는 PO 활성화 과정(Fig. 5)에서 기인된다.
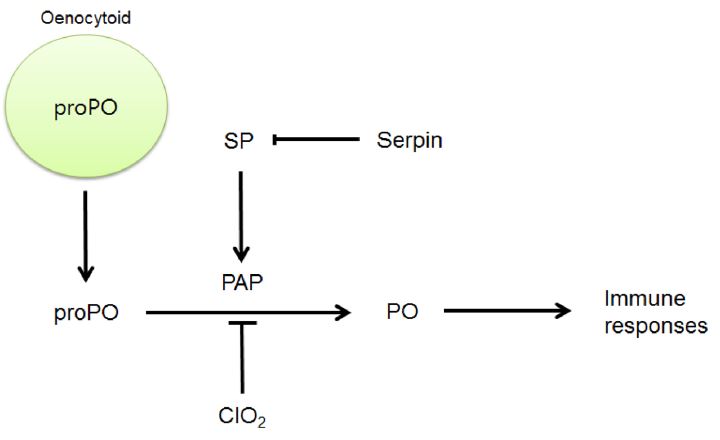
A diagram illustrating an inhibitory action of chlorine dioxide (ClO2) against prophenoloxidase (proPO) activation. proPO is synthesized in a specific hemocyte, oenocytoid and released into plasma. In plasma, proPO is activated by proPOactivating protease (PAP), which is activated by other serine proteases (SPs) that are regulated by serine protease inhibitor (Serpin). chlorine dioxide inhibits the activation process from proPO to PO.
Acknowledgments
본 결과물은 농림축산식품부의 재원으로 농림수산식품기술평가원의 농생명산업기술개발사업(114063-03)으로부터 지원을 받아 연구되었다.
Literature Cited
-
Bell, C. H., and D. J. Walker, (1973), Diapause induction in Ephestia elutella and Plodia interpunctella (Lepidoptera: Pyralidae) with a dawn dusk lighting system, J. Stored Prod. Res, 9, p149-158.
[https://doi.org/10.1016/0022-474X(73)90022-2]

-
Binder, M., V. Mahler, B. Hayek, W. R. Sperr, and M. Scheller, (2001), Molecular and immunological characterization of arginine kinase from the Indianmeal moth, Plodia interpunctella, a novel cross-reactive invertebrate pan-allergen, J. Immunol, 167, p5470-5477.
[https://doi.org/10.4049/jimmunol.167.9.5470]

-
Bradford, M. M., (1976), A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye finding, Anal. Biochem, 72, p248-254.
[https://doi.org/10.1016/0003-2697(76)90527-3]

-
Burmester, T., (2002), Origin and evolution of arthropod hemocyanins and related proteins, J. Comp. Physiol. B, 172, p95-107.
[https://doi.org/10.1007/s00360-001-0247-7]

-
Cerenius, L., and K. Söderhäll, (2004), The prophenoloxidase-activating system in invertebrates, Immunol. Rev, 198, p116-126.
[https://doi.org/10.1111/j.0105-2896.2004.00116.x]

-
Cerenius, L., B. L. Lee, and K. Söderhäll, (2008), The proPO-system: pros and cons for its role in invertebrate immunity, Trends Immunol, 29, p263-271.
[https://doi.org/10.1016/j.it.2008.02.009]

-
Cline, L. D., (1978), Penetration of seven common flexible packaging materials by larvae and adults of eleven species of stored-product insects, J. Econ. Entomol, 71, p726-729.
[https://doi.org/10.1093/jee/71.5.726]

- Decker, H., and N. Terwilliger, (2000), Cops and robbers: putative evolution of copper oxygen-binding proteins, J. Exp. Biol, 203, p1777-1782.
- Don, G., (1998), The chlorine dioxide handbook, Am. Water Works Assoc, p3-4.
-
Fontenot, E. A., F. H. Arthur, J. R. Nechols, and M. R. Langemeier, (2013), Economic feasibility of methoprene applied as a surface treatment and as an aerosol alone and in combination with two other insecticides, J. Econ. Entomol, 106, p1503-1510.
[https://doi.org/10.1603/EC12470]

-
Gibbs, S.G., J. J. Lowe, P. W. Smith, and A. L. Hewlett, (2012), Gaseous chlorine dioxide as an alternative for bedbug control, Infect. Control Hosp. Epidemiol, 33, p495-499.
[https://doi.org/10.1086/665320]

-
González-Santoyo, I., and A. Córdoba-Aguilar, (2011), Phenoloxidase: a key component of the insect immune system, Entomol. Exp. Appl, 142, p1-16.
[https://doi.org/10.1111/j.1570-7458.2011.01187.x]

-
Grieshop, M. J., P. W. Flinn, and J. R. Nechols, (2010), Effects of intra- and interpatch host density on egg parasitism by three species of Trichogramma, J. Insect Sci, 10, p99.
[https://doi.org/10.1673/031.010.9901]

-
Hallman, G. J., and T. W. Phillips, (2008), Ionizing irradiation of adults of Angoumois grain moth (Lepidoptera: Gelechiidae) and Indianmeal moth (Lepidoptera: Pyralidae) to prevent reproduction, and implications for a generic irradiation treatment for insects, J. Econ. Entomol, 101, p1051-1056.
[https://doi.org/10.1093/jee/101.4.1051]

-
Herrero, S., B. Oppert, and J. Ferré, (2001), Different mechanisms of resistance to Bacillus thuringiensis toxins in the indianmeal moth, Appl. Environ. Microbiol, 67, p1085-1089.
[https://doi.org/10.1128/AEM.67.3.1085-1089.2001]

-
Jaenicke, E., and H. Decker, (2003), Tyrosinases from crustaceans form hexamers, Biochem. J, 371, p515-523.
[https://doi.org/10.1042/bj20021058]

-
Jiang, H., Y. Wang, C. Ma, and M. R. Kanost, (1997), Subunit composition of pro-phenol oxidase from Manduca sexta: molecular cloning of subunit ProPO-P1, Insect Biochem. Mol. Biol, 27, p835-850.
[https://doi.org/10.1016/S0965-1748(97)00066-0]

-
Jiang, H., Y. Wang, and M. R. Kanost, (1998), Pro-phenol oxidase activating proteinase from an insect, Manduca sexta: a bacteria inducible protein similar to Drosophila easter, Proc. Natl. Acad. Sci. USA, 95, p12220-12225.
[https://doi.org/10.1073/pnas.95.21.12220]

-
Kan, H., C. H. Kim, H. M. Kwon, J. W. Park, K. B. Roh, H. Lee, B. J. Park, R. Zhang, J. Zhang, K. Söderhäll, N. C. Ha, and B. L. Lee, (2008), Molecular control of phenoloxidase-induced melanin synthesis in an insect, Biol. Chem, 283, p25316-25323.
[https://doi.org/10.1074/jbc.M804364200]

-
Kanost, M. R., (1999), Serine proteinase inhibitors in arthropod immunity, Dev. Comp. Immunol, 23, p291-301.
[https://doi.org/10.1016/S0145-305X(99)00012-9]

-
Kanost, M. R., H. Jiang, and X. Q. Yu, (2004), Innate immune responses of a lepidopteran insect, Manduca sexta, Immunol. Rev, 198, p97-105.
[https://doi.org/10.1111/j.0105-2896.2004.0121.x]

-
Kim, I. H., A. Y. Song, J. Han, K. H. Park, and S. C. Min, (2014), Indian meal moth (Plodia interpunctella)-resistant food packaging film development using microencapsulated cinnamon oil, J. Food Sci, 79, pE2023-E2030.
[https://doi.org/10.1111/1750-3841.12642]

-
Kumar, S., J. Park, E. Kim, J. Na, Y. S. Chun, H. Kwon, W. Kim, and Y. Kim, (2015), Oxidative stress induced by chlorine dioxide as an insecticidal factor to the Indian meal moth, Plodia interpunctella, Pestic. Biochem. Physiol, 124, p48-59.
[https://doi.org/10.1016/j.pestbp.2015.04.003]

-
Liu, Y. B., (2011), Oxygen enhances phosphine toxicity for postharvest pest control, J. Econ. Entomol, 104, p1455-1461.
[https://doi.org/10.1603/EC10351]

-
Nam, Y., J. Ji, J. H. Na, Y. S. Chun, and M. I. Ryoo, (2011), Biological control of indianmeal moth and rice weevil by parasitoids with reference to the intraspecific competition pattern, J. Econ. Entomol, 104, p693-701.
[https://doi.org/10.1603/EC10242]

-
Nappi, A. J., and B. M. Christensen, (2005), Melanogenesis and associated cytotoxic reactions: applications to insect innate immunity, Insect Biochem. Mol. Biol, 35, p443-459.
[https://doi.org/10.1016/j.ibmb.2005.01.014]

-
Ogata, N., (2007), Denaturation of protein by chlorine dioxide: oxidative modification of tryptophan and tyrosine residues, Biochemistry, 46, p4898-4911.
[https://doi.org/10.1021/bi061827u]

-
Ogata, N., (2012), Inactivation of influenza virus haemagglutinin by chlorine dioxide: oxidation of the conserved tryptophan 153 residue in the receptor-binding site, J. Gen. Virol, 93, p2558-2568.
[https://doi.org/10.1099/vir.0.044263-0]

-
Prevett, P. F., (1971), Some laboratory observations on the development of two African strains of Plodia interpunctella (Hbner) (Lepidoptera: Pyralidae) with particular reference to the induction of diapause, J. Stored Prod. Res, 7, p253-260.
[https://doi.org/10.1016/0022-474X(71)90023-3]

- Ress, D., (2004), Insect of Stored Products, CSIRO Publishing, Collingwood, Australia.
-
Ryne, C., G. P. Svensson, and C. Lfstedt, (2001), Mating disruption of Plodia interpunctella in small-scale plots: effects of pheromone blend, emission rates, and population density, density. J. Chem. Ecol, 27, p2109-2024.
[https://doi.org/10.1023/A:1012251106037]

- SAS Institute, Inc, (1989), SAS/STAT user’s guide, SAS Institute, Inc, Cary, NC.
-
Shrestha, S., and Y. Kim, (2008), Eicosanoids mediate prophenoloxidase release from oenocytoids in the beet armyworm Spodoptera exigua, Insect Biochem. Mol. Biol, 38, p99-112.
[https://doi.org/10.1016/j.ibmb.2007.09.013]

-
Shrestha, S., and Y. Kim, (2009), Various eicosanoids modulate the cellular and humoral immune responses of the beet armyworm, Spodoptera exigua, Biosci. Biotechnol. Biochem, 73, p2077-2084.
[https://doi.org/10.1271/bbb.90272]

-
Sugumaran, M., (2002), Comparative biochemistry of eumelanogenesis and the protective roles of phenoloxidase and melanin in insects, Pigment Cell Res, 15, p2-9.
[https://doi.org/10.1034/j.1600-0749.2002.00056.x]

-
Volk, C. J., R. Hofmann, C. Chauret, G. A. Gagnom, G. Ranger, and R. C. Andrews, (2002), Implementation of chlorine dioxide disinfection: effects of the treatment change on drinking water quality in a full-scale distribution system, J. Environ. Eng. Sci, 1, p323-330.
[https://doi.org/10.1139/s02-026]

-
Wijayaratne, L. K. W., and P. G. Fields, (2012), Effects of rearing conditions, geographical origin, and selection on larval diapause in the Indianmeal moth, Plodia interpunctella, J. Insect Sci, 12, p119.
[https://doi.org/10.1673/031.012.11901]

-
Zhao, P., J. Li, Y. Wang, and H. Jiang, (2007), Broad-spectrum antimicrobial activity of the reactive compounds generated in vitro by Manduca sexta phenoloxidase, Insect Biochem. Mol. Biol, 37, p952-959.
[https://doi.org/10.1016/j.ibmb.2007.05.001]
