
비티플러스 살충제의 모기 방제 효과 및 환경생물에 대한 안전성 평가
초록
비티플러스는 Bacillus thurigiensis와 면역억제가 혼합된 생물농약의 총칭이다. 본 연구는 모기류에 살충력이 높은 새로운 비티플러스 생물농약에 대해서 야외포장 조건에서 약효와 환경생물에 대한 안전성평가에 관해 수행되었다. 모기 유충에 대한 효과적 방제를 위해 두 가지 살포 처리에 따라 비티플러스의 방제 효과를 검증하였다. 비티플러스의 공중살포(3.3 m2 당 100 mL)에 따른 수계에 서식하는 모기 유충의 효과적 방제를 위해서는 최소 50%의 제제화 된 약제 농도가 요구되었다. 이에 반해 논생태계와 유사한 조건의 간이모형 조건에서 비티플러스를 수중살포한 경우 모기유충에 대한 비티플러스의 방제효과는 0.1%의 제제화 된 약제 농도에서 80% 이상의 살충 효과를 나타냈고, 0.2% 처리에서는 완전 방제 효과를 보여 주었다. 또한 유충에 비해서는 다소 낮지만 10% 설탕물에 포함된 0.1%의 비티플러스는 성충에 대해서도 40% 이상의 살충력을 나타냈다. 환경생물에 대한 안전성평가에서는 잉어(Cyprinus carpio), 큰물벼룩(Daphnia magna), 꿀벌(Apis mellifera)을 대상으로 비티플러스에 대한 독성을 평가한 결과 급성적인 영향은 주지 않는 것으로 나타났다. 이러한 결과는 논생태계에 서식하는 모기 유충방제에 비티플러스의 수중살포 처리가 유효한 방제 처리라는 것을 제시하고 있다.
Abstract
BtPlus is a group of biopesticides that are made of Bacillus thuringiensis and immunosuppressant. A new BtPlus that exhibits high insecticidal activity against mosquito larvae has been investigated in control efficacy in field conditions and its environmental safety against aquatic system. This study assessed the control efficacy of BtPlus against mosquito larvae with two different application methods. In aerial spraying application (100 mL per 3.3 m2), BtPlus was effective at 50% or above formulation concentrations to control mosquito larvae. For a direct application to aqueous mosquito habitat, a semi-field mimicking paddy rice field was constructed. In this condition, BtPlus showed 80% and 100% control efficacies at 0.1% and 0.2% concentrations, respectively. BtPlus also showed 40% mortality against adults at 0.1% concentration in 10% sugar bait. However, its control efficacies against adults were much less than against larvae. Safety assessment of BtPlus against ecosystem was evaluated using young carp (Cyprinus carpio), a water flea (Daphnia magna), and a honey bee (Apis mellifera). BtPlus did not give any adverse effects on these nontarget organisms. Based on these results, BtPlus can be applied to control mosquitoes by direct aqueous application to paddy rice field.
Keywords:
Aedes albopictus, biopesticide, BtPlus, Culex pipiens pallens, safety assessment키워드:
흰줄숲모기, 빨간집모기, 비티플러스, 생물농약, 안전성평가서 론
모기과(Culicidae) 곤충은 말라리아(malaria)와 사상충증(filariasis)과 같은 인체기생충을 매개하고 황열(yellow fever), 일본뇌염(Japanese encephalitis), 뎅기열(dengue fever), 웨스트나일(west nile) 및 최근의 소두증(microcephaly)을 유발하는 바이러스를 인체 및 가축에게 전달하는 의학해충이다(Kim et al., 2012a). 이러한 모기는 매년 7 억명 이상의 사람들에게 다양한 질병을 옮기고 있으며, 그 중 말라리아의 경우 매년 3 백만명 이상의 사람이 모기의 의해 전염된 병으로 사망한다(Kang et al., 2005).
국내에서 모기 발생은 다양한 지역과 시기에 모니터링 되었다. 발생되는 모기류의 분류는 Aedes, Anopheles, Armigeres, Coquillettidia, Culex, Hulecoeteomyia, Mansonia, Ochlerotatus, Stegomyia의 9 속을 포함하며 이 가운데 금빛숲모기(Aedes vexans nipponii), 중국얼룩날개모기(Anopheles sinensis) 및 작은빨간집모기(Culex tritaeniorhynchus)가 우점종으로 나타나고 있다(Jeong and Lee, 2003; Kim et al., 2003, 2012a). 이들 모기 방제는 화학농약(pyrethroid, organophosphate, carbamate, neonicotinoid)을 이용하여 주로 성충을 대상으로 한 화학적 방제에만 의존하여 왔다(Ahn, 2011; Kil et al., 2008). 또는 기피제를 사용하여 모기 성충으로부터 피해를 막는 간접적 방법도 포함된다(Kang et al., 2005). 반면에 모기 유충의 경우 모기의 발생장소가 되는 장소나 인공물을 변경 또는 제거시켜 모기의 발생장소를 없애는 물리적 방제(Kudom, 2015), 식물추출물 또는 곤충성장조절제 사용과 같은 화학적 방제(Choi et al., 2007; Wang et al., 2016), 천적을 이용한 지속적인 유충 포획으로 모기유충의 밀도를 감소시키는 생물적 방제(Yu and Kim, 1989), 그리고 위에 기술한 방법들을 함께 사용하는 종합적 방제(Lima et al., 2015)가 있다.
생물농약으로서 곤충병원세균인 Bacillus thuringiensis subsp. israelensis (BtI)를 이용하여 모기 유충 방제에 적용시킨 살충제가 개발되었다(Lee and Lee, 2004). 그러나 모기 유충이 서식하는 광범위한 수서 생태계를 고려할 때 약효의 증진은 유효 살포량의 감소를 이끌 수 있기에 이에 대한 노력이 경주되어 왔다. 이러한 목적으로 기존의 제품 보다 모기류 방제에 있어서 약효가 우수한 생물농약이 개발되었다(Park et al., 2016). 이러한 약효 증진은 기존에 나비목 및 딱정벌레류에서 개발된 비티플러스(BtPlus)류 살충제 개발과 동일한 개발 원리로서(Seo et al., 2011; Kim et al., 2015), 주성분의 일부가 곤충면역억제물질을 포함하기 때문에 가능하였다. 즉, 모기류에 특이적으로 살충효과를 보이는 BtI를 기반으로 곤충면역억제제를 첨가하여 새로운 비티플러스가 개발되었다. 곤충 면역은 세균을 포함한 다양한 곤충병원미생물의 병원성 발휘에 걸림돌이다. 선천성 면역반응으로만 구성된 곤충면역은 BtI와 같은 세균 침입에 대해서 세포성 면역반응을 발휘하여 식균작용 및 소낭형성을 발휘하게 된다(Hoffmann, 1995). 또한 다양한 항생펩타이드가 초기의 세포성 면역작용에 의해 제거되지 못한 세균들을 공격하는 것으로 알려지고 있다(Stokes et al., 2015). 곤충면역반응에 대해서 효과적으로 면역억제를 유도하는 여러 물질이 Xenorhabdus와 Photorhabdus 세균류에서 분비된다(Seo et al., 2012). 이들 세균류는 곤충병원선충인 Steinernema와 Heterorhabditis의 장내 세균낭(receptacle)에 각각 종 특이적으로 서식하고 있다(Kim et al., 2012b). 이 선충의 감염태가 대상 곤충의 개구부(입, 항문, 기문)를 통해 침입하게 되면 이들 장내 세균이 곤충의 혈강으로 배출된다. 곤충의 혈강에 침입한 Xenorhabdus 또는 Photorhabdus 세균류는 아이코사노이드 생합성을 억제하는 물질을 배출하여 곤충의 면역반응을 억제하게 된다(Kim et al., 2005). 아이코사노이드는 탄소수 20개의 다가불포화지방산의 산화된 형태로서 곤충의 세포성 및 체액성 면역을 중개한다(Stanley and Kim, 2014). 따라서 아이코사노이드 생합성 억제는 곤충 면역반응의 전체적 억제를 유발하게 된다. 본 비티플러스는 BtI 세균에 여러 아이코사노이드 생합성 물질을 함유하고 있는 Xenorhabdus nematophila 세균 배양액을 혼합하여 제조되었다(Park et al., 2016).
본 연구는 비티플러스 약제의 야외 실증시험의 일환으로 설계되었다. 처리될 대상 야외 조건을 농생태계의 벼 포장으로 이를 간이적으로 모형화하여 국내 수도 농생태계에 서식할 수 있는 두 종의 모기류(Aedes albopictus, Culex pipiens pallens)를 대상으로 분석하였다. 아울러 환경생물에 대한 비티플러스의 안전성도 평가하였다.
재료 및 방법
모기사육
흰줄숲모기(A. albopictus)와 빨간집모기(C. pipiens pallens)를 사육하는 실내조건은 두 모기류 모두 25 ± 1oC, 광주기 16:8h (L:D)이며, 상대습도 40~60%를 유지하였다. 약 200마리의 유충은 500 mL의 증류수가 담겨 있는 사육용기(가로× 세로 × 높이, 25 × 10 × 8 cm)에 1:1로 혼합된 어분(MillepetArtemia, Ansan, Korea)과 건조효모(Samchon Chemical, Damyang, Korea) 10 mg씩을 매일 공급하였다. 암수 성충에게는 10% 설탕물을 공급하였으며, 흰줄숲모기 암컷은 원교계 마우스(Mus musculus)를 이용한 흡혈을 통해 산란을 유도하였다. 흰줄숲모기와 빨간집모기 유충은 각각 서울대학교 농업생명과학대학의 곤충학과 곤충미생물공학 연구실과 국립보건연구원의 질병매개곤충과에서 분양을 받았다.
BtI 생물농약 비티플러스 제조
비티플러스 제조를 위한 BtI (B. thuringiensis subsp. israelensis)가 seed 배양을 위해 2 mL의 TSB (tryptic soy broth, Difco, MD, USA) 배지에서 24시간 동안 28oC에서 180 rpm의 속도로 회전진탕 배양하였다. 이 후 1 L의 TSB 배지에 1 mL가 접종되어 seed 배양과 동일한 조건으로 48시간 동안 배양되었다. 포자형성을 유도하기 위해 정지기에 도달한 TSB 배지를 4oC에서 48시간 동안 저온처리를 하였다. BtI 포자 농도는 1010 spores/mL 이상이 되도록 8,000 rpm에서 30 분간 각 배양액을 원심분리과정을 통하여 상등액인 배지성분을 제거하였으며 멸균증류수에 교반시켜 10배로 농축하였다. 기주 곤충의 면역을 억제하여 BtI의 살충력을 상승시키기 위하여 그람음성의 곤충병원세균인 Xenorhabdus nematophila (Xn)도 BtI와 동일한 조건에서 배양되었다. 비티플러스의 제조는 BtI, Xn, 보존제가 전체 양의 10%, 80%, 10%로 각각 구성되었으며, 보존제로는 에탄올 원액을 이용하였다.
비티플러스 공중살포(aerial spray)를 통한 모기 유충의 생물검정
공중살포를 통한 두 종의 모기류에 대한 비티플러스의 유효 살충력를 확인하기 위해 비티플러스 농도는 제제화된 제형 기준으로 0.1, 1, 10, 50, 100%를 처리하였다. 비티플러스 처리량은 처리 면적(90 × 90 cm)당 전체 100 mL 부피로 정하였다. 처리면적당 모기 3령 유충은 3반복으로 이루어졌으며, 각 반복당 10마리의 유충이 물 100 mL가 담겨있는 종이컵에 처리되었다(Fig. 1A). 모기 유충의 살충력은 비티플러스 공중살포 후 24 시간째에 조사가 되었으며, 물 표면에 떠오르거나 육안으로 관찰시 움직임이 없는 개체를 사충으로 인정하였다. 실험환경은 25 ± 1oC, 광주기 16:8 h (L:D)이며, 상대습도 40~60% 조건이었다. 무처리는 증류수 100mL를 살포하였다.
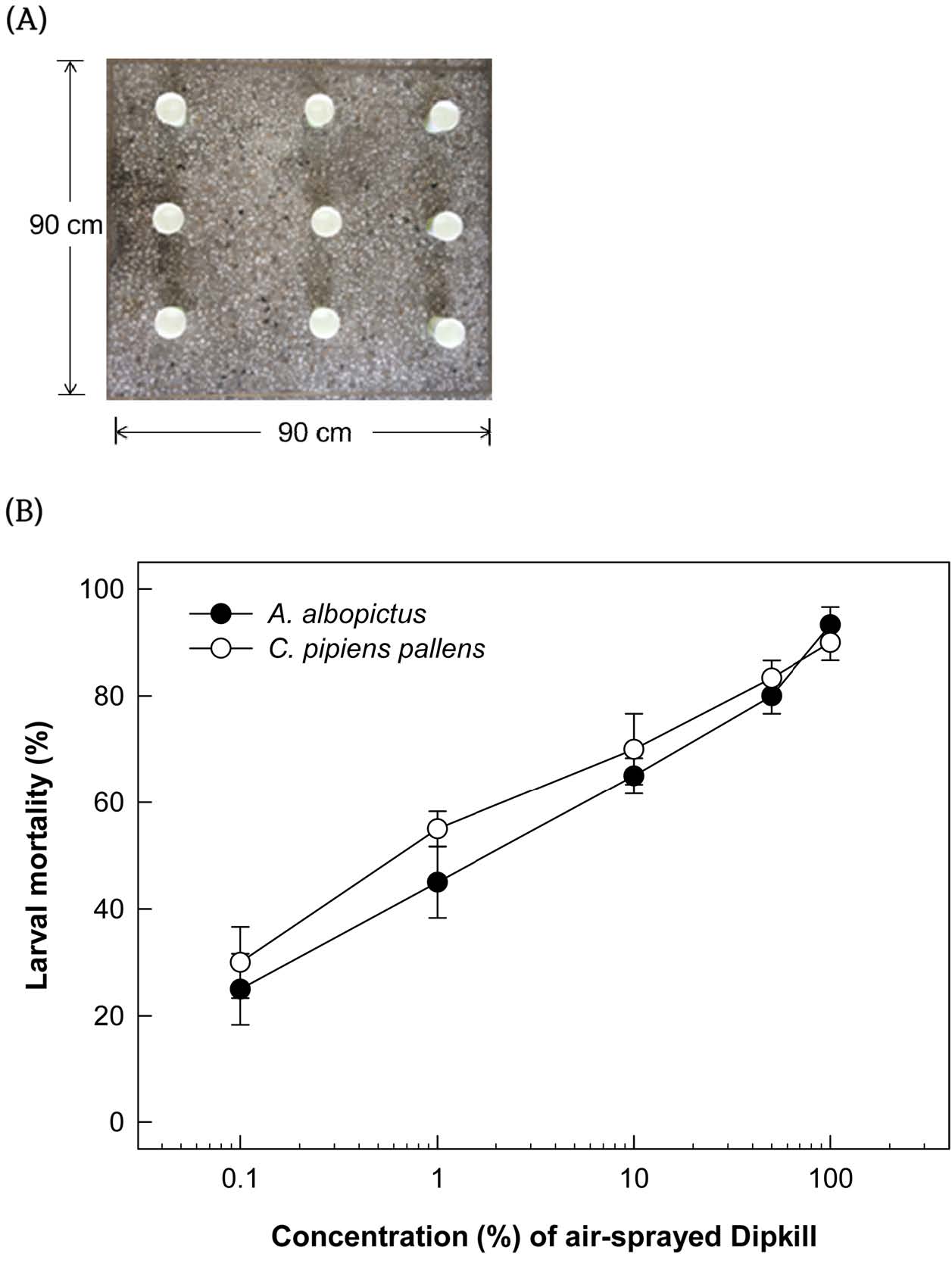
Effect of BtPlus (1010 BtI spores/mL + 80% Xn cultured broth) on mortality against two culicidae mosquitoes, Aedes albopictus and Culex pipiens pallens, by spraying in the air. (A) Space arrangement of mosquito larvae in a cup, which has 10 cm of diameter and containing 100 mL of water. (B) Doseresponse of BtPlus against two culicidae mosquito larvae. Each replication used 10 fourth instar larvae of larvae and was replicated three times. Mortality was measured at 24 h after treatment. Error bar indicate standard deviation. Different letters above standard deviation bars indicate significant difference among means at Type I error = 0.05 (LSD test).
모기 성충에 대한 비티플러스의 방제 효과 검정
모기 성충에 대한 비티플러스의 살충력을 확인하기 위해 비티플러스를 설탕물에 혼합처리 하여 성충이 설탕물을 흡즙할 때 체내로 전달되도록 하였다. 비티플러스의 처리농도는 각각 500 ppm과 1,000 ppm이였으며, 두 종의 모기류 모두 성충으로 우화한지 5시간 미만의 성충 개체를 본 실험에 이용하였다. 모기 성충의 살충력은 비티플러스 흡즙 후 24시간째에 조사가 되었으며, 육안으로 관찰시 움직임이 없는 개체를 사충으로 인정하였다. 각 처리에 30마리씩 3반복으로 처리하였다.
간이 수도생태계 모형제작 및 비티플러스 생물검정
투명 아크릴판을 이용해 간이 논 생태계 모형(100 × 50 × 10 cm)을 제작하였다. 이 모형에 고압 살균된 상토를 2 cm의 높이로 복토한 후 10 cm 간격으로 벼 유묘를 이앙하였으며, 이곳에 물 8 L를 채워 논과 동일한 환경으로 구성하였다. 비티플러스를 이용한 두 종의 모기류 유충에 대한 생물검정에서는 간이 모형에 채워진 8 L의 물을 기준으로 1,000 ppm과 2,000 ppm의 약제 처리 농도를 평가하였다. 각 농도별 3반복으로 구성되었으며, 각 반복 당 모기 유충은 30마리로 이루어졌다. 모기 유충의 살충력은 비티플러스 처리 후 24시간 째에 조사가 되었으며, 생충수를 확인한 후 사충은 육안으로 관찰시 움직임이 없는 개체 또는 조사기간 동안 호흡을 위해 물 표면에 떠오르지 않는 개체로 판별하였다.
비티플러스에 대한 급성독성평가
비티플러스에 대한 급성독성평가를 잉어(Cyprinus carpio), 큰물벼룩(Daphnia magna), 꿀벌(Apis mellifera)를 대상으로 ㈜경농 중앙연구소 안전성연구팀에서 실험을 수행하였다. 농약 및 원제의 등록기준의 기초시험 농도인 10 ppm을 기준으로 준비된 시험농도를 시험용수에 처리한 후 시험어류는 치사수 및 유영이상 증상을 96시간까지 조사하였고, 큰물벼룩은 유영 저해개체 및 유영이상 유무를 48시간까지 조사하였다. 시험어류는 전장이 3~5 cm 크기로 선별되었고, 12 L의 유리제품 수조(φ24 × 30 cm)에 시험용수는 10 L를 사용하였으며, 수온은 22 ± 2oC, pH는 7.5 ± 0.2, DO는 94.5 ± 0.8%, 광주기 16:8 h (L:D)의 수온조건으로 인위적인 산소공급은 시키지 않았으며 실험개시부터 종료시까지 절식을 유지하였다.
큰물벼룩은 태어난 지 24시간 이내의 개체를 선별하였고, 125 mL 용량의 비이커에 시험용수 100 mL을 사용하였으며, 수질 조건은 수온은 21 ± 1oC, pH는 7.4 ± 0.1, DO는 평균 94.5% (92.3-96.7), 광주기 16:8 h (L:D)으로 유지하였다. 시험용수는 미국 EPA에서 제시된 방법(U.S. Environmental Protection Agency 1985)에 따라 조제하였으며, 먹이는 Chlorella vulgaris를 순수 배양하여 1일 1회마다 1~2.5 × 106 cells/mL씩 제공하였다. 급성 독성평가에서 잉어는 각 처리 당 10개체, 큰물벼룩은 각 처리 당 30개체로 구성되었다.
꿀벌(Apis mellifera)을 대상으로 비티플러스에 대한 접촉 독성 평가를 진행하였다. 시험에 이용된 용기는 길이 15 cm, 직경 5 cm 크기의 원통형 스테인리스 철망으로 제작된 용기를 이용하였고, 시험용기의 입구는 유리 급식관(길이 5 cm, 직경 1 cm)을 끼울 수 있도록 구멍을 뚫은 스펀지 마개로 막아서 이용하였다. 접촉 독성평가에서 꿀벌은 각 처리 당 30개체로 구성되었다.
통계분석
모든 살충효과에 대한 생물검정 결과는 백분율 자료로서 arsine 변환 후 SAS PROC GLM (SAS Institute, 1989)을 이용하여 ANOVA 분석 및 처리 평균간 비교를 실시하였다.
결 과
비티플러스 공중살포를 통한 모기 유충의 생물검정
비티플러스를 이용하여 야외 모기 유충 방제를 구현하기 위해 공중 살포 시 유효 살포량을 분석할 필요가 있었다(Fig. 1). 비티플러스의 공중살포 분석은 90 × 90 cm의 사각 면적에 비티플러스 현탁액을 100 mL 공중 살포하였다(Fig. 1A). 이때 비티플러스의 농도가 증가함에 따라 두 모기류(흰줄숲모기: F=109.50; df=5, 12; P<0.0001, C. pipiens pallens: F=98.67; df=5, 12; P<0.0001)에 대한 살충력도 높아졌다. 제형화된 비티플러스를 기준으로 0.1%를 살포하였을 때 흰줄숲모기는 20%, 빨간집모기는 25%의 살충력을 처리 후 24시간에 나타내었으며, 비티플러스 50% 이상을 살포하였을 때 두 모기류 모두에서 78% 이상의 살충력이 확인되었다. 비티플러스 100% 처리에는 두 모기 유충 종 모두 완전 방제 효과를 나타냈다. 두 모기 종간에 비티플러스에 대한 감수성 차이는 나타나지 않았다(P>0.05, Fig. 1B). 따라서 공중 살포로 모기 유충을 방제하기 위해서는 최소한 제형화된 약제로 50% 농도(살포액 기준으로 500,000 ppm)로 살포해야 효과적이라는 결과를 얻었다.
간이 논 생태계 모형에서 비티플러스를 이용한 모기 유충 생물검정
공중 살포를 통해 모기 유충을 방제하는 것은 현실적으로 비경제적이라는 배경에 논 생태계 수중 처리를 시도하였다(Fig. 2). 8 L의 물량을 수용할 수 있는 논 생태계 모형을 이용하여 비티플러스의 모기 유충 방제 효과를 분석하였다. 간이 논 생태계는 벼의 유모가 이앙되어 실제 논과 유사한 환경에서 실험을 진행하였다(Fig. 2A). 그 결과 두 종류 농도의 비티플러스의 처리에 대한 흰줄숲모기(F=36.00; df=2, 6; P<0.0005)와 빨간집모기(F=58.33; df=2, 6; P<0.0001)의 약제 감수성이 나타났으며, 두 모기에 대한 비티플러스의 살충력 차이는 확인되지 않았다(P>0.05, Fig. 2B). 0.1%(=1,000 ppm)의 제형화된 비티플러스를 비티플러스 처리한 후 24 시간 경과될 때 흰줄숲모기는 80%, 빨간집모기는 83%의 살충력이 나타났으며, 0.2% (=2,000 ppm)의 비티플러스 처리에서는 두 종의 모기류 모두 100%의 살충력이 확인되었다.
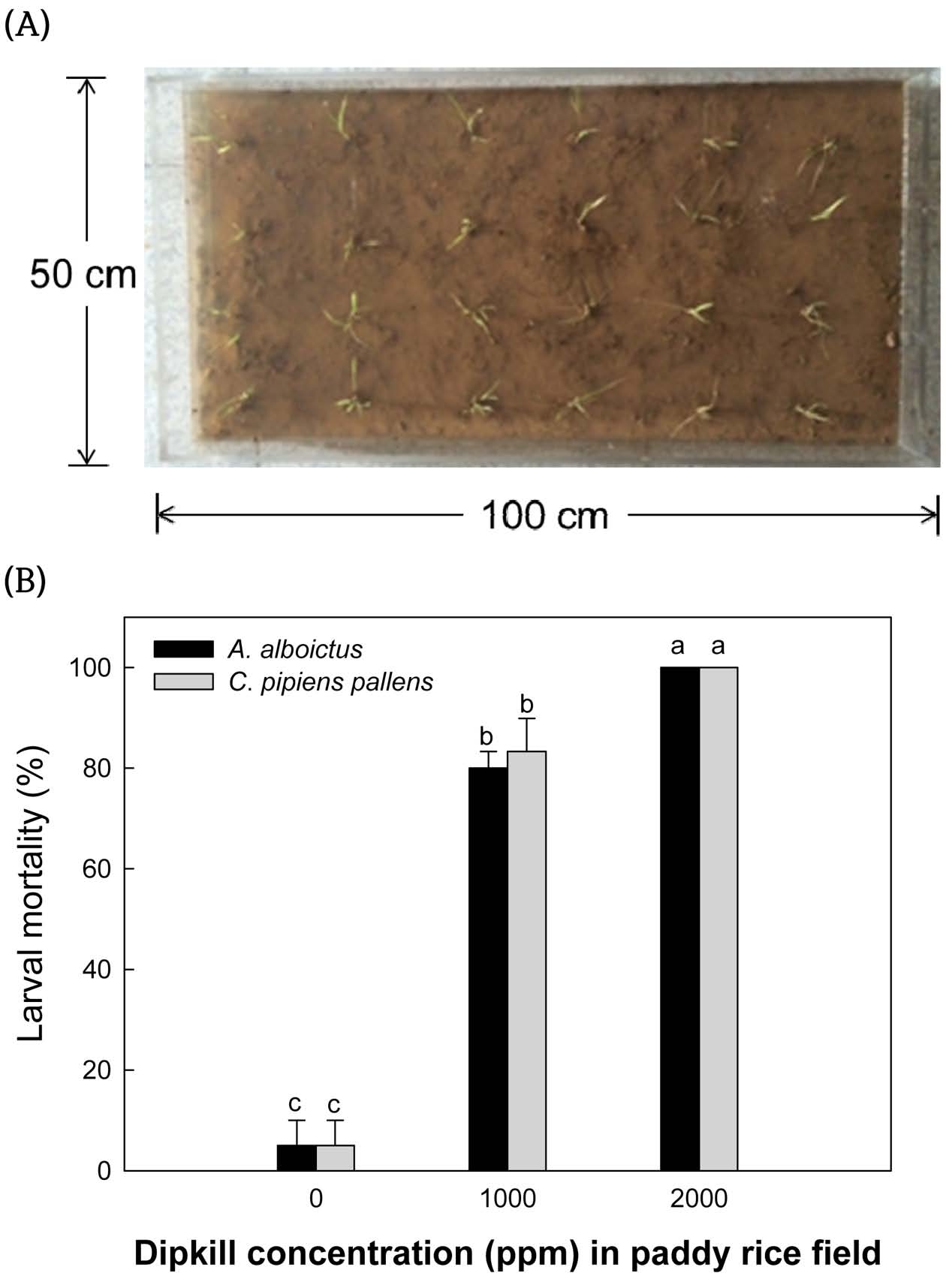
2. Effect of BtPus (1010 BtI spores/mL + 80% Xn cultured broth) on mortality against two culicidae mosquito larvae, Aedes albopictus and Culex pipiens pallens, in Semi-field condition. (A) Designation of semi-field condition for mosquito bioassay. (B) Mosquito larvicidal effect of BtPlus on mortality against two culicidae mosquito larvae. Each replication used 50 fourth instar larvae and was replicated three times. Mortality was measured at 24 h after treatment. Error bar indicate standard deviation. Different letters above standard deviation bars indicate significant difference among means at Type I error = 0.05 (LSD test).
비티플러스를 이용한 모기 성충의 생물검정
모기 성충에 대한 비티플러스 처리는 흰줄숲모기와 빨간집모기에 대한 통계적으로 유의한 살충력이 확인되었다(Fig. 3). 이들 두 모기류의 살충력은 비티플러스 처리 농도에 의존하여 증가하는 경향을 보여주었다(흰줄숲모기: F=318.50; df=2, 6; P<0.0001, 빨간집모기: F=360.50; df=2, 6; P<0.0001). 제형화된 비티플러스 기준으로 0.05% (=500 ppm)의 비티플러스 처리 후 72시간 째에 흰줄숲모기는 25%, 빨간집모기는 30%의 살충력을 나타내었으며, 0.1% (=1,000 ppm)의 비티플러스 처리 시 흰줄숲모기는 45%, 빨간집모기는 50%의 살충력을 나타내었다. 무처리와 비교하여 비티플러스 1,000 ppm의 경우 모기 성충의 방제효과가 흰줄숲모기와 빨간집모기에서 40%와 45%로 확인되었다.
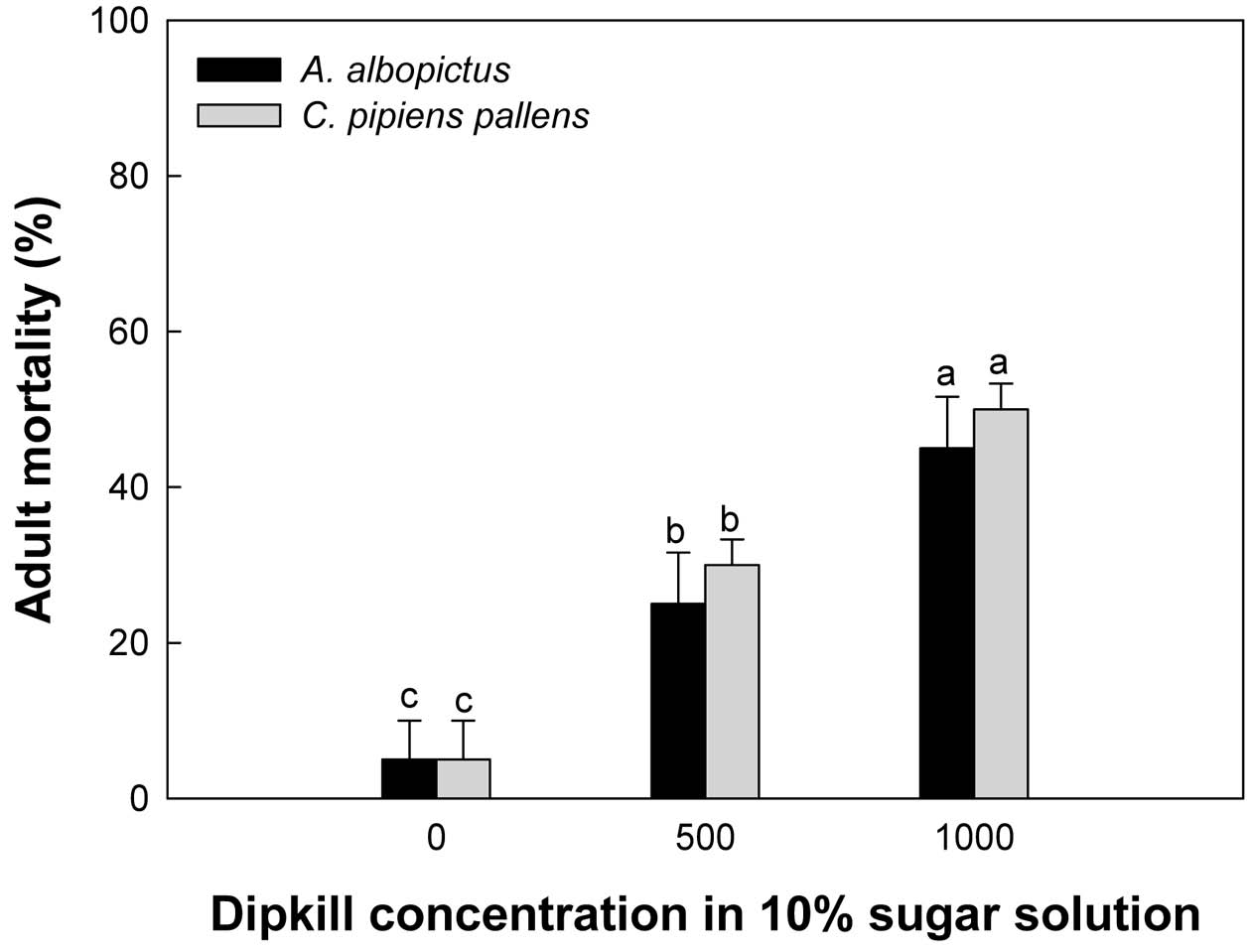
Effect of BtPlus (1010 BtI spores/mL + 80% Xn cultured broth) on mortality against two culicidae mosquito adults, Aedes albopictus and Culex pipiens pallens. Each replication used 10 adults and was replicated three times. Mortality was measured at 24 h after treatment. Error bar indicate standard deviation. Different letters above standard deviation bars indicate significant difference among means at Type I error = 0.05 (LSD test).
비티플러스의 환경생물에 대한 안전성 평가
잉어와 큰물벼룩을 대상으로 비티플러스 10 mg/L에 대한 급성독성평가를 진행하였다. 잉어를 이용한 급성독성평가에서 비티플러스 처리 후 96 시간까지 치사어(Table 1)와 일반적인 중독증상으로 보이는 특이한 증상(Table 2)이 나타나지 않았다. 시험에 이용한 잉어의 전장과 체중 평균은 4.6 ± 0.3 cm, 0.9 ± 0.2 g이었다. 큰물벼룩을 이용한 급성독성평가에서도 비티플러스 처리 후 48시간까지 유영 저해를 보이는 개체(Table 3)와 일반적인 중독증상을 보이는 개체(Table 4)가 관찰되지 않았다. 또한 꿀벌을 이용한 접촉 독성시험 결과 100 μg a.i./bee 농도에서 48시간까지 치사개체는 관찰되지 않았다(Table 5).

Acute toxicity of BtPlus (1010 BtI spores/mL + 80% Xn cultured broth) to common carp, Cyprinus carpio

Symptoms of BtPlus (1010 BtI spores/mL + 80% Xn cultured broth) intoxication with respect to acute toxicity of common carp, Cyprinus carpio

Effect of BtPlus (1010 BtI spores/mL + 80% Xn cultured broth) on mobility of the water flea, Daphnia magna

Symptoms of BtPlus (1010 BtI spores/mL + 80% Xn cultured broth) intoxication with respect to swimming behavior of the water flea, Daphnia magna
고 찰
비티플러스는 B. thuringiensis (Bt) 기반의 살충제이다(Kim, 2015). 다양한 Bt 종류가 갖는 선택적 해충 적용 범위를 이용하여 대상 해충을 결정하게 된다. 비교적 Cry1 독소에 감수성인 나비목은 B. thuringiensis subsp. kurstaki 또는 B. thuringiensis subsp. aizawai를 주요 Bt로 이용하는 반면 Cry3 독소 단백질에 감수성인 딱정벌레류에는 B. thuringiensis subsp. tenebrionis를 이용하여 제작하게 된다(Seo et al., 2010; Park et al., 2015). 반면에 본 연구에서 이용한 비티플러스의 경우는 파리목에 살충력이 높은 Cry4 독소 기반의 B. thuringiensis subsp. israelensis를 이용하게 된다(Park et al., 2016). 여기에 곤충면역저하 물질을 포함한 X. nematophila 배양액을 혼합하여 살충력을 향상시킨 여러 비티플러스를 개발하여 왔다. 본 연구는 이 가운데 비티플러스 약제가 현장 적용성이 있는 지를 밝히는 데 목적을 두고 연구를 진행했다. 이를 분석하기 위해 두 가지 방향으로 접근하였다. 하나는 살포방법이고 다른 하나는 생태계 안전성 부분이다. 우선 살포방법에 따른 현장 적용성을 분석하기 위해 공중살포와 수중살포의 두 가지 방법을 비교하였다. 대상은 논생태계로 이에 대한 모형을 구축하고 처리하였다. 논생태계는 일반 자연 수계에 비해 모기 유충에 대한 포식어 밀도가 다양하여 이에 따라 모기 밀도가 다양하게 존재한다(Yu and Kim, 1989). 이러한 논생태계의 모형에 대한 비티플러스의 공중살포가 다양한 농도로 실시되었다. 효과적으로 모기 유충을 방제할 수 있는 농도는 적어도 50% 이상의 비티플러스가 처리되어야 한다. 본 연구에서는 3.3 m2 (1평)를 기준으로 100 mL의 비티플러스 살포량을 선행 연구에서 결정하였다. 따라서 50%의 비티플러스의 약량이 투입되려면 상품화된 비티플러스의 1,000 ppm 기준 농도로 고려하여 볼 때 논 1평에 50,000 mL 즉 50 L의 약제 살포가 이뤄져야 한다는 결론이 나온다. 이는 현실적으로 불가능한 처리 방법으로 볼 수 있다. 다른 처리 방법은 수중처리 방법을 검토하였다. 이는 실내 실험에서 시험관 내에서 1,000 ppm의 비티플러스는 16시간 이내에 100% 방제효과를 주었기 때문에 실시되었다. 이를 논생태계 모형에 적용한 결과 실내 실험 결과에 비해서 낮은 방제 효과가 나타났다. 1,000 ppm의 비티플러스가 논생태계 수중에 처리될 경우 약 80-83%의 방제효과를 나타내었다. 2,000 ppm으로 처리될 경우 완전방제효과를 보여 실내 시험관 처리 효과 보다 높은 농도가 야외에 처리되어야 비티플러스의 방제 효과를 줄 수 있다는 결론을 얻게 되었다. 본 연구에 사용된 비티플러스 약제는 액제 형태이기에 수중 약제의 용해도 문제는 고려하지 않았다. 그러나 약제를 고체 제형으로 제형화 할 경우 수중 처리 시에 용해도 문제가 고려되어야 한다. 국내 토양에서 얻은 BtI 균주를 대상으로 두 종류의 제형화를 이뤄 수중 처리하여 방제 효과를 비교한 결과 수화제에 비해 액상수화제가 동일한 약효 성분을 기준으로 할 때 높았다는 결과가 있다(Seo et al., 2010). 따라서 액상으로 제형화된 비티플러스의 경우는 논생태계 수중살포의 경우는 수화제가 겪는 수중 용해 및 확산에 대한 문제는 낮을 것으로 예상된다.
논생태계를 대상으로 비티플러스를 처리할 경우 주변 생태계에 미치는 영향이 검토되어야 한다. 이에 본 연구에서는 수계 생태계를 대표할 수 있는 척추동물과 무척추동물을 대상으로 비티플러스의 독성을 분석하였고, 화분 매개 유용곤충인 꿀벌에 대한 독성 평가를 아울러 병행하였다. 분석된 결과는 비티플러스가 이러한 생태계 비표적 동물들에게 해로운 영향을 주지 않는다는 결론을 얻었다. 비티플러스의 주성분인 BtI는 친환경적 미생물농약이다. Bt 약제의 살충력은 대상 곤충의 특이적 생리 현상에 기반을 두고 있기에 비교적 선택적이다. 즉 곤충의 장 내에서 알칼리성의 pH는 Bt의 내독소 단백질을 용해하고, 이와 더불어 내독소단백질의 활성을 유도하는 소화효소의 작용이 필수적이고 이후 내독소단백질과 곤충 소화관 수용체간의 특이적 결합을 통해 살충력이 발휘된다(Bravo et al., 2011). 따라서 Bt 자체만으로도 생태계 비표적동물들에 영향을 주지 않게 된다.
비티플러스의 또 다른 주성분은 Xn 세균 및 이 세균의 배양액이다. 곤충 병원세균인 Xn은 아이코사노이드 생합성 억제를 통해 기주곤충의 면역중계반응을 효과적으로 교란시킨 후 대상 곤충에게 패혈증을 유발하여 살충효과를 일으킨다(Park and Kim, 2000). 이러한 면역억제는 곤충의 특이적인 인지질분해효소(PLA2)를 억제하면서 야기된다(Kim et al., 2005). PLA2 활성에 의해 유리되어 나오는 전구물질이 arachidonic acid로서 이 물질의 다양한 산화물이 아이코사노이드로 전환되어 곤충의 면역과 생식과 같은 다양한 생리 기능에 관여하는 것으로 알려져 있다(Stanley and Kim, 2014). Xn이 생성하여 분비하는 대사물질은 BZA, Pro-Tyr, acetylated Phe-Gly-Val, oxindole, indole, p-hydroxypropionic acid, cyclo-Pro-Tyr, 그리고 4-hydroxyphenylacetic acid 등으로 모두는 곤충의 PLA2 활성을 억제하는 것으로 분석되었다(Shrestha et al., 2010; Seo et al., 2012). 따라서 작용점인 PLA2의 분자 구조 분석을 통해 동물체 상호간 억제자에 대한 상대적 감수성 차이를 고찰해 볼 필요가 있다. PLA2의 구조 변이는 동물체 및 생성하는 조직에 따라 사이에 다양하여 이 유전자는 하나의 유전자군(gene family)을 형성하게 되고 최소 12 개 이상의 세부 분류군으로 나뉘게 된다(Schaloske and Dennis, 2006). 그러나 일반적으로 이들 세부 분류군을 크게 3 부류로 모아서 분비성 PLA2 (sPLA2), 칼슘비의존형 세포성 PLA2 (iPLA2)그리고 칼슐의존형 세포성 PLA2 (cPLA2)로 나누어 부르게 된다(Stanley and Kim, 2014). 곤충에서 면역에 관련된 최초의 PLA2는 거짓쌀도둑거저리(Tribolium castaneum)에서 동정되었고, 이는 4 종류의 sPLA2로 판명되었다(Shrestha et al. 2010). 이후 파밤나방에서 iPLA2가 동정되었고, 이 효소의 활성은 세포성 면역과 밀접하게 연동되었다(Park et al., 2015). 아직 cPLA2는 곤충에서 동정되지 않았다. 현재까지 밝혀진 곤충류의 PLA2의 구조를 살펴보면 척추동물의 PLA2와 높은 상동성을 보여주고 있다. 따라서 Xn의 대사물질은 척추동물의 PLA2에 영향을 줄 수 있다는 것이 구조적 설명이다. 그러나 이 Xn의 포유류에 대한 독성 실험이 진행되었으며, 전혀 해로운 영향을 주지 않는 결과를 얻었다(Park et al., 2010). 본 연구는 이들 물질이 수서생태계에 존재하는 잉어와 왕물벼룩에게도 영향을 주지 않는 것으로 나타났다. 이러한 사실은 Xn 대사물질 자체만으로는 경구 독성이 없는 데에서 유래되며 또한 동물체 상호간 PLA2 구조적 불일치가 이러한 상대적 독성 차이를 유발하였을 것으로 사료된다. 본 연구에서 나타난 모기 성충에 대한 비티플러스의 독성은 BtI의 독소단백질의 가능성과 비티플러스에 존재하는 Xn 대사물질의 효과로 볼 수 있다. 이에 대한 개별적 독성 분석이 필요하다.
결론적으로 본 연구는 비티플러스가 모기 유충이 발생되는 논생태계에 수중살포 방법으로 방제 효과를 나타낼 수 있으며, 수서 생태계에 존재하는 비표적 동물들에게 해로운 영향을 주지 않고 꿀벌과 같은 유용곤충에도 독성을 보이지 않아 안전성을 확보하여 주었다. 그러나 토양과 수중에서의 비티플러스에 대한 잔류성 평가는 진행되지 않아 추후 이에 대한 연구가 필요하다.
Acknowledgments
본 연구는 농림축산식품부의 재원으로 농림수산식품기술평가원의 농생명산업기술개발사업(313006-3)이 김용균에게 그리고 2016년도 한국연구재단의 기초연구사업(No. 2013R1A1A2061353)이 박영진에게 각각 지원되어 수행되었습니다.
References
- Ahn, Y., (2011), Evaluation of insecticide resistance of vector mosquitoes, Seoul National University, Seoul, Korea.
-
Bravo, A., S. Likitvivatanavong, S. S. Gill, and M. Soberón, (2011), Bacillus thuringiensis: A story of a successful bioinsecticide, Insect Biochem. Mol. Biol, 41, p423-431.
[https://doi.org/10.1016/j.ibmb.2011.02.006]

-
Choi, S. Y., S. C. Oh, M. S. Cho, S. K. Paek, J. S. Kim, D. A. Kim, M. R. Gill, Y. N. Youn, and Y. M. Yu, (2007), Bioassay of environment-friendly insecticides for management of mosquito, Culex pipiens molestus, Kor. J. Appl. Entomol, 46, p261-267.
[https://doi.org/10.5656/KSAE.2007.46.2.261]

-
Hoffmann, J. A., (1995), Innate immunity of insects, Curr. Opin. Immunol, 7, p4-10.
[https://doi.org/10.1016/0952-7915(95)80022-0]

- Jeong, Y. S., and D. K. Lee, (2003), Prevalence and seasonal abundance of the dominant mosquito species in a large march near coast of Ulsan, Kor. J. Appl. Entomol, 42, p125-132.
- Kang, S. H., S. A. Jang, J. B. Han, D. K. Seo, C. H. Song, M. K. Kim, Y. L. Kim, S. H. Choi, I. K. Kim, and G. H. Kim, (2005), Comparative efficacy of mosquito repellents against Aedes albopictus (Diptera: Culicidae), Kor. J. Appl. Entomol, 44, p243-249.
-
Kil, M. R., D. A. Kim, S. K. Paek, J. S. Kim, S. Y. Choi, D. Y. Jin, and Y. N. Yu, (2008), Characterization of Bacillus thuringiensis subsp, tohokuensis CAB167 isolate against mosquito larva. Kor. J. Appl. Entomol, 47, p457-465.
[https://doi.org/10.5656/KSAE.2008.47.4.457]

-
Kim, E., S. Jeoung, Y. Park, K. Kim, and Y. Kim, (2015), Novel formulation of Bacillus thuringiensis for the control of brassica leaf beetle, Phaedon brassicae (Coleoptera: Chrysomelidae), J. Econ. Entomol, 108, p2556-2565.
[https://doi.org/10.1093/jee/tov245]

-
Kim, Y. K., C. M. Lee, J. B. Lee, and S. B. Bae, (2012a), Seasonal prevalence of mosquitoes and ecological characteristics of Anopheline larval occurrence in Gimpo, Gyeonggi Province, Republic of Korea, Kor. J. Appl. Entomol, 51, p305-312.
[https://doi.org/10.5656/KSAE.2012.07.0.017]

-
Kim, S. K., Y. Flores-Lara, and P. S. Stock, (2012b), Morphology and ultrastructure of the bacterial receptacle in Steinernema nematodes (Nematoda: Steinernematidae), J. Invertebr. Pathol, 110, p366-374.
[https://doi.org/10.1016/j.jip.2012.04.011]

-
Kim, Y., D. Ji, S. Cho, and Y. Park, (2005), Two groups of entomopathogenic bacteria, Photorhabdus and Xenorhabdus, share an inhibitory action against phospholipase A2 to induce host immunodepression, J. Invertebr. Pathol, 89, p258-264.
[https://doi.org/10.1016/j.jip.2005.05.001]

-
Kim, H. C., K. W. Lee, R. S. Richards, S. S. Schleich, W. E. Herman, and T. A. Klein, (2003), Seasonal prevalence of mosquitoes collected from light traps in Korea (1999-2000), Kor. J. Entomol, 33, p9-16.
[https://doi.org/10.1111/j.1748-5967.2003.tb00043.x]

-
Kudom, A. A., (2015), Larval ecology of Anopheles coluzzii in Cape Coast, Ghana: water quality, nature of habitat and implication for larval control, Malar. J, 14, p447.
[https://doi.org/10.1186/s12936-015-0989-4]

-
Lee, W. J., and D. K. Lee, (2004), Laboratory assessment of a formulated Bacillus thuringiensis var, israelensis against five medically important species of mosquito larvae in Republic of Kor. J. Asia Pac. Entomol, 7, p133-136.
[https://doi.org/10.1016/S1226-8615(08)60209-5]

-
Lima, E. P., M. O. Goulart, and M. L. Rolim Neto, (2015), Metaanalysis of studies on chemical, physical and biological agents in the control of Aedes aegypti, BMC Public Health, 15, p858.
[https://doi.org/10.1186/s12889-015-2199-y]

-
Park, Y., and Y. Kim, (2000), Eicosanoids rescue Spodoptera exigua infected with Xenorhabdus nematophila, the symbiotic bacteria to the entomopathogenic nematode Steinernema carpocapsae, J. Insect Physiol, 46, p1469-1476.
[https://doi.org/10.1016/S0022-1910(00)00071-8]

-
Park, Y., S. Kumar, R. Kanumuri, D. Stanley, and Y. Kim, (2015), A novel calcium-independent cellular PLA2 acts in insect immunity and larval growth, Insect Biochem. Mol. Biol, 66, p13-23.
[https://doi.org/10.1016/j.ibmb.2015.09.012]

-
Park, Y., (2015), Entomopathogenic bacterium, Xenorhabdus nematophila and Photorhabdus luminescens, enhances Bacillus thuringiensis Cry4Ba toxicity against yellow fever mosquito, Aedes aegypti (Diptera: Culicidae), J. Asia Pac. Entomol, 18, p459-463.
[https://doi.org/10.1016/j.aspen.2015.05.002]

- Park, Y., J. K. Jung, and Y. Kim, (2016), A mixture of Bacillus thuringiensis subsp. israelensis with Xenorhabdus nematophila-cultured broth enhances toxicity against mosquitoes Aedes albopictus and Culex pipiens pallens (Diptera: Culicidae), J. Econ. Entomol, In printed.
- SAS Institute, Inc, (1989), SAS/STAT User’s Guide, release 6.03 Ed, SAS Institute, Cary, NC.
-
Seo, S., S. Lee, Y. Hong, and Y. Kim, (2012), Phospholipase A2 inhibitors synthesized by two entomopathogenic bacteria, Xenorhabdus nematophila and Photorhabdus temperata subsp, temperata. Appl. Environ. Microbiol, 78, p3816-3823.
[https://doi.org/10.1128/AEM.00301-12]

-
Seo, S., and Y. Kim, (2011), Development of “Bt-Plus” biopesticide using entomopathogenic bacteria (Xenorhabdus nematophila, Photorhabdus temperata ssp, temperata) metabolites. Kor. J. Appl. Entomol, 50, p171-178.
[https://doi.org/10.5656/KSAE.2011.07.0.24]

-
Seo, M. J., Y. J. Gil, T. H. Kim, H. J. Kim, Y. N. Youn, and Y. M. Yu, (2010), Control effects against mosquitoes larva of Bacillus thuringiensis subsp, israelensis CAB199 isolate according to different formulations. Kor. J. Appl. Entomol, 49, p151-158.
[https://doi.org/10.5656/KSAE.2010.49.2.151]

-
Shrestha, S., Y. Hong, and Y. Kim, (2010), Two chemical derivatives of bacterial metabolites suppress cellular immune responses and enhance pathogenicity of Bacillus thuringiensis against the diamondback moth, Plutella xylostella, J. Asia Pac. Entomol, 13, p55-60.
[https://doi.org/10.1016/j.aspen.2009.11.005]

-
Schaloske, R. H., and E. A. Dennis, (2006), The phospholipase A2 superfamily and its group numbering system, Biochimica et Biophysica Acta, 1761, p1246-1259.
[https://doi.org/10.1016/j.bbalip.2006.07.011]

-
Stanley, D., and Y. Kim, (2014), Eicosanoid signaling in insects: from discovery to plant protection, Crit. Rev. Plant Sci, 33, p20-63.
[https://doi.org/10.1080/07352689.2014.847631]

-
Stokes, B. A., S. Yadav, U. Shokal, L. C. Smith, and I. Eleftherianos, (2015), Bacterial and fungal pattern recognition receptors in homologous innate signaling pathways of insects and mammals, Front. Microbiol, 6, p19.
[https://doi.org/10.3389/fmicb.2015.00019]

- U.S. Environmental Protection Agency, (1991), Methods for measuring the acute toxicity of effluents to freshwater and marine organisms, 4th Ed, USEPA, Cincinnati, OH.
-
Wang, Z. Q., H. Perumaisamy, M. Wang, S. Shu, and Y. J. Ahn, (2016), Larvicidal activity of Magnolia denudata seed hydrodistillate constituents and related compounds and liquid formulations towards two susceptible and two wild mosquito species, Pest Manag. Sci, 72, p897-906.
[https://doi.org/10.1002/ps.4064]

- Yu, H. S., and H. C. Kim, (1989), Integrated control of vector mosquitoes with native fishes (Aplocheilus and Aphyocypris) and Bacillus thuringiensis (H-14) in natural rice fields of Korea, Kor. J. Appl. Entomol, 28, p167-174.