Polychlorinated Biphenyl의 작물-토양간 흡수 이행성
초록
Polychlorinated biphenyls는 잔류성 환경 오염물질로서 내생호르몬 대사 교란 효과를 포함한 다양한 생리 독성을 나타내는 것으로 알려져 있다. 해당 물질의 환경 동태에 관한 연구는 토양 중, 분해소실과 관련된 연구가 주로 수행되었으며, 한편 생물과 관련 연구는 동물 중, 대사 및 독성 작용에 대한 연구를 대상으로 실시되어 왔다. 이와 같은 연구는 주로 Aroclor 등, 혼합물을 위주로 진행되었으며, 따라서 개별 이성질체에 관한 연구는 매우 제한적으로 수행되었다. 본 연구에서는 수용해도 및 염소 치환체의 위치가 상이한 polychlorinated biphenyl 이성질체 5종을 합성하여, 토양 중 분포 및 당근으로의 이행에 관련한 분해-소실 및 생물농축 과정에 대한 연구를 수행하였다. Biphenyl 및 polychlorinated biphenyl 이성질체의 토양 중 반감기는 biphenyl, PCB-1, PCB3, PCB-77 및 PCB-126에 대하여 각 20.2, 16.0, 11.6, 46.5 및 198.0일이었으며, 지용성이 강한 이성질체일수록, 반감기가 길게 나타났다. 한편 당근 중 biphenyl, 및 polychlorinated biphenyls 농도는 PCB-126을 제외한 시료에서 식재 후, 10-20일 내외에 최고 농도에 도달하여, 0.4-2.6 mg/kg의 농도가 식재 후 90일까지 유지되었으며 당근-토양간 PCB의 농도비는 90일 경과 시료의 경우 biphenyl, PCB-1, PCB-3, PCB-77, 및 PCB-126에 대하여 각각 1.7, 8.1, 1.9, 1.8, 5.9로 나타났다. 일정 경과 시간 후 농도비가 상기와 같이 유지되는 현상은 당근의 비대생장에 따른 희석효과에 따른 것으로 사료된다. 한편 당근에 흡수된 PCBs의 총량은 재배기간 중 지속적으로 상승하여 PCB-126의 경우, 90일 경과시 토양 잔류량 대비, 1.1%가 당근에서 검출되었다.
Abstract
Polychlorinated biphenyls (PCBs) are ubiquitous environmental contaminants, found in the many environments. PCBs exerts various toxicological effects, including endocrine-disrupting activity. Most researches with these toxicants performed with soil matrix with mixtures of congeners, namely Aroclor, while the biological activities have been tested with animals. However, studies with pure congeners are limited. In this study, 5 congeners were synthesized and their fates (bioaccumulation, degradation, kinetics) were studied in carrot-soil system. The soil half-lives of biphenyl, PCB-1, PCB-3, PCB-77, and PCB-126 were 20.2, 16.0, 11.6, 46.5, 198.0 days, respectively. In general, the longer half-lives were observed with the higher hydrophoicity of PCBs. Times, required for maxium accumulation of PCBs in carrot (Tmax) were 10-20 days for most congeners and the concentrations were 0.4-2.6 mg/kg. The concentrations of PCBs in carrot were kept as constant after Tmax, except PCB-126. The concentration ratio between carrot and soil after 90 days of treatment were 1.7, 8.1, 1.9, 1.8, and 5.9 for biphenyl, PCB-1, PCB-3, PCB-77, and PCB-126. Because of the increase of biomass, the total residual amount of PCBs in carrots however, increased till the end of experiment. The portions of PCB-126 in carrot were 1.1% of the soil residues at 90 days after planting.
Keywords:
Bioaccumulation, biodegradation, carrot, polychlorinated biphenyl, soil키워드:
Polychlorinated biphenyl, 토양, 당근, 생물농축, 생분해서 론
Polychlorinated biphenyls (PCBs)은 다핵방향족 탄화수소 및 유기염소계 농약과 함께 광범위한 환경 시료에서 검출되는 잔류성 유기오염물질이다. PCBs는 절연제 및 난연제로서 특히 미국 등에서 사용되었다(George et al. 1988; Ross 2004). PCBs는 염소의 치환수 및 위치에 따라 총 209종의 이성질체가 존재하며, 다양한 생리학적 독성을 나타내는 것이 알려져 있다(Giesey and Kannan 1998; Ross 2004). 예를 들면 co-planar PCBs의 일종인 PCB-126 (3,3',4,4',5-pentachlorobiphenyl)의 경우, poly-chlorinated dibenzo-pdioxin(PCDD)와 유사한 내분비장애 독성을 나타내어, 해당 이성질체의 TEF는 TCDD 기준, 0.1로서 매우 강한 독성을 나타내는 것이 알려져 있다. 한편 PCB는 환경에 따라 다양한 대사 경로를 거치는 것이 알려져 있으며, 예를 들어 탈염소화에 의한 다른 이성질체로의 전환, hydroxy PCBs 또는 methylsulfonyl PCBs로의 대사 등이 알려져 있다(Grimm et al., 2015). PCBs의 식물에 대한 독성 관련 연구는 주로 Aroclor 등의 PCBs 혼합물을 이용하여 수행되었으며, 일부 식물의 경우, 생육억제 효과가 있는 것으로 보고되었다(Weber and Mrozek 1979). 환경 중, 잔류성 문제가 제기되고 있는 유기 염소계 농약, 다핵방향족 탄화수소(PAHs), PCBs 및 TCDDs 등의 물질은 생태계에서의 농축(생물농축)이 일반적으로 관찰되고 있다. 예를 들어, Anabaena 등의 식물성 플랑크톤의 PCBs 생물농축계수는 4.1-4.6 내외로 나타나 수서 생태계 중, 해당 물질의 농축과 이에 따른 독성 발현이 가능하다고 알려졌다(Skoglund et al., 1996). 한편 이와 같은 유기화합물의 생물농축 현상은 수계는 물론, 토양 환경에서도 일어나는 것이 잘 알려져 있다. 그러나 토양의 경우, 수계에서 일반적으로 관찰되는 환경 구성인자보다는 매우 복합적이며 다양한 요인이 관여하여, 적절한 연구방법의 설정, 결과의 도출이 어렵다. 예를 들어 어류 중, 생물농축 연구 시, 지용성 생물조직과 수계 등, 비교적 간단한 두 가지 상간의 분배계수로 예측이 가능하나, 토양의 경우, 토양 공극수, 토양 유기물의 함량 및 성질, 수분, 미생물 존재유무 등에 따라 다양한 결과가 도출될 수 있다.
상기한 바와 같이 작물 중, 유기물 흡수 이행은 매우 다양한 요인에 영향을 받는 것으로 알려져 있다. 기존 연구에 따르면, 호박 및 화본과 목초의 토양 잔류 PCB의 흡수/이행 관련 연구 결과, 화본과 식물이 호박과 비교하여 매우 효과적인 흡착을 나타내는 것이 보고되었다(Chu et al., 2006; Low et al., 2009; Whitfield et al., 2007). 한편 식물 종에 따라 근권에서 흡착된 유기물의 지상부 조직으로의 이행성 역시 차이가 있으며, 상기한 연구에 따르면, 호박의 경우, PCB 등의 지용성 유기물의 근권에서의 흡수력은 낮으나, 지상부 조직으로 이행은 매우 빠르게 일어나는 것이 관찰되었다(Whitfield et al., 2007). 이와 같은 점을 고려하면 지상부로의 이행성이 높은 식물의 경우, 오염 토양에서의 식물 생육 및 이용 시, 안전성이 확보되기 어렵다고 하겠다. 따라서 오염 토양에서의 식물자원의 이용은 이와 같은 다양한 특성에 대한 연구가 선행되어, 해당 자원의 안전성을 검증하는 절차가 필수적이다.
본 연구에서는 PCB 이성질체 중, 구조적 특성이 상이한 5종의 이성질체를 합성하여, 토양에 처리한 후, 대표적 근경 식물일 당근을 식재하여, 경과 시간에 따른 토양 및 작물 중, PCB의 농도변화를 검정하고, 실험 기간 중, PCB의 농축/분해소실 경향을 연구하여, 이성질체의 물성에 따른 생물농축 및 분해 경로간 상관관계를 밝히고자 하였다.
재료 및 방법
재료 및 시약
Biphenyl 표준품(>98%) 및 유기용매는 HPLC급으로 Sigma-Aldrich Korea 및 Fisher Scientific (USA)에서 구입하여 사용하였다. 기타 시약으로 크로마토그래피용 silica gel은 Merck사의 제품을 사용하였으며, ethyl acetate 등 대사물 추출용 용매는 대정사의(Korea) 제품을 구입, 사용하였다. PCB-1, PCB-3, PCB-77 및 PCB-126은 Suzuki coupling 방법으로 합성하고, column chromatography를 이용, 정제하여(순도 >99%) 사용하였다(Kim et al., 2016).
PCB 이성질체의 토양 처리 및 당근 재배
실험에 사용한 토양은 경기도 남양주시 소재, 밭토양을 채취, 음건 후, 작물 잔사 등을 제거 후, 사용하였으며, 토성은 사질양토, pH 5.92, 유기물 함량, 2.5%, CEC 15.6 meq/100 g이었다. Biphenyl 및 PCBs 표준용액(acetone, 20 mL)을 상기의 토양(20 kg)에 가하여, 화합물별 토양 중 농도를 biphenyl, PCB-1, PCB-3, 및 PCB-77은 1.5 mg/kg, PCB-126의 경우, 0.8 mg/kg으로 조절하였다. 시료를 혼합한 다음, 차광 조건하 실온에서 48시간 건조하고, 증류수(200 mL)을 가하여 혼합 후, 실험용 pot (20*20*40 cm)에 가한 다음, 2일간 방치하였다. 실험용 당근은 세장형 미니당근(아시아베이비, 아시아종료)에서 구매하여, 화합물 비처리구 토양에서 재배, 발아 후, 30일의 모종을 pot별 3구 식재한 다음, 실온에서 0, 15, 30, 60 및 90일 후 채취하여 실험에 사용하였다. 재배 기간 중, 증류수를 이용하여 토양 수분 함량은 30-40% 내외로 조절하였다. 토양 시료는 채취 후, 실온에서 24 시간 음건하여, 혼합한 다음, -20oC에서 보관하였다. 당근 시료는 증류수로 세척하여, 표면에 부착된 토양을 제거한 다음 -20oC에 보관하였다. 실험구는 PCBs 이성질체별로 3반복으로 수행하였다.
Biphenyl 및 PCB 추출 및 정제
시료(당근, 6.25 g)을 분취하여, acetone (100 mL)을 가한 다음, Waring blender를 이용하여 5분간 마쇄한 다음, sonicator를 이용하여 60분간 추출하였다. 추출물을 감압여과 후, 잔사를 동일한 조건에서 추출하여 여액을 합하였다. 여액을 감압, 건고 후, 잔사는 dichloromethane (50 mL)에 재용해하여, 무수 Na2SO4로 건조한 다음, 용매를 제거하고 잔사는 dichloromethane (10 mL)에 재용해하여, 아래와 같은 column chromatography를 수행하였다. 상기의 용액을 적층 황산 silica gel column (column 하단에서부터 silica gel, 0.1 g, 5% 황산-silica gel, 0.9 g, 및 무수 Na2SO4, 0.1 g)에 가하여 용출한 다음, dichloromethane (5 mL)을 추가하여 PCBs를 용출하였다. Column 분획을 감압 건고한 다음, dichloromethane (250 uL)에 용해한 다음, gas chromatographymass spectrometry (GC-MS)에 주입하여 PCBs 정량 분석을 수행하였다.
토양 시료의 경우, 동일량의 시료(6.25 g)를 acetone (150 mL)을 가한 다음, sonicator로 60분간 2회 추출하여 상기의 당근 시료와 동일한 방법으로 정제 및 분석을 수행하였다.
분석법의 회수율은 상기의 방법에 따라 토양 및 당근에 분석 대상물질의 농도가 0.1 및 0.5 mg/kg이 되도록 처리하여 수행하였다.
분석기기 및 분석조건
Biphenyl 및 PCBs 분석은 Shimadzu GC-2010/SE GCMS로 수행하였으며, Restek사의 Rtx-5MS (30 m, 0.25 mm i.d., 0.25 μm thickness) column을 사용하였다. Column 온도조건은 초기온도 170oC로 10분간 유지 후, 2oC/분로 승온하여 290oC에서 20분간 유지하였으며, injector 온도는 250oC, interface 온도는 275oC로 설정하였고, Helium carrier gas는 1 mL/분으로 유지하였다. Biphenyl 및 PCB의 정성분석은 total ion chromatogram (m/z 50-500)에서 실시하였으며, 정량 분석은 selected ion monitoring (SIM) mode로 수행하였다. SIM 분석을 위한 정량/(정성) ion으로는, biphenyl의 경우, m/z 154 (biphenyl); PCB-1 및 PCB-3, 188/(152, 190), 292/(220/288); 및 PCB-126, 326/(254/324)를 선정하여 분석을 수행하였다. TIC 및 SIM 분석 시 시료는 2 μL를 주입하였다.
PCB congener의 logP 측정 및 logKoc 예측
Biphenyl 및 PCBs의 logP는 HPLC를 이용한 US-EPA 방법을 이용하여 구하였다(US-EPA, 1996). 표준물질로는 benzene, biphenyl, naphthalene, phenanthrene, anthracene, 및 pyrene 등을 사용하였다. LogP가 알려진 상기 물질 표준용액(5 mg/L, MeOH)을 Eclipse XDB C-18 column (4.6 × 250 mm, 5 μm)에 주입하여 아래의 HPLC 조건으로 분석을 수행하였다. HPLC는 Waters 사의 E-2695 model로, 이동상은 MeOH/water (7:3, v/v), 1 mL/min, UV/Vis 검출파장은 254 nm로 설정하였으며, 상기 표준용액 20 μL를 주입하여 표준물질의 머무름시간(retention time)을 구하였다. 이와 같이 얻어진 retention time과 문헌상 logP간의 선형회귀식(linear regression equation)을 구하였다. PCBs 표준용액(5 mg/L, MeOH)을 동일 조건으로 분석하여 얻어진 retention time을 상기의 선형회귀식에 대입하여 연구대상물질의 logP를 계산하였으며, biphenyl 및 4종 PCB congener의 logP는 biphenyl, PCB-1, PCB-3, PCB-77, 및 PCB-126에 대하여 각각 3.25, 3.62, 3.91, 4.91, 및 5.54로 관찰되었다. 토양흡착계수(logKoc)는 상기의 logP를 바탕으로 EPI Suite를 이용하여 예측하였다(EPI Suite ver. 4.11, US EPA).
결과 및 고찰
Biphenyl 및 PCB congener 분석법
당근 및 토양 중 biphenyl 및 PCBs의 회수율은 71-110% 내외로 나타났으며, biphenyl, PCB-1 및 PCB-3등 휘발성이 높은 시료의 경우, 저농도 처리구(0.1 mg/kg)의 회수률이 전반적으로 낮았으나, PCB-77 및 PCB-126 시료의 회수율은 93-110%로 다소 높은 경향을 나타내었다(Table 1). 당근 및 토양 중, 정량 분석은 SIM mode로 수행하였으며, 이는 TIC mode 분석의 경우, 매우 다양한 당근 중 일차 및 이차 대사물(예: falcarinol 등의 polyacetylene, carotene등 지용성 대사물)에 의한 영향으로 검출한계가 전반적으로 높게 나타났기 때문이다. SIM mode에서의 두 가지 시료군에 대한 검출한계는 0.01-0.05 mg/kg이었다.
Biphenyl 및 PCB congener의 토양 중 소실
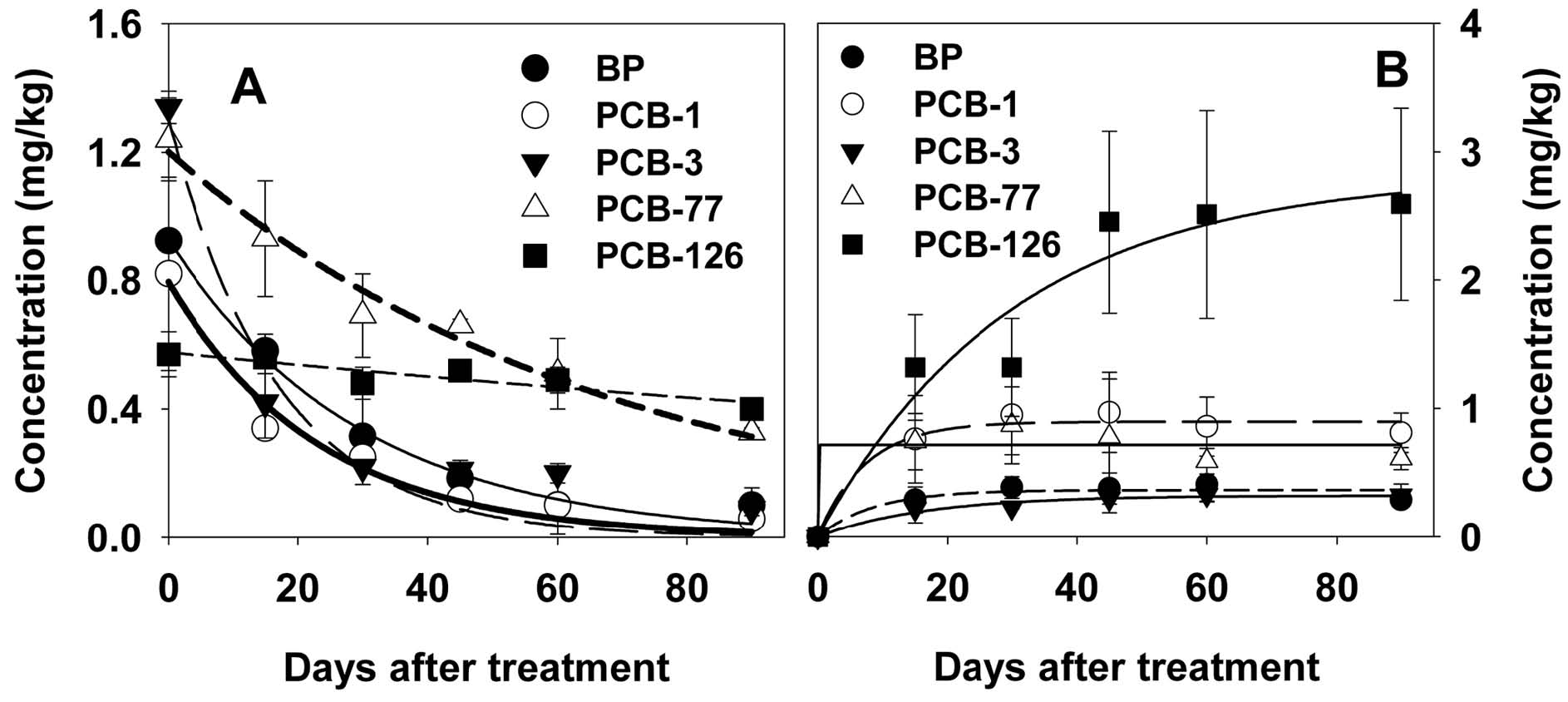
재배 토양 중, biphenyl 및 PCBs는 화합물의 종류에 따라 상이한 속도로 감소되었다. Biphenyl, PCB-1, 및 PCB-3의 경우, 비교적 빠른 속도로 소실된 반면, PCB-77 및 PCB-126은 완만한 속도로 감소되어, PCB-126의 경우, 90일 경과 후에도 초기 농도의 90% 내외가 토양 중에 잔류함을 알 수 있었다(Fig. 1). 분석대상물의 농도는 일차반응 곡선에 따라 감소하는 것으로 사료되며, 이에 따른 개별 화합물의 토양 중 반감기는 11.6-198.0일이었다(Table 2). 토양 중 환경 오염물질의 농도는 다양한 요인에 의하여 영향을 받으며, 토성, 유기물 함량, 토양 pH, 토양 미생물상 등, 토양 고유의 성질에 관련된 요인과 오염 물질의 수용성, 안정성, 증기압 등의 화합물의 물성에 관련된 요인으로 나눌 수 있다. 한편 biphenyl을 비롯한 다양한 방향족 물질의 토양 흡착은 물리화학적 성상 중, 수용성 정도에 의하여 결정되며, logP 및 Koc (또는 logKoc) 등으로 대표되는 관련 성질은 미생물에 의한 유기물의 분해 및 용탈 등의 환경 중, 오염물질의 이행을 결정하는 주요 인자로 알려져 있다(Sabjic and Nakagawa 2014). 이와 같은 요인 중, 토양흡착계수(Koc)는 환경 중 소실 속도와 상관관계가 있다. 이는 높은 흡착계수의 물질의 경우, 미생물이 분해에 사용할 수 있는 토양 용액 중 물질 농도가 낮아서 생분해 역시 지연되며, 강우 등에 의한 용탈 또한 저해된다(Weissenfels et al. 1991). 지용성 지표로 사용되는 logP는 토양 흡착계수(logKoc)와 양호한 직선상관관계를 나타내며, 환경 오염물의 동태예측에도 이용되고 있다(Seth et al., 1999). 이와 같은 점을 고려하여, 본 연구에서는 logP를 HPLC법으로 측정하고, EPI Suite를 이용하여 logKoc를 계산하였다. Biphenyl, PCB-1, PCB-3, PCB-77, 및 PCB-126의 logKoc는 각 2.82, 3.14, 3.39, 3.78, 및 4.16이었다. 본 연구에 사용된 biphenyl, PCB-1, 및 PCB-3의 경우 반감기는 11.6일인 반면 높은 logKoc를 가진 PCB-77 및 PCB-126은 46.5-198.0일로 나타나 이와 같은 토양흡착성이 화합물의 소실에 일부 요인으로 작용할 수 있음을 알 수 있었다. 한편 작물 재배가 없는 노지 토양 또는 실내 토양 연구의 경우, 치환염소수가 2-5 내외의 PCB 이성질체의 토양 중 반감기는 0.5-5년으로 보고된 바 있다(Ayris and Harrad, 1999; Doick et al., 2005a). 이와 같은 차이점은 토성, 기후 등의 다양한 요인과 함께, 식물 및 미생물상의 조성에 따라 PCBs 소실 경향이 달라질 수 있기 때문이다. 특히 당근 등의 근채류 작물의 경우, 오염 토양으로부터, 비교적 다량의 PCBs를 흡수할 수 있음이 보고되었다(Javorska et al., 2011).
Biphenyl 및 PCB congener의 당근 시료 중 동태
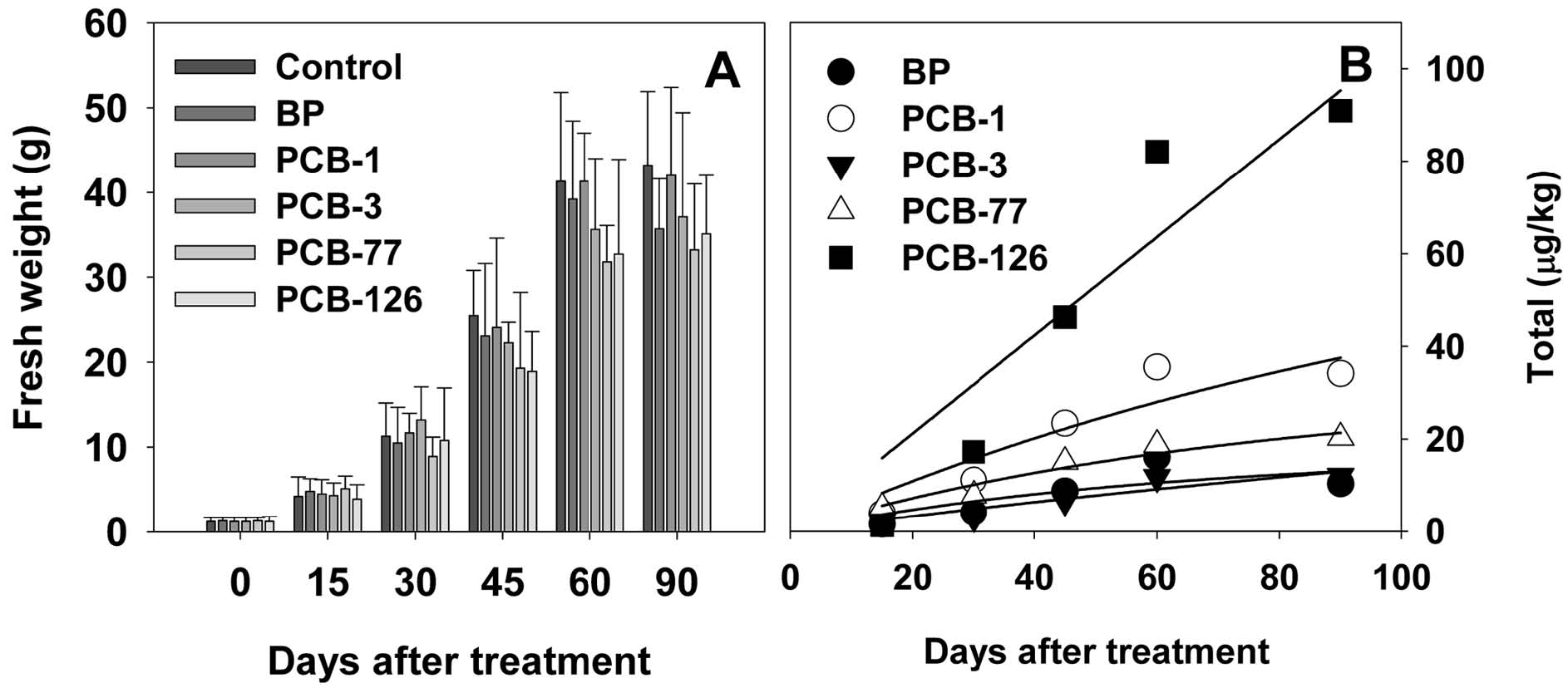
당근 중, biphenyl 및 PCBs의 농도는 토양과는 달리, 재배 초기의 빠른 증대와 함께, 90일 경과 후, 0.2-2.6 mg/kg의 농도로 완만한 증가 또는 평형상태를 나타내었다(Fig. 1). 대부분의 화합물은 대략 15-30일 경과 후, 농도가 일정하게 유지되었으나, PCB-126 처리구의 경우, 90일 경과까지 PCB의 농도가 지속적으로 증가하였다. 그러나 농도 변화 추이와 비교하여, 흡수된 PCBs의 총량은 실험 종료일까지 지속적으로 증대되었다(Fig. 2). 근채류로서 당근은 재배기간 중, 지속적으로 중량이 증대되어, 대략 식재 후 60일까지 성장하였으며, 따라서 해당 기간 중, 비대성장 효과에 의하여, 집적된 PCBs의 농도는 완만한 증가 또는 평형을 나타내었으나, 당근 근부에 흡수된 PCBs의 총량은 지속적으로 증대되는 것으로 사료된다. Low 등은 호박을 이용한 연구에서, 재배 기간의 경과에 따라 초기에는 PCBs의 농도가 빠르게 증가하나 일정기간 경과 후에는 농도가 일정하게 유지된다고 하였고, 흡수 총량은 호박의 성장에 따라 지속적으로 증가된다고 하였다(Low et al., 2009). PCB-126의 경우, 다른 congener와 비교하여, 초기의 당근 중 농도 및 총량 증가 속도는 낮았으나, 재배기간 후반에 매우 빠른 속도로 흡수가 진행된 것을 보인다.
한편 PCBs 및 PAHs 등의 작물 흡수 이행성과 관련한 기존 연구에 따르면 해당 물질의 지용성과 흡수량간에 강한 상관관계가 있다고 알려져있다(Ayris and Harrad, 1999; Iwata and Gunther, 1976). Liu 및 Schnoor는 hybrid poplar의 양액 재배 중, PCB congener의 뿌리 조직 농축 현상을 연구하여 logP가 클수록 root concentration factor (RCF)가 큰 값을 지닌다고 하였다(Liu and Schnoor, 2008). 이와 같이 생물계-수계로 구성된 비교적 간단한 계의 경우, logP등의 지용성 인자와 생물농축계수(BCF)는 일반적으로 강한 선형상관관계를 나타내는 것으로 알려져 있다(Devillers et al., 1996). 그러나 본 연구에 사용한 PCBs의 경우, 이와 같은 상관관계는 관찰되지 않았다. 예를 들어, PCB-126은 당근 중 농축 현상이 잘 관찰되었으나, biphenyl 및 다른 PCB congener의 경우 logP (및 Koc)와 PCBs 농도 및 총량간의 관계가 나타나지 않았다(Figs. 1-3). 이와 같은 현상이 나타난 원인으로는 화합물 구조 특이적 흡착-탈착 또는 배출, 화합물 별로 다른 aging 등을 고려할 수 있다(Doick et al., 2005b; Whitfield et al., 2007). 토양 환경 중 오염물질은 aging과정을 통하여 토양 용수 또는 입자표면 등, 비교적 생물학적 이용도가(bioavaibility) 높은 분획에서 humin 등의 난분해성 토양유기물에 흡착되어 bioavailability가 낮아질 수 있다. 그러나 해당 과정의 원리 및 다양한 구조의 토양오염물질의 aging이 식물 흡수에 미치는 영향에 대한 연구는 매우 제한적이다. 이와 같은 aging 효과를 추후 검토할 예정이다.
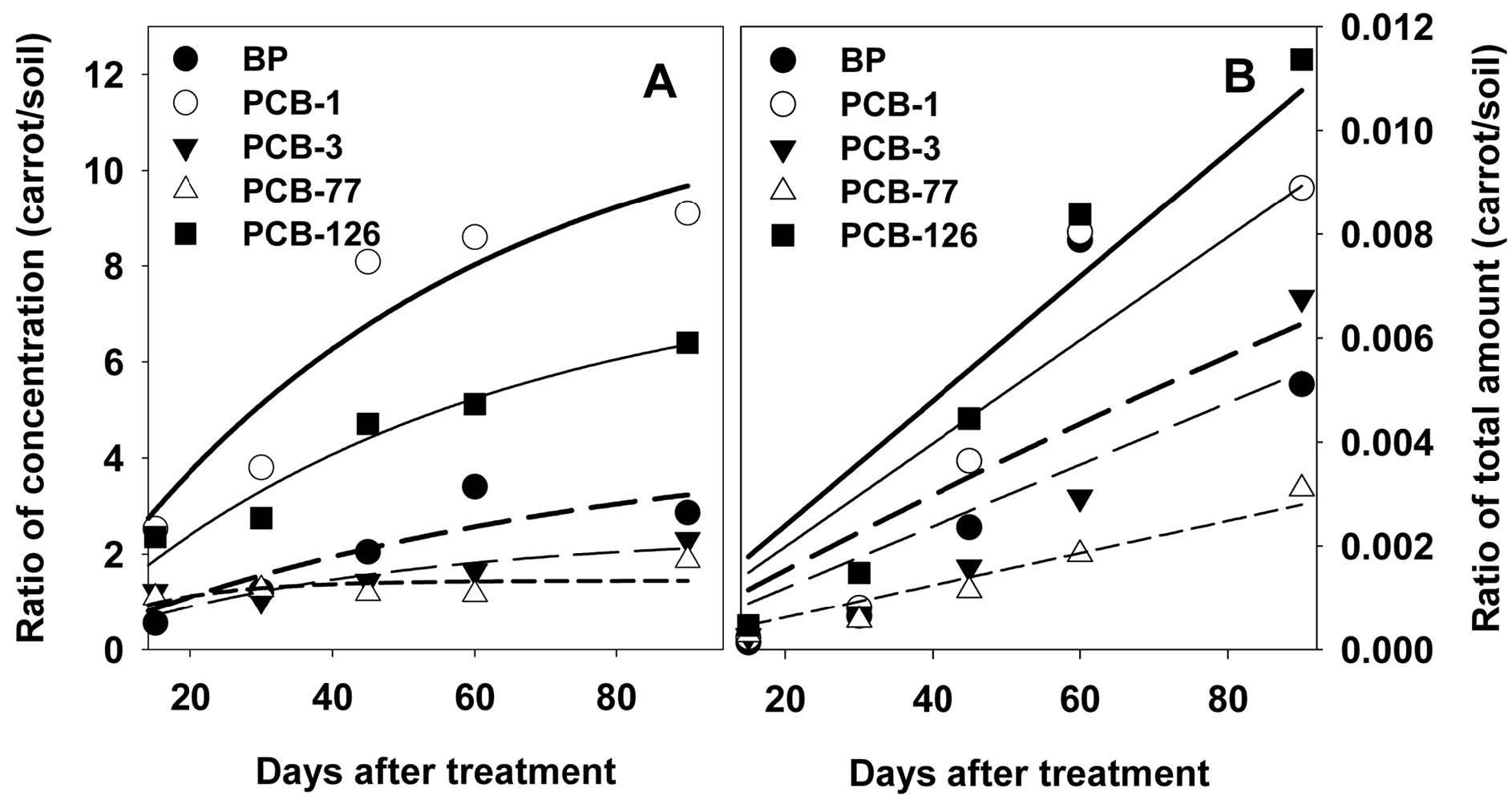
Biphenyl 및 PCB congener의 당근-토양간 이행
당근-토양 중 biphenyl 및 PCBs의 농도비는 실험 기간 중 지속적으로 증가하였다(Fig. 1). 처리 후 90일 경과 시료의 경우, 농도비는 대략 1.2-8.1 내외로 물질에 따라 상이한 농축비율을 나타내었다. PCB-5를 이용한 종전 연구에 따르면, 토양 중 PCBs의 작물로의 이행에 의한 농축비는 작물 종 및 조직에 따라서 차이가 나며, 일반적으로 근부 조직의 농축비가 높아서 근부조직-토양간의 농도비가 대략 0.4-5.3으로 나타났다(Li et al., 2011). PCB congener의 혼합물인 Aroclor를 이용한 연구에서는 congener에 따라 0.04-0.8 내외의 당근-토양 중 PCBs 농도비가 보고되었다(Iwata and Gunther, 1976). 한편 토양 잔류성 및 물리화학적 성상이 PCBs와 유사한 유기염소계 농약의 경우, 당근에 대한 농축비는 0.6-1.1 내외로 보고되었다(Waliszewski et al., 2008; Witczak and Abdel-Gawad, 2012). Aroclor를 일부 연구에 따르면, 작물로의 흡수이행은 congener의 logP와 통계적 유의성이 있는 상관관계를 나타내지만, 일부 congener의 경우, 구조-특이적 흡수가 나타나는 것으로 밝혀졌다(Whitfield et al., 2007). 저분자량의 유기물의 경우, 생물체에 대한 흡수는 일반적으로 확산(passive diffusion)에 따른 것이지만 기존 연구에 따르면 일부 유기염소계 화합물의 경우 능동수송(active transport)에 의하여 흡수되기도 하는 것으로 보인다(Chu et al., 2006). 한편 이와 같은 흡수-이행 연구와 함께, 식물을 이용한 토양 중 오염물질 추출/제거 측면의 연구도 보고되었다(Javorska et al., 2011; Whitfield et al., 2007; Zeeb et al., 2006). 이들 연구에 따르면, PCBs의 식물 흡수는 식물종, 토성, congener의 물성 등에 따라 차이가 나타나며, 지용성 congener일수록 식물조직에서의 축적이 뚜렷하게 나타난다고 하였다. 식물을 이용한 오염물의 추출/제거는 일반적으로 오염토양의 복원에 사용 가능한 방법의 일환으로 연구되고 있다.
한편 상기의 농도 추이와 함께, 작물 중 흡수된 독성물질의 총량에 관한 연구 역시 중요한데, 기존 보고는 대부분 총량 보다는 농도 변화를 주요 연구 대상으로 수행되었다. 이와 같은 점은 당근 및 무 등, 재배기간 중 중량 변화가 큰 작물의 경우, 비대생장에 의한 희석효과 및 흡수와 관련된 표면적 증가를 고려하여야 하기 때문이다. 연구에 사용한 당근의 90일 경과 후 개체 중량은 평균 32-44 g 내외로 식재일과 비교 20-30배의 생체중 증가가 나타났으며, 개체별 흡수된 PCBs의 총량은 10.1-87.9 μg이었다(Fig. 2). 이는 토양 잔류 biphenyl 및 PCBs의 양(1.04-8 mg/20 kg)과 비교하면 0.05-1.1%에 해당하는 양이다. 환경 중 난분해성 오염물질의 식물 농축과 관련하여 다양한 모델이 제시되고 있는데, 대표적인 것으로 초기의 급격한 축적과 일정 경과시간 후 완만한 속도로 축적이 이루어져 극대값에 이르는 아래와 같은 모델식이 제시된 바 있다(Nizzetto et al., 2008).
y = Concentration of contaminants in plants at specified time
y0= Initial concentration of contaminants in plants
PCBs 및 PAHs등 다수의 환경 매질에 존재하는 오염물질의 식물로의 농축은 여러 compartment로 구성된 상기 equation 2와 같은 multi-compartment model을 이용하여 해석하는 것이 일반적이다. 그러나 본 연구에서는 PCB 비오염 토양에 연구대상물질을 처리하여 사용한 바, equation 1을 적용하여 모델을 구성하였다(Table 3). 당근 중 PCBs의 총량과 경과시간에 대한 분석 결과 PCBs의 경우, 모델식의 상관계수(r2)는 0.8570-0.9520로 비교적 양호하게 나타났다. 해당 식에 따르면 당근 중 축적되는 PCBs의 총량은 최대 16.69-283.12 μg으로 예측되었다. 그러나 biphenyl의 상관계수는 매우 낮게 나타났는데, 이는 biphenyl 또는 PCBs의 저분자량 congener의 경우, 다양한 식물 대사과정의 영향 등을 배제할 수 없기 때문이다(Rezek et al., 2007). 또한 상기 모델은 토양 중 오염물의 농도변화가 반영되지 않았으며, 해당 사항이 반영된 세부 연구의 필요성이 제기되었다.
결 론
본 연구는 농업환경 중, PCBs의 식물로의 흡수/이행 관련 연구의 일환으로 다양한 PCBs 이성질체의 식물에 대한 흡수/이행성과 PCBs의 물성간의 상관관계를 밝히기 위하여 수행되었다. Biphenyl 및 PCBs의 토양 환경 중, 잔류성은 biphenyl 모핵 구조에 치환된 염소의 수효가 증가할수록 잔류성이 증대하여, 긴 반감기를 나타내는 것을 알 수 있었으며, 한편 염소의 치환 위치에 따라서 생분해 또는 소실 속도가 상이함이 밝혀졌다. 당근으로의 흡수 이행성은 대부분의 이성질체에서 잔류량의 평형상태 도달에 장기간이 소요되었다. 특히 PCB-126의 경우, 토양잔류성이 매우 강하여, 실험기간 중, 지속적 생물농축량의 증대가 관찰되었으며, 이와 같은 사실은 환경 중, 검출되는 다수의 고지용성 이성질체의 경우, 작물의 재배기간의 지속성에 비례하여, 다량의 PCB가 작물에 농축될 수 있다는 점을 나타내는 것이다.
Acknowledgments
본 연구는 농촌진흥청의 연구개발비(작물 재배환경 중 유해화학물질의 안전관리기준 설정 연구, 과제번호 PJ011435)로 수행되었으며 이에 감사드립니다.
References
-
Ayris, S., and S. Harrad, (1999), The fate and persistence of polychlorinated biphenyls in soil, J. Environ. Monit, 1, p395-401.
[https://doi.org/10.1039/a903017d]

-
Chu, W. K., M. H. Wong, and J. Zhang, (2006), Accumulation, distribution and transformation of DDT and PCBs by Phragmites australis and Oryza sativa L.: I, Whole plant istudy. Environ. Geochem. Health, 28, p159-168.
[https://doi.org/10.1007/s10653-005-9027-8]

-
Devillers, J., S. Bintein, and D. Domine, (1996), Comparison of BCF models based on logP, Chemosphere, 33, p1047-1065.
[https://doi.org/10.1016/0045-6535(96)00246-9]

-
Doick, K. J., E. Klingelmann, P. Burauel, K. C. Jones, and K. T. Semple, (2005a), Long-term fate of polychlorinated biphenyls and polycyclic aromatic hydrocarbons in an agricultural soil, Environ. Sci. Technol, 39, p3663-3670.
[https://doi.org/10.1021/es048181i]

-
Doick, K. J., P. Burauel, K. C. Jones, and K. T. Semple, (2005b), Distribution of aged 14C-PCB and 14C-PAH residues in particle-size and humic fractions of an agricultural soil, Environ. Sci. Technol, 39, p6575-6583.
[https://doi.org/10.1021/es050523c]

-
George, C. J., G. F. Bennet, D. Simoneaux, and W. J. George, (1988), Polychlorinated biphenyls a toxicological review, J. Hazard. Mater, 18, p113-144.
[https://doi.org/10.1016/0304-3894(88)85018-0]

-
Giesey, J. P., and K. Kannan, (1998), Dioxin-like and non-dioxin-like toxic effects of polychlorinated biphenyls (PCBs): implications for risk assessment, Crit. Rev. Toxicol, 28, p511-569.
[https://doi.org/10.1080/10408449891344263]

-
Grimm, F. A., D. Hu, I. Kania-Korwel, H. J. Lehmler, G. Ludewig, K. C. Hornbuckle, M. W. Duffel, A. Bergman, and L. W. Robertson, (2015), Metabolism and metabolites of polychlorinated biphenyls (PCBs), Crit. Rev. Toxicol, 45, p245-272.
[https://doi.org/10.3109/10408444.2014.999365]

-
Iwata, Y., and F. A. Gunther, (1976), Translocation of the polychlorinated biphenyl Aroclor 1254 from soil into carrots under field conditions, Arch. Environ. Contam. Toxicol, 4, p44-59.
[https://doi.org/10.1007/BF02221014]

- Javorska, H., P. Tlustos, and R. Kaliszova, (2011), Distribution of polychlorinated biphenyl congeners in root vegetables, Pol. J. Environ. Stud, 20, p93-99.
-
Li, H., L. Liu, C. Lin, and S. Wang, (2011), Plant uptake and in-soil degradation of PCB-5 under varying cropping conditions, Chemosphere, 84, p943-949.
[https://doi.org/10.1016/j.chemosphere.2011.06.007]

-
Liu, J., and J. L. Schnoor, (2008), Uptake and translocation of lesser-chlorinated polychlorinated biphenyls (PCBs) in whole hybrid poplar plants after hydroponic exposure, Chemosphere, 73, p1608-1616.
[https://doi.org/10.1016/j.chemosphere.2008.08.009]

-
Low, J. E., A. M. L. Whitfield, A. Rutter, and B. A. Zeeb, (2009), Effect of plant age on PCB accumulation by Cucurbitat pepo ssp, pepo. J. Environ. Qual, 39, p245-250.
[https://doi.org/10.2134/jeq2009.0169]

-
Kim, C. -S., D. -H. Lim, and Y. -S. Keum, (2016), Biodegradation pathways of polychlorinated biphenyls by soil fungus Aspergillus niger, Kor. J. Pestic. Sci, 20, p7-13.
[https://doi.org/10.7585/kjps.2016.20.1.7]

-
Nizzetto, L., C. Pastore, X. Liu, P. Camporini, D. Stroppiana, B. Herbert, M. Boschetti, G. Zhang, P. A. Brivio, K. C. Jones, and A. D. Guardo, (2008), Accumulation parameters and seasonal trends for PCBs in temperate and boreal forest plant species, Environ. Sci. Technol, 42, p5911-5916.
[https://doi.org/10.1021/es800217m]

-
Rezek, J., T. Macek, M. Mackova, and J. Triska, (2007), Plant metabolites of polychlorinated biphenyls in hairy root cultureof black nightshade Solanum nigrum SNC-9O, Chemosphere, 69, p1221-1227.
[https://doi.org/10.1016/j.chemosphere.2007.05.090]

-
Ross, G., (2004), The public health implications of polychlorinated biphenyls (PCBs) in the environment, Ecotoxicol. Environ. Safe, 59, p275-291.
[https://doi.org/10.1016/j.ecoenv.2004.06.003]

- Sabljic, A., and Y. Nakagawa, (2014), Biodegradation and quantitative structure-activity relationship (QSAR), In ChenW.SabljicA.CryerS.A.KookanaR.S.(eds)ACS symposium series vol 1174 Non-first order degradation and time-dependent sorption of organic chemicals in soil, Washington DC, American Chemical Society, p57-84.
-
Seth, R., D. Mackay, and J. Muncke, (1999), Estimating the organic carbon partition coefficient and its variability for hydrophobic chemicals, Environ. Sci. Technol, 33, p2390-2394.
[https://doi.org/10.1021/es980893j]

-
Skoglund, R., K. Stange, and D. L. Swackhamer, (1996), A kinetics model for predicting the accumulation of PCBs in phytoplankton, Environ. Sci. Technol, 30, p2113-2120.
[https://doi.org/10.1021/es950206d]

- US EPA, (1996), roduct properties test guidelines OPPTS 830.7570, Partition coefficient (n-octanol/water) estimation by liquid chromatography.
-
Waliszewski, S. M., O. Carvajal, S. Gomez-Arroyo, O. Amador-Munoz, R. Villalobos-Pietrini, P. M. Hayward-Jones, and R. Valencia-Quintana, (2008), DDT and HCH isomer levels in soils, carrot root and carrot leaf samples, Bull. Environ. Contam Toxicol, 81, p343-347.
[https://doi.org/10.1007/s00128-008-9484-8]

-
Weber, J. B., and E. Mrozek, (1979), Polychlorinated biphenyls: phytotoxicity, absorption and translocation by plants, and inactivation by activated carbon, Bull. Environ. Contam. Toxicol, 23, p412-417.
[https://doi.org/10.1007/BF01769980]

-
Whitfield, A. M. L., B. A. Zeeb, A. Rutter, and K. J. Reimer, (2007), In situ phytoextraction of polychlorinated biphenyl- (PCB)contaminated soil, Sci. Total Environ, 374, p1-12.
[https://doi.org/10.1016/j.scitotenv.2006.11.052]

- Witczak, A., and H. Abdel-Gawad, (2012), Comparison of organochlorine pesticides and polychlorinated biphenyls residues in vegetables, grain and soil from organic and conventional farming in Poland, J. Environ. Sci. Health B, 47, p343-353.
-
Zeeb, B. A., J. S. Amphlett, A. Rutter, and K. J. Reimer, (2006), Potential for phytoremediation of polychlorinated biphenyl- (PCB-)contaminated soil, Int. J. Phytoremediation, 8, p199-221.
[https://doi.org/10.1080/15226510600846749]