
들깨 생산단지 시설재배지 중 잔류성유기염소계 농약류 잔류량 조사
초록
본 연구에서는 들깨 시설재배지 토양 및 작물 중 잔류성유기염소계 농약의 잔류량을 조사하였다. 토양 및 작물 중 잔류성유기염소계 농약 분석을 위한 추출 및 정제는 QuEChERS 방법을 다소 개선한 방법으로 수행되었다. 들깨 시설재배지 토양 및 농산물 중 잔류성유기염소계 농약의 회수율은 각각 76.3-113.4 및 79.4-107.3%, 정량한계는 각각 0.03-0.24와 0.33-0.50 μg/kg 수준이었다. 들깨 시설재배지 토양에서 dieldirn 및 endosulfan sulfate 2 성분만이 각각 1.6-9.2 및 22.0-87.81 μg/kg 수준으로 검출되었으나 들깻잎의 모든 시료에서는 검출되지 않았다. 이러한 결과는 들깨 시설재배지 토양이 농산물 안전성을 위협할 정도로 잔류성유기염소계 농약으로 오염되지 않았음을 나타냈다.
Abstract
This study was conducted to investigate residual organochlorine pesticides in green house soil and green perilla leaves. Extraction and clean-up method were developed using the modified QuEChERS method for residual organochlorine pesticides (ROCPs) in soil and green perilla leaves. Recovery and limit of quantitation (LOQ) of ROCPs in greenhouse soil and green perilla leaves were 76.3-113.4 and 79.4-107.3%, 0.03-0.24 and 0.33-0.50 μg/kg, respectively. Detected ROCPs in greenhouse soil were dieldrin and endosulfan sulfate, the residue were 1.6-9.2 and 22.0-87.8 μg/kg, respectively. But two pesticides in all green perilla leaf samples were not detected. These results showed that ROCPs residue in greenhouse soil was lower than the level of bioaccumulation occurring.
Keywords:
Greenhouse, Green perilla, persistent organic pollutants, residual organochlorine pesticides키워드:
들깨, 시설하우스, 잔류성유기염소계 농약, 잔류성유기오염물질서 론
꿀풀과에 속하는 들깨(Perilla frutescens var. japonica Hara)는 한국, 중국, 일본 등지에서 자라는 한해살이 식물로 인도의 고지와 중국의 중남부 등이 원산지로 알려져 있고, 특이한 향기가 있어 우리나라에서는 잎과 종자에서 짜낸 기름을 식용하고 있다(Chung et al., 2014). 들깻잎은 perillaketone 등 40가지 이상의 정유성분을 함유하고 있고, 식용으로의 생산 재배는 우리나라에서만 이루어지고 있다(Kim et al., 2008). 우리나라에서 고소득 작물 중 하나인 들깨의 시설재배는 경남 밀양과 충남 금산에서 주로 행해지고 있으며, 최근 신선 채소류의 소비량이 증가함에 따라 재배면적이 증가하고 있다(Ju et al., 2013). 또한 통계청은 2014년 들깨 재배면적과 생산량이 37,461 ha와 43,260 ton으로 2013년에 비해 각각 24.3과 29.7% 증가하였음을 보고하고 있다(KOSTAT, 2015).
잔류성유기염소계 농약류(residual organochlorine pesticides, ROCPs)는 잔류성유기오염물질(persistent organic pollutants, POPs) 중 염소를 함유하고 있고 농약으로 사용된 물질이다. 우리나라에서는 aldrin, endrin, dieldrin, toxaphene, chlordane, heptachlor, mirex, hexachloro benzene (HCB), dichloro diphenyl trichloro ethane (DDT), α-hexachloro cyclohexane(HCH), β-HCH, pentachloro benzene (PeCB) 및 endosulfan 13종의 ROCPs 중 chlordane 및 mirex를 제외한 11종이 살충제로 등록되어 사용된 바 있다(Lim et al., 2016). 이들 중 aldrin, dieldrin, endrin, endosulfan 등 몇몇 농약은 제조 및 사용이 금지된 이후에도 국·내외의 환경 및 작물에서 꾸준히 검출됨이 보고되고 있다(Jorgenson, 2001; White, 2001; Hashimoto, 2005; Jurado et al., 2005; Seike et al., 2007; Lim et al., 2016). 또한 토양 중 잔류성유기염소계 농약은 작물에 흡수·이행 되며, 그 정도는 작물과 농약성분에 따라 다르게 나타난다(Waliszewski et al., 2004; Chen et al., 2005; Gonzales et al., 2005; Mikes et al., 2009)
Endosulfan의 사용 및 제조가 금지된 2011년 이후로 우리나라 농업환경 중 잔류성유기염소계 농약류의 노출량에 대한 보고는 딸기 시설재배지 토양과 딸기에서의 잔류량 조사결과(Lim et al., 2016)와 국립농산물품질관리원의 “농산물 등 안전관리 결과”(2013년 605회 검출, 부적합 47회, 2014년 455회 검출, 부적합 27회)를 제외하면 전무한 실정이다. 따라서 본 연구에서는 우리나라 엽채류 시설재배지의 잔류성유기염소계 농약류 오염실태를 파악하기 위하여 들깨 생산단지 시설재배지 중 잔류성유기염소계 농약류의 노출량을 평가하고자 하였다.
재료 및 방법
시약 및 표준품
조사대상 잔류성유기염소계 농약 α-HCH, β-HCH, γ-HCH, δ-HCH, hexachloro benzene, heptachlor, heptachlor epoxide, aldrin, dieldrin, endrin, α-endosulfan, β-endosulfan, endosulfan sulfate, 2,4-DDE, 4,4-DDE, 2,4-DDD, 4,4-DDD, 2,4-DDT 및 4,4-DDT는 Dr. Ehrenstorfer GmbH (Augsburg, Germany)로부터 구입하였고, 시료 전처리를 위한 activated carbon, magnesium sulfate, sodium chloride 및 sodium citrate는 Sigma-Aldrich (Saint Louis, USA), Q-sep® QuEChERS dSPE Tube (150 mg magnesium sulfate, 50 mg primary secondary amine (PSA), 50 mg C18, 2 mL, Pennsylvania, USA)는 Restek, acetone은 J.T. Baker (New Jersey, USA)의 제품을 구입하여 사용하였다.
시료채취 및 조제
들깨 시설재배지 토양 및 들깻잎 시료는 2015년 6월에 우리나라 들깨 주산지인 충청남도 금산군과 경상남도 밀양시에서 각각 15와 27점을 채취하였다. 들깨 시설재배지 토양 및 작물시료는 Lim et al. (2016)의 방법에 따라 채취하였다. 토양은 토양시료채취기를 이용하여 10 cm 깊이로 100-200 g을 시설하우스 내의 10개 지점에서 채취하여 혼화하고, 이를 음건하여 2 mm 체를 통과시킨 후 사용하였다. 들깻잎 시료는 토양시료를 채취한 시설하우스 내 10개 지점에서 각 100-200 g 정도를 채취하고, 이를 믹서기로 분쇄하여 혼화한 다음 사용하였다.
잔류성유기염소계 농약 분석
들깨 시설재배지 토양 중 잔류성유기염소계 농약류 잔류량 조사를 위한 전처리는 QuEChERS 방법을 다소 변형한 방법으로 수행하였다(Lim et al., 2016, Fig. 1). 토양시료 50 g을 칭량하여 삼각플라스크에 넣은 다음 magnesium sulfate 20 g, sodium chloride 5 g 및 sodium citrate 5 g을 첨가하고, 2시간 동안 acetone으로 2회(100+50 mL) 진탕 추출한 다음 여과하였다. 이를 40oC에서 감압 농축하고 4 mL acetonitrile로 재 용해한 다음 1.5 mL를 취하여 QuEChERS dSPE Tube에 넣었다. QuEChERS dSPE Tube를 5분간 진탕한 다음 10분간 원심분리(3000 rpm, Combi 514R, Hanil, Incheon, Korea)하고, syringe filter (0.22 μm)를 이용하여 상등액을 여과한 후 gas chromatography (GC, Agilent Technologies, Santa Clara, USA)-micro electron capture detector (μECD)로 분석하였다(Table 1). 잔류성유기염소계 농약은 POPs (persistent organic pollutants, 잔류성유기오염물질)로 지정되어 제조 및 사용되지 않고 있다. 따라서 들깻잎 중 이들의 잔류량은 들깨 시설재배지 토양을 분석한 후 검출된 농약만을 분석대상으로 하여 다소 변형된 QuEChERS 방법으로 분석하였다(Lim et al., 2016, Fig. 1). 들깻잎 10 g을 칭량하여 삼각플라스크에 넣고, sodium chloride 1 g, sodium citrate 1 g 및 activated carbon 1 g을 첨가하고, 2시간 동안 acetone으로 2회(100+50 mL) 진탕 추출한 다음 여과하였다. 이를 40oC에서 감압 농축하고 4 mL acetonitrile로 재 용해한 다음 1.5 mL를 취하여 QuEChERS dSPE Tube에 넣었다. QuEChERS dSPE Tube를 5분간 진탕한 다음 10분간 원심분리하고, syringe filter (0.22 μm)를 이용하여 상등액을 여과한 후 GC-μECD로 분석하였다(Table 1).

Flow chart for residual organochlorine pesticides in soil (left) and green perilla leaves (right). QuEChERS dSPE: Quick, easy, cheap, effective, rugged, and safe dispersive solid phase extraction, GC-μECD: Gas chromatography-micro electron capture detector.
GC-μECD 분석을 통해 확인된 토양 및 들깻잎 중 잔류성유기염소계 성분에 대해서는 GC-mass spectrometry (MS)(Agilent Technologies, Santa Clara, USA)로 동일성분임을 재확인하였다.
분석법의 유효성
조사대상 α-HCH 등 잔류성유기염소계 농약 19종의 정량분석법 유효성은 검량선의 직선성, 정량한계(limits of quantitation, LOQ), 회수율 및 상대표준편차(relative standard deviation, RSD)를 사용하여 검증하였다. 조사대상 잔류성유기염소계 농약 19종을 각각 100 mL acetone에 용해하여 100 mg/L의 stock solution을 제조하고, 효율적인 분석을 위하여 2개의 그룹(Group I 10종, Group II 9종)으로 stock solution을 희석·혼합하여 1-5000 μg/L의 혼합표준용액을 제조한 후 검량선을 작성하였다. 잔류성유기염소계 농약 19종의 LOQ는 S/N비(signal to noise ratio)가 10이 되는 농도로 정하였다. 토양 회수율 시험은 토양 50 g에 2개의 그룹으로 분류된 분석대상 19종 잔류성유기염소계 농약을 4 및 20 μg/kg 수준으로 처리한 후 토양에 충분히 결합될 수 있도록 24시간(암조건) 동안 방치한 다음 Fig. 1의 방법에 따라 3회 반복하여 수행하였다(Gwon et al., 2014). 들깻잎 회수율 시험은 토양시료에서 검출된 dieldrin 및 endosulfan sulfate만을 대상으로 수행하였고, 들깻잎 10 g에 토양에서 검출된 두 약제를 10 및 20 μg/kg 수준으로 처리한 다음 Fig. 1의 방법에 따라 3회 반복하여 수행하였다. 회수율은 각각의 약제 검량곡선에 대입하여 산출한 농도와 첨가농도의 비로부터 구하였고, 실험실 내 정밀성(intermediate precision)은 5반복 수행한 다음 상대표준편차(relative standard deviation, RSD, %)로 검증하였다.
결과 및 고찰
검량선, 회수율 및 정량한계
조사대상 잔류성유기염소계 농약 19종의 머무름 시간은 그룹 I의 경우 α-HCH 23.6, β-HCH 26.1, γ-HCH 26.9, δ-HCH 30.1, α-endosulfan 46.8, 2,4-DDD 50.5, endrin 52.1, β-endosulfan 53.5, 2,4-DDT 55.3 및 endosulfan sulfate 58.1분, 그룹 II의 경우 hexachloro benzene 23.6, heptachlor 34.5, aldrin 38.2, heptachlor epoxide 43.3, 2,4-DDE 46.5, 4,4-DDE 49.9, dieldrin 51.0, 4,4-DDD 55.2, 및 4,4-DDT 59.5분이었고(Fig. 2), 검량선 직선성은 결정계수(R2)가 ≥0.9993으로 모두 양호한 결과를 나타냈다.
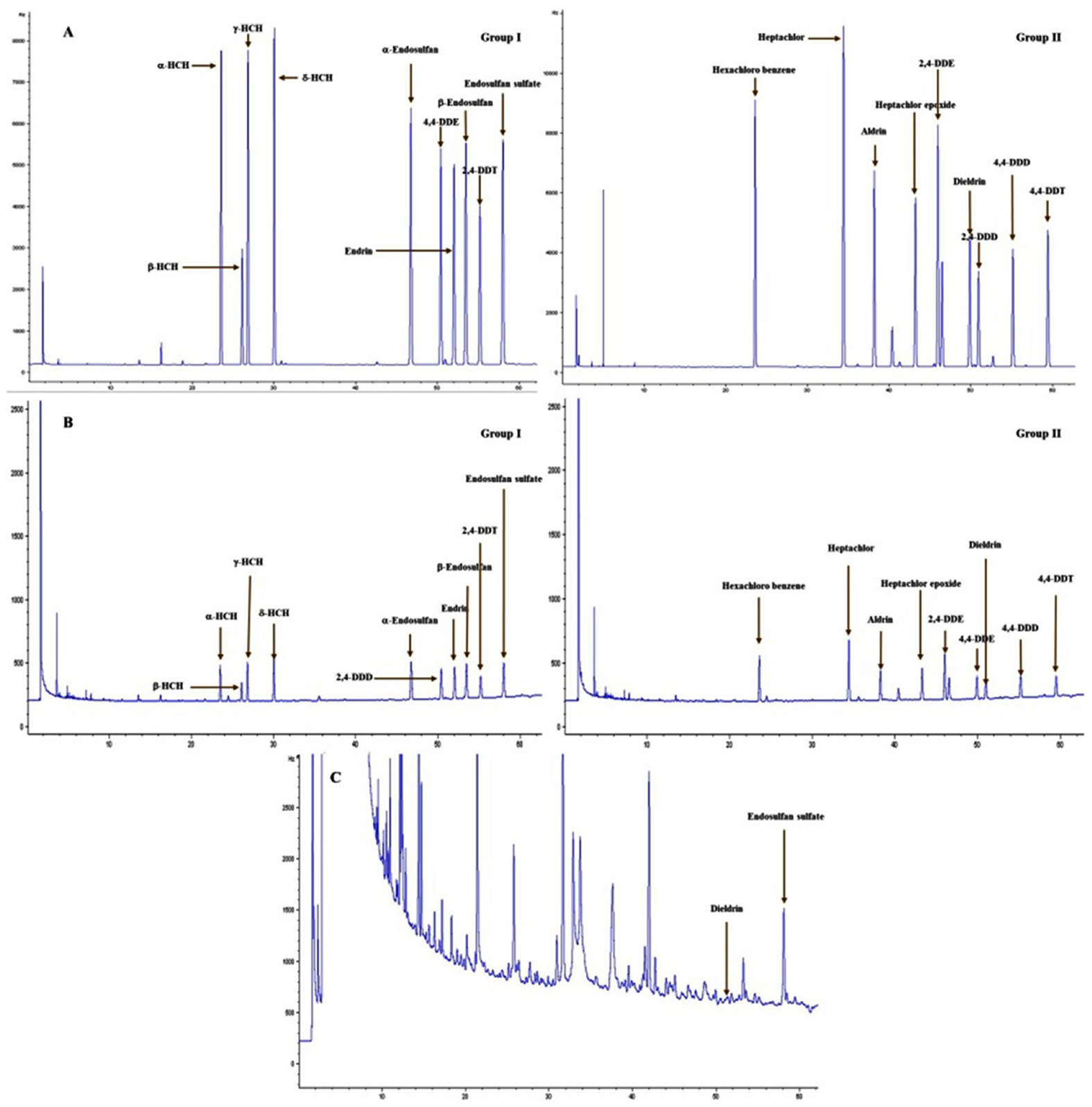
Representative standard (A), recovery (B), and sample chromatogram (C) of residual organochlorine pesticides. DDE: diphenyl dichloro ethylene, DDD: dichloro diphenyl dichloro ethane, DDT: dichloro diphenyl trichloro ethane.
토양에서의 그룹 I과 그룹 II 회수율과 RSD는 각각 90.1-113.4와 76.3-102.6%, 0.9-3.5와 0.9-3.7% 범위이었으며, LOQ는 0.03-0.24 μg/kg 범위로 나타났다(Table 2). 들깻잎에서의 회수율 시험은 토양시료에서 검출된 dieldrin 및 endosulfan sulfate만을 대상으로 수행하였고, 들깻잎에서의 이들의 회수율과 RSD는 각각 79.4-107.3과 80.4-83.2%, 3.3-4.0과 2.8-3.5% 범위이었으며, LOQ는 0.50과 0.33 μg/kg이었다(Table 3). 토양과 들깻잎에서의 회수율 및 RSD의 결과는 회수율 70-120%, RSD 10% 이내의 조건을 충족하였다.
들깨 시설재배지 토양에서의 잔류성유기염소계 농약 잔류수준
들깻잎 주산지 충청남도 금산군과 경상남도 밀양시 지역의 시설재배지 토양(42지점)에서의 잔류수준은 dieldrin과 endosulfan sulfate만이 각각 9개 지점과 5개 지점에서 검출되었고, 검출범위는 각각 1.6-9.2와 22.0-87.8 μg/kg이었다(Table 4). 들깻잎 시설재배지 토양에서 검출된 dieldrin과 endosulfan sulfate 성분에 대해서는 이들의 GC-MS 질량스펙트럼의 대표적 이온분자량(m/z) dieldrin 79, 81, 82, endosulfan sulfate 272, 274, 387을 확인하여 동일성분임을 재확인하였다.
잔류성유기염소계 농약 endosulfan의 사용 및 제조가 금지된 2011년 이후 우리나라 시설재배지 토양 중 잔류성유기염소계 농약의 잔류수준은 제한적으로 보고된 바 있다(Lim et al., 2016). 이 보고에 의하면 딸기 시설재배지에서 본 연구의 들깨 시설재배지 토양에서 검출된 잔류성유기염소계 농약 dieldrin과 endosulfan sulfate 잔류량이 최대 dieldrin 2.3, endosulfan sulfate 118.6 μg/kg 수준으로, 본 연구결과(최대 잔류수준 dieldrin 9.2, endosulfan 87.8 μg/kg)와 현저한 차이가 없었다. 또한 일부 토양시료에서 농약관리법에 의해 비슷한 시기에 사용이 금지된 aldrin (1969년 금지), DDT (1969년 금지), dieldrin (1970년 금지), endrin (1969년 금지), heptachlor (1979년 금지) 등 잔류성유기염소계 농약 중 dieldrin만이 10 μg/kg 미만 수준으로 검출된 것은 토양 중에서 이들의 반감기가 aldrin 365일, DDT 2000일, dieldrin 1000일, endrin 4300일, heptachlor 250일(Augustijn-Beckers et al., 1994)로서 dieldrin이 heptachlor와 aldrin보다 반감기가 더 길고, DDT와 endrin에 비해 반감기는 더 짧지만 환경에 노출된 aldrin은 dieldrin으로 분해(ATSDR, 2002)되므로 사용된 aldrin양 만큼 토양 중 dieldrin의 잔류량이 증가되고, 검출 토양에 상대적으로 aldrin 또는 dieldrin의 사용량이 많았기 때문으로 판단된다.
들깻잎에서의 잔류성유기염소계 농약 잔류수준
식품의약품안전처(Korea Food Additives Code, 2016)는 농산물 중 잔류성유기염소계 농약의 잔류허용기준을 농작물별로 설정하여 관리하고 있다. Aldirin과 dieldrin의 잔류허용기준은 이들의 합으로서 곡류 등에서 10-100, endirn (endrin과 δ-ketoendrin의 합)은 과채류 등에서 10-50, endosulfan(α-endosulfan, β-endosuflan 및 endosulfan sulfate의 합)은 고추 등에서 50-200, heptachlor (heptachlor와 heptachlor epoxide의 합)는 대두 등에서 10-20 μg/kg으로 정하고 있다. 시설재배 들깻잎 중 잔류성유기염소계 농약류의 잔류수준은 들깨 시설재배지 토양에서 dieldrin과 endosulfan sulfate가 각각 최대 9.2와 87.8 μg/kg 수준으로 검출되었음에도 불구하고 이들은 모든 들깻잎 시료에서 검출되지 않아 식품의약품안전처의 잔류허용기준 보다 1/10 이하 수준인 정량한계(0.50과 0.33 μg/kg) 미만이었다(Table 5).
이상의 결과는 우리나라 들깨 시설재배지 토양에서 잔류성유기염소계 농약류 dieldrin 및 endosulfan sulfate 2종이 낮은 농도로 검출되었으나, 들깻잎으로 두 성분이 흡수·이행되지 않는 수준으로 들깻잎 시설재배지 토양이 농산물 안전성을 위협할 정도로 잔류성유기염소계 농약류에 의해 오염되지 않았음을 나타냈다.
Acknowledgments
본 연구는 농촌진흥청 공동연구사업 및 국립농업과학원(PJ010117, PJ010896, PJ010922 및 PJ011435)의 지원에 의해 이루어졌습니다.
References
- ATSDR, (2002), oxicological profile for aldrin/dieldrin, Agency for Toxic Substances and Disease Registry, Atlanta, United State America.
- Augustijn-Beckers, P. W. M., A. G. Hornsby, and R. D. Wauchope, (1994), The SCS/ARS/CES pesticide properties database for environmental decision-making, II. Additional compounds. Rev. Environ. Contam. Toxicol, 137, p1-29.
-
Chen, L., Y. Ran, B. Xing, B. Mai, J. He, X. Wei, J. Fu, and G. Sheng, (2005), Contents and sources of polycyclic aromatic hydrocarbons and organochlorine pesticides in vegetable soils of Guangzhou, China, Chemosphere, 60, p879-890.
[https://doi.org/10.1016/j.chemosphere.2005.01.011]

-
Chung, S. O., J. J. Kim, S. D. Bae, S. A. Jang, and C. G. Park, (2014), Efficacy of acaricides and insecticides to T. Kanzawai and A. egomae. J. Agric, Life Sci, 48, p1-8.
[https://doi.org/10.14397/jals.2014.48.5.1]

-
Gonzalez, M., K. S. B. Miglioranza, J. E. Aizpun de Moreno, and V. J. Moreno, (2005), Evaluation of conventionally and organically produced vegetables for high lipophilic organochlorine pesticide (OCP) residues, Food Chem. Toxicol, 43, p261-269.
[https://doi.org/10.1016/j.fct.2004.10.002]

-
Gwon, J. H., T. K. Kim, E. K. Seo, S. M. Hong, H. Y. Kwon, K. S. Kyung, J. E. Kim, and N. J. Cho, (2014), Multiresidue analysis of 124 pesticides in soils with QuEChERS extraction and LC-MS-MS, Korean J. Pesti. Sci, 18, p296-313.
[https://doi.org/10.7585/kjps.2014.18.4.296]

-
Hashimoto, Y., (2005), Dieldrin residue in the soil and cucumber from agricultural field in Tokyo, J. Pestic. Sci, 30, p397-402.
[https://doi.org/10.1584/jpestics.30.397]

-
Jorgenson, J. L., (2001), Aldrin and dieldrin: A review of research on their production, environmental deposition and fate, bioaccumulation, toxicology, and epidemiology, Environ. Health Perspect, 109, p113-139.
[https://doi.org/10.2307/3434852]

-
Ju, J. I., H. G. Choi, Y. S. Kang, Y. G. Seong, and H. B. Lee, (2013), Optimum sowing date for seed production of latematuring vegetable perilla at green house of middle region, Korean J. Crop Sci, 57, p310-315.
[https://doi.org/10.7740/kjcs.2012.57.3.310]

-
Jurado, E., F. Jaward, R. Lohmann, K. C. Jones, R. Simo, and J. Dachs, (2005), Wet deposition of persistent organic pollutants to the global oceans, Environ. Sci. Technol, 39, p2426-2435.
[https://doi.org/10.1021/es048599g]

- Kim, S. J., E. Y. Kang, S. E. Seo, T. S. Gwak, J. W. Kim, E. H. Kim, S. H. Seo, H. K. Song, J. K. Ahn, C. Y. Yu, and I. M. Chung, (2008), Chemical composition and comparison of essential oil contents of Perilla fructescens Britton var, japonica HARA leaves. Korean J. Medical Crop Sci, 16, p242-254.
- KOSTAT, (2015), 2014 Statistics of Farm product, Korea National Statistical Office, Daejeon, Korea.
-
Lim, S. J., Y. T. Oh, Y. S. Jo, J. H. Ro, G. H. Choi, J. Y. Yang, and B. J. Park, (2016), Persistent organic pollutants (POPs) in greenhouse soil and strawberry – Organochlorine pesticides, Korean J. Envrion. Agric, 35, p6-14.
[https://doi.org/10.5338/KJEA.2016.35.1.05]

-
Mikes, O., P. Cupr, S. Trapp, and J. Klanova, (2009), Uptake of polychlorinated biphenyls and organochlorine pesticides from soil and air into radishes (Raphanus sativus), Environ. Pollut, 157, p488-496.
[https://doi.org/10.1016/j.envpol.2008.09.007]

- Seike, N., H. Eun, and T. Otani, (2007), Temporal change in organochlorine pesticide contamination in Japanese paddy soils, Organohalogen Compod, 69, p28-31.
-
Waliszewski, S. M., O. Carvaja, R. M. Infanzon, P. Trujillo, A. A. Aguirre, and M. Maxwell, (2004), Levels of organochlorine pesticides in soils and rye plant tissues in a field study, J. Agric. Food Chem, 52, p7045-7050.
[https://doi.org/10.1021/jf040250p]

-
White, J. C., (2001), Plant-facilitated mobilization and translocation of weathered 2,2-bis(p-chlorophenyl)-1,1- dichloroethylene(p,p'-DDE) from an agricultural soil, Environ. Toxicol. Chem, 20, p2047-2052.
[https://doi.org/10.1002/etc.5620200925]

