
약초 추출물과 그 분획물의 식물병원균에 대한 항진균 활성
초록
본 연구에서는 식물병원성 진균을 대상으로 농작물의 병해 방제에 활용 가능한 식물성 유기농업자재를 발굴하고자 84종의 약초 추출물 및 그 분획물의 항진균 활성을 평가하고, 보고된 항균물질을 조사하였다. 주정 조추출물의 항진균 활성은 R. solani, P. capsici, S. sclerotiomm, F. oxysporum 및 C. acutatum 대상으로 500 mg L−1 농도에서 paper-disc diffusion 방법으로 확인한 결과, 세 종류 이상의 병원성 진균에서 항진균 활성을 나타낸 주정 추출물은 석창포, 청호, 건삼, 지황, 진피, 길경, 창이자, 상엽, 솔잎, 건강, 백출 등 11종이었다. 11종의 약초 주정 추출물의 극성별 분획물에 대한 항진균 활성을 확인한 결과, 500 mg L−1 농도에서 석창포, 건삼, 지황, 진피, 건강 및 백출의 유기용매 분획물과 청호, 길경, 창이자 및 솔잎의 물 분획물이 보다 강한 항진균 활성을 나타냈다.
Abstract
This study was to discover the plant organic agricultural materials that can be used for disease control crops targeting phytopathogenic fungi. The antifungal activities of the ethanol extracts of 84 medicinal herbs and their fractions were screened and the antimicrobial active compounds in the extract were surveyed. The antifungal activities of the extracts were tested with the paper-disc diffusion method against R. solani, P. capsici, S. sclerotiomm, F. oxysporum and C. acutatum at 500mg L−1. The ethanol extracts of Acorus gramineus, Artemisia annua, Panax ginseng, Rehmannia glutinosa, Citrus unshiu, Platycodon grandiflorum, Xanthium strumarium, Morus alba, Pinus densiflora, Zingiber officinale and Atractylodes japonica inhibited over the three target fungi including R. solani, and S. sclerotiorum among them. The 11 bioactive ethanol extracts were separated with hexane, ethyl acetate and water layers by liquid-liquid partition. The organic solvent fractions of A. gramineus, P. ginseng, R. glutinosa, C. unshiu, Z. officinale and A. japonica and the aqueous fractions of A. anmua, P. grandiflorum, X. strumarium and P. densiflora showed more potent antifungal activity than the other fraction as well as the increment of the activity at the concentration of 500 mg L−1.
Keywords:
Antifungal activity, Medicinal herbs, Extracts, Plant pathogenic fungi키워드:
항진균 활성, 약초, 추출물, 식물병원균서 론
최근 안전한 먹거리에 대한 관심이 늘어남에 따라 소비자의 친환경 농산물에 대한 수요 증가로 유기농산물 재배 면적이 증가하고 있으며, 유기 농산물의 안정적 생산을 위한 병해충 관리와 토양 개량, 그리고 작물 생육을 돕는 유기농업자재의 수요 또한 증가하고 있다(MAFRA, 2021). 특히 병해충 관리용 유기농업자재로 인증 받기 위해서는 친환경 농어업육성법에서 정한 원료물질만을 사용해야 하며, 이러한 유기농업자재의 원료로는 농업부산물, 미생물, 광물질, 식물성 오일, 식물 추출물 등이 주 원료로 사용될 수 있다(Lee et al., 2018). 이들 중 식물추출물은 병해충 방제와 토양 개량 및 작물 생육의 용도로 이용되고 있으며, 이는 화학농약을 대체할 수 있는 적절한 대안이 될 수 있다(Kim et al., 2015). 최근 연구사례를 통해 일부 식물 추출물은 다수의 식물병원균에 대한 방제 효능과 화학 농약에 근접한 방제력을 지니고 있어(Schilder et al., 2002; Schmitt et al., 2002), 화학 농약과의 혼용 혹은 교호 사용을 통해 화학 농약 사용량을 줄일 수 있으며(Bardin et al., 2008), 약제 내성을 지닌 병해충에도 효과적인 방제 원료로 사용될 수 있다(Jacometti et al., 2010). 현재 국립농산물품질관리원에 등록된 유기농업자재는 1906종(2021년 9월 기준)이며, 병해충방제용으로 등록된 자재 650종 중 병해 방제효과를 인증 받은 29종 중 식물추출물이 함유된 유기농업자재는 9종에 불과하다(NAQS, 2021).
작물에 발생하는 병은 바이러스, 세균, 진균에 의해서 유발되며, 이들 중 진균은 농업의 심각한 손실을 유발하고 있다(Kang et al., 2012). 특히, Rhizoctonia 속 병원균은 거의 모든 작물에 피해를 입히고 기주의 감염부위나 환경조건에 따라 잘록병, 밑둥썩음병, 뿌리썩음병, 줄기썩음병, 잎집무늬마름병 등으로 나타난다(Choi and Choi, 2018). Sclerotinia 속 병원균은 균핵병을 일으키며 흰곰팡이병, 줄기썩음병, 꽃썩음병 등으로 나타난다. 그 중 Sclerotinia sclerotiorum 은고랭지, 십자화과, 시설 재배지에서 주로 발병된다고 보고되어 있다(Kwon and Choi, 2015). Fusarium 속 병원균은 대표적으로 시들음병을 일으키고 덩굴쪼김병, 밑썩음병 등으로 나타난다(Choi et al., 2020). Phytophthora 속은 다양한 작물에서 역병을 일으키고 Colletotrichum 속 병원균은 탄저병을 발병하는데, 특히 고추에서 Phytophthora capsici, Colletotrichum acutatum이 가장 심각한 피해를 주는 것으로 보고되어 있다(Park et al., 2012). 따라서, 매년 반복적으로 발생하는 이들 병원균의 방제에는 많은 화학 농약이 처리되고 있으며, 이는 장기적으로 토양과 작물 잔류 문제, 환경오염, 생태계 파괴, 약제 내성유도 등의 많은 문제를 야기할 수 있어 화학농약 사용을 줄이기 위한 병해관리용 대체 소재 개발이 반드시 필요하다.
본 연구에서는 84종의 약초를 이용하여 이러한 식물병원균을 대상으로 농작물의 병해 방제에 활용 가능한 식물성 유기농업자재를 발굴하고자 하였으며, 이 중에서 5종 식물병원성 진균에 대한 식물추출물의 포자 발아 억제활성을 검토 후 식물병해의 방제용 재료로 가능한 약초를 선발하여 유기농업자재로의 가능성을 확인하고자 하였다.
재료 및 방법
약초 추출물
실험에 사용한 약초 84종(Table 1)은 산청생약협동조합(산청, 한국)에서 건조된 상태로 밀봉된 것을 구입하여 추출물 제조에 사용하였다. 추출방법은 건조 약초 1 kg을 94.5% ethanol (EtOH, Extra pure grade, Daejung chemicals & metals Co. Ltd., Siheung, Korea)에 20일간 실온에서 침지하여 추출하였고, 여과지(Whatman No.2, 8 μm)에 거른 액을 감압농축하여 항균 효과 시험에 사용할 시료로 준비하였다. 농축된 추출물 시료는 dimethylsulfoxide (DMSO, Sigma-Aldrich Co. Ltd., St. Loius, MO, USA)에 5000mg L−1 농도로 조제하여 각 균주별 항진균 활성 측정을 위한 stock solution으로 사용하였다.
시험균주
Colletotrichum acutatum, Fusarium oxysporum, Phytophthora capsici, Rhizoctonia solani, Sclerotinia sclerotiorum 등 5개 균주는 국립농업과학원 보관 균주를 사용하였다.
항진균활성 스크리닝
지름 0.8mm의 멸균된 paper disc (antibiotic assay type, Advantec Co., Japan)에 시료 500mg L−1의 시료 추출액 30 μL를 처리하여 항진균활성 시험용 시료로 준비하였다. Potato dextrose agar (PDA, Difco Co., Detroit, MI, USA) 배지에서 생육한 각각의 시험대상 균사체를 직경 0.5mm의 크기로 배지와 함께 절취한 후 신규 PDA배지 중앙에 위치시키고, 시료용액이 든 paper disc를 plate에 올린 후 28oC에서 3~5일간 배양하며 paper disc 주변의 균사 성장 억제 지역 형성의 유무를 관찰하였다. 모든 실험은 3회 반복 실시하였다.
활성 한약재 추출물 분획
주정을 사용한 조추출물에서 시험 균주 3종 이상의 항균활성을 나타낸 한약재는 Fig. 1과 같은 방법으로 액-액 분배하였다. 200 mL 물에 현탁된 주정추출물은 비극성 용매인 n-hexane (HPLC grade, Duksan Co., Ansan, Korea) 200 mL을 넣어 강하게 진탕 후 추출하고, 수용액 층은 ethyl acetate (EtOAc, HPLC grade, Duksan Co., Ansan, Korea) 200 mL을 이용하여 순차적으로 3회 반복 추출하였다. 추출액은 40oC에서 rotary vaccum evaporator (N1000, EYELA, Tokyo, Japan)로 농축하여 용매를 완전히 제거하였다. 유기용매 분획물 시료는 DMSO에 500 mg L−1 농도로 조제하였고, 수용액 층은 증류수를 사용하여 각각 조제한 후 각 균주별 항진균 활성 측정에 사용하였다.
결과 및 고찰
약초 84종에 대한 주정 추출물의 항진균력은 식물병원성 진균인 C. acutatum, F. oxysporum, P. capsici, R. solani와 S. sclerotiorum을 대상으로 500mg L−1 농도로 제조된 추출물을 paper disc agar diffusion법에 따라 30 μL 처리 후 clear zone을 확인하였다. 시험에 사용한 진균 중 한 종류 이상에서 포자 성장 억제 활성을 나타낸 것은 복분자 열매 추출물 등 68종의 약초에서 나타났으며, 특히 세 종류 이상에서 항진균 활성을 나타낸 추출물은 석창포, 청호, 건삼, 지황, 진피, 길경, 창이자, 상엽, 솔잎, 건강, 백출 등 11종이었다. 이 중 창이자 열매는 4종의 식물 병원성 진균에서 항균활성을 나타내었다(Table 2). 본 실험에서 3종 이상의 균에서 항진균 활성이 확인된 석창포 등 11종의 약초 추출물은 극성이 서로 다른 hexane (Kow = 3.90, polarity index = 0.1), ethyl acetate (Kow = 0.73, polarity index = 4.4)와 water (Kow=-1.38, polarity index = 10.2) 등 세 가지 용매로 순차 분획 후 농축하여 500mg L−1에서 항진균 활성 증가 여부를 시험하여, 항진균 활성물질의 정제와 농축가능성을 평가하였다(Table 3). 일반적으로 극성 화합물은 극성, 비극성 화합물은 비극성용매에 대한 용해도가 높으므로 보고된 항균 활성 화합물의 log P와 분획 추출 용매의 극성을 통해 근사적 용해도를 추정하여 어떤 화합물이 활성에 관여했는지 비교할 수 있다.
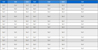
Antifungal activities by different solvent extracts of medicinal herbs against phytopathogenic fungi
석창포 조추출물의 hexane과 EtOAc 정제추출물은 S. sclerotiorum에 대해 강력한 항진균 활성을 나타났으며, 이는 석창포의 주요 항균성분으로 알려진 allyl isothiocyanate와 asarone의 지용성과 잘 일치하는 것으로 보아 이들 성분에 의한 항진균 활성일 가능성이 높은 것으로 판단된다(Table 4) (Lee et al. 2004; Jimenez et al., 2010; Nazarth et al., 2019). 또한, 석창포의 수용액 정제추출물은 R. solani에서 균 생장 억제 활성이 확인되었으나, 수용성 항균 물질에 대해서는 현재 보고된 것이 없어 더 많은 추가 연구가 필요하였다. 청호 조추출물의 수용액 정제추출물은 R. solani에 대해 보다 높은 항진균 활성이 나타났고, hexane 정제추출물의 경우 R. solani와 S. sclerotiorum, C. acutatum에서도 항진균 활성이 확인되었다. 청호에서 확인된 항균성 물질은 artemisinin 등 지용성 terpene계 물질과 stigmastrol 등 steroid계 물질이 알려져 있다(Dhingra et al., 2000; Marques et al. 2007; Efferth et al. 2008; El-fiky et al., 2008; Morcia et al., 2012). 건삼 추출물의 용매 분획물 중 수용액 정제 추출물은 시험대상 균주에 대한 항진균 활성이 확인되지 않았으나, hexane 정제 추출물에서 R. solani에 대한 우수한 항진균 활성이 확인되었고, 이는 건삼에서 알려진 지용성 항균물질인 falcarinol 등 fatty alcohol계 물질과 protopanaxadiol 등 비배당체 saponin계 물질이 항진균 활성에 기여하였을 것으로 추측된다(Battinelli et al., 1998; Merad et al., 2021). 지황의 경우 hexane 정제추출물은 R. solani와 P. capsic에 대한 항진균 활성이 높게 나타났으며, EtOAc 정제추출물은 C. acutatum에 대한 활성이 높게 나타났다. 지황에서 보고된 항균물질 중 hexane 용해성 물질로는 steroid계 ergosterol peroxide가 알려져 있으며, EtOAc 용해성 물질로는 polyphenol성 물질인 2,6-Dihydroxy-2-methyl-7-(prop-1E-enyl)-1-benzofuran-3(2H)-one이 보고된 바 있다(You et al., 2009; You et al., 2019). 진피에서는 hexane과 EtOAc 정제추출물이 R. solani에 대해 높은 항진균 활성을 나타내었으나, 모든 용매 정제물에서 P. capsici와 C. acutatum에 대한 항진균 활성이 확인되지 않았다. 진피의 조추출물은 P. capsici에 대한 항진균 활성이 있었으나, 정제추출물에서 항진균 활성이 사라진 것을 확인하였고, 이는 정제물 제조과정 중 휘발성 물질의 과도한 손실 혹은 물질의 구조적 불안정성에 기인한 것으로 추정된다. 진피에서 알려진 항균활성 물질 중 지용성인 물질로는 2-phenethyl alcohol이 알려져 있으며, 진피 essential oil의 항균 활성도 보고된 바 있다(Jo et al., 2004, Liu et al., 2014). 길경의 hexane 정제추출물과 수용액 정제추출물은 S. sclerotiorum에 대해 높은 항진균 활성이 나타났으며, 이는 polygalacic acid와 같이 지용성이면서 pH에 따라 수용성을 나타낼 수 있는 항균물질의 특성이 반영되었을 가능성도 있다(Bader et al., 2000). 하지만, 길경에 대한 다양한 항균 활성 물질 연구자료가 부족하여 항균 활성 물질에 대한 규명 연구가 보완되어야 할 것이다. 창이자의 조추출물을 사용하여 제조한 모든 정제추출물이 R. solani에 대해 항진균 활성을 나타내었으며, 특히 수용액 정제추출물은 매우 강한 항진균 활성을 보였다. 하지만, EtOAc 정제추출물이 S. sclerotiorum에 대한 항진균 활성을 보인 것을 제외하면, 모든 정제추출물이 P. capsici, F. oxysporium, C. acutatum에 대해 항진균활성이 나타나지 않았다. 창이자에서 알려진 항균물질은 대부분 지용성인 terpene계 물질로 보고되었으나, 수용액 정제추출물에서 높은 항진균활성이 확인되는 것으로 보아, 수용성 항진균 물질 탐색에 관한 연구가 보완될 필요가 있었다(Lavault et al., 2005; Pinel et al., 2007). 상엽의 경우 세 가지 용매 정제물 중 S. sclerotiorum, C. acutatum 제외한 다른 세 가지 균에 대해서 항진균 활성이 확인되었으나, 분획 정제로 인한 항진균 활성증가는 확인되지 않았고, 상엽의 주요 항균 물질로는 Albanol B 등 polyphenol성 물질이 보고된 바 있다(Sohn et al., 2004; Fukai et al., 2005; Aslam et al., 2009; Abirami et al., 2020). 솔잎 또한, 수용액 정제물에서 항진균 활성 증가가 S. sclerotiorum에서 확인되었으며, 알려진 항균성 물질은 대부분 pinene 등 terpene계 지용성 물질이 보고된 바 있으며, 수용성을 일부 가지는 cinnamic acid도 알려져 있다(Hong et al., 2004; Sultan et al., 2008; Korošec et al., 2014; Moghaddam et al., 2015; Iraji et al., 2020). 건강 조추출물의 정제추출물 중 hexane 정제추출물은 주정 추출물에 비해 S. sclerotiorum에 대한 항진균 활성이 크게 증가하였으며, 6-dehydrogingerdione 등 polyphenol계 물질과 6-gingerol 등 phenol계 물질이 주요 지용성 항균 물질로 알려져 있다(Endo et al., 1990; Ficker et al., 2003; Lee et al., 2018). 백출의 유기용매 분획물 2종은 P. capsici에 대한 활성 증가가 확인되었고, 항균활성 물질에 대한 연구는 많이 부족하지만, essential oil의 항균활성에 대한 연구는 일부 알려진 바 있다(Ren et al., 2012).
선발된 추출물 11종 중 지황은 다른 약초보다 실험에 이용한 5종의 모든 식물병원성 진균에 대해 항진균능을 가지고 있음을 확인하였다. 지황은 뿌리를 이용하는 약용작물로서 지표성분인 catalpol 및 aucubin은 iridoid 배당체로 항염증, 항균, 항산화 등의 약리활성을 발휘한다고 알려져 있다(Reina et al., 2013; Wang et al., 2016; Zhao et al., 2016). 그리고 catalpol은 식물병원균 Cladosporium cucumerinum에 10 – 25 μg mL-1 의 최소억제농도를 보이며, 주요 이용 부위인 뿌리보다 지상부에 이들 성분의 함량이 약 1.5 – 5배 높다고 보고되어 있다(Dellar et al., 1996; Lee et al., 2017). 가을 수확하는 지황의 경우 뿌리의 약 80%가 지상부이며 이는 전량 폐기된다. 지황의 뿌리는 유기농업자재 소재로는 단가가 비교적 높기 때문에 지상부를 활용한 항진균 연구를 보완한다면 주요 이용 부위를 제외한 부산물을 식물 병해 방제용 재료로 활용함으로써 이용가치를 증대할 수 있을 것으로 판단된다.
84종의 약초의 추출물로부터 5종의 식물병원성 진균에 대한 주정 추출물의 포자 발아 억제 활성을 검토하여 식물 병해 방제용 재료로 활용 가능한 약초 추출물 11종을 선발하였으며, 이들은 병해관리용 유기농업자재의 원료로서 충분한 기능성이 있음을 확인하였다. 비록 이들 추출물이 갖는 항진균 활성 유효성분에 관한 연구는 부족하지만, 추후 항진균성 효능 물질 규명 및 유효물질의 정량적 연구, 부산물 활용 연구가 보완된다면 이들 추출물은 새로운 유기농업자재 소재로 활용될 수 있을 것이다.
Acknowledgments
This study was supported by the “Research Program for Agricultural Science & Technology Development (Project No. PJ01571605)”, National Institute of Agricultural Sciences, Rural Development Administration, Republic of Korea.
References
-
Abirami G, Alexpandi R, Durgadevi R, Kannappan A, Veera Ravi A, 2020. Inhibitory effect of morin against Candida albicans pathogenicity and virulence factor production: an in vitro and in vivo approaches. Front Microbiol. 11: 561298.
[https://doi.org/10.3389/fmicb.2020.561298]

-
Aghazadeh M, Zahedi Bialvaei A, Aghazadeh M, Kabiri F, Saliani N, et al., 2016. Survey of the antibiofilm and antimicrobial effects of Zingiber officinale (in vitro study). Jundishapur J. Microbiol. 9(2):e30167.
[https://doi.org/10.5812/jjm.30167]

-
Ahn JY, Song JY, Yun YS, Jeong G, Choi IS, 2006. Protection of Staphylococcus aureus-infected septic mice by suppression of early acute inflammation and enhanced antimicrobial activity by ginsan. FEMS Immunol. Med. Microbiol. 46(2):187-197.
[https://doi.org/10.1111/j.1574-695X.2005.00021.x]

-
Aslam SN, Stevenson PC, Kokubun T, Hall DR, 2009. Antibacterial and antifungal activity of cicerfuran and related 2-arylbenzofurans and stilbenes. Microbiol. Res. 164(2):191-195.
[https://doi.org/10.1016/j.micres.2006.11.012]

- Bader G, Seibold M, Tintelnot K, Hiller K, 2000. Cytotoxicity of triterpenoid saponins. Part 2: Relationships between the structures of glycosides of polygalacic acid and their activities against pathogenic Candida species. Pharmazie. 55(1):72-74.
-
Bardin M, Fargues J, Nicot PC, 2008. Compatibility between biopesticides used to control grey mould, powdery mildew and whitefly on tomato. Biol. Control 46(3):476-483.
[https://doi.org/10.1016/j.biocontrol.2008.05.012]

- Battinelli L, Mascellino MT, Martino MC, Lu M, Mazzanti G, 1998. Antimicrobial activity of ginsenosides. Pharm. Pharmacol. Commun. 4:411-413.
-
Choi JS, Choi YH, 2018. Antifungal activity substance from Psoralea corylifolia seeds against Rhizoctonia solani AG-4. Korean J. Pestic. Sci. 22(4):356-362. (In Korean)
[https://doi.org/10.7585/kjps.2018.22.4.356]

- Choi JS, Lee DW, Choi YH, 2020, Isolation of antifungal activity substance from Rheum australe D. Don roots against Fusarium oxysprum f. sp. Lycopersici (Saccardo) Snyder & Hansen. Korean J. Org. Agric. 28(1):95-108. (In Korean)
-
Dellar JE, Conn BJ, Cole MD, Waterman, PG, 1996. Cinnamate esters of catalpol from Westringia fruticosa and Westringia viminalis. Biochem. Syst. Ecol. 24(1):65-69.
[https://doi.org/10.1016/0305-1978(95)00091-7]

- Dhingra V, Pakki SR, Narasu ML, 2000. Antimicrobial activity of artemininin and its precursors. Curr. Sci. 78(6):709-713.
-
Efferth T, Romero MR, Wolf DG, Stamminger T, Marin JJG, et al., 2008. The antiviral activities of artemisinin and artesunate. Clin. Infect. Dis. 47(6):804-811.
[https://doi.org/10.1086/591195]

-
El-Fiky F, Asres K, Gibbons S, Hammoda H, Badr J, et al., 2008. Phytochemical and antimicrobial investigation of latex from Euphorbia abyssinica Gmel. Nat. Prod. Commun. 3(9):1505-1508.
[https://doi.org/10.1177/1934578X0800300922]

-
Endo K, Kanno E, Oshima Y, 1990. Structures of antifungal diarylheptenones, gingerenones A, B, C and isogingerenone B, isolated from the rhizomes of Zingiber officinale. Phytochemistry. 29(3):797-799.
[https://doi.org/10.1016/0031-9422(90)80021-8]

-
Ferreira FMD, Hirooka EY, Ferreira FD, Silva MV, Mossini SAG, et al., 2018. Effect of Zingiber officinale Roscoe essential oil in fungus control and deoxynivalenol production of Fusarium graminearum Schwabe in vitro. Food Addit. Contam. Part A. 35(11):2168-2174.
[https://doi.org/10.1080/19440049.2018.1520397]

-
Ficker C, Smith ML, Akpagana K, Gbeassor M, Zhang J, et al., 2003. Bioassay-guided isolation and identification of antifungal compounds from ginger. Phytother. Res. 17(8):897-902.
[https://doi.org/10.1002/ptr.1335]

-
Fukai T, Kaitou K, Terada S, 2005. Antimicrobial activity of 2-arylbenzofurans from Morus species against methicillin-resistant Staphylococcus aureus. Fitoterapia. 76(7-8):708-711.
[https://doi.org/10.1016/j.fitote.2005.06.012]

-
Hong EJ, Na KJ, Choi IG, Choi KC, Jeung EB, 2004. Antibacterial and antifungal effects of essential oils from coniferous trees. Biol. Pharm. Bull. 27(6):863-866.
[https://doi.org/10.1248/bpb.27.863]

-
Hongxia L, Shaohua L, Fazheng R, Liping W, Lishui C, et al., Antioxidant and antimicrobial capacity of chinese medicinal herb extracts in raw sheep meat. J. Food Prot. 70(6):1440-1445.
[https://doi.org/10.4315/0362-028X-70.6.1440]

-
Inagaki N, Komatsu Y, Sasaki H, Kiyohara H, Yamada H, et al., 2001. Acidic polysaccharides from rhizomes of Atractylodes lancea as protective principle in Candida-lnfected mice. Planta Med. 67(5):428-431.
[https://doi.org/10.1055/s-2001-15822]

-
Iraji A, Yazdanpanah S, Alizadeh F, Mirzamohammadi S, Ghasemi Y, et al., 2020. Screening the antifungal activities of monoterpenes and their isomers against Candida species. J. Appl. Microbiol. 129(6):1541-1551.
[https://doi.org/10.1111/jam.14740]

-
Jacometti MA, Wratten SD, Walter M, 2010. Alternatives to synthetic fungicides for Botrytis cinerea management in vineyards. Aust. J. Grape Wine Res. 16(1):154-172.
[https://doi.org/10.1111/j.1755-0238.2009.0067.x]

-
Jiménez F, Cruz M, Zúñiga C, Martínez M, Chamorro G, et al., 2010. Aryloxyacetic esters structurally related to α-asarone as potential antifungal agents. Med. Chem. Res. 19:33-57.
[https://doi.org/10.1007/s00044-009-9170-3]

- Jo C, Park BJ, Chung SH, Kim CB, Cha BS, et al., 2004. Antibacterial and anti-fungal activity of Citrus (Citrus unshiu) essential oil extracted from peel by-products. Food Sci. Biotechnol. 13(3):384-386.
-
Kang DW, Ryu IH, Han SS, 2012. The isolation of Bacillus subtilis KYS-10 with antifungal activity against plant pathogens. Korean J. Pestic. Sci. 16(2):178-186. (In Korean)
[https://doi.org/10.7585/kjps.2012.16.2.178]

-
Kim JH, Choi GH, Kang JE, Park BJ, 2015. Stability of representative active compounds on commercial biopesticides based on neem or Sophora flavescens extract under controlled temperature. Korean J. Pestic. Sci. 19(2):88-92. (In Korean)
[https://doi.org/10.7585/kjps.2015.19.2.88]

-
Korošec B, Sova M, Turk S, Kraševec N, Novak M, et al., 2014. Antifungal activity of cinnamic acid derivatives involves inhibition of benzoate 4-hydroxylase (CYP53). J. Appl. Microbiol. 116(4):955-966.
[https://doi.org/10.1111/jam.12417]

- Kwon OC, Ju WT, Kim HB, Kim YS, 2019. Antifungal activities of extracts from different parts of mulberry plant against Alternaria alternata and Fusarium sp. Int. J. Indust. Entomol. 38(1):6-13.
-
Kwon Y, Choi YH, 2015. Isolation of antimicrobial active substance from Usena longissimi against Sclerotial Rot (Sclerotinia sclerotiorum). Korean J. Org. Agric. 23(4):887-896. (In Korean)
[https://doi.org/10.11625/KJOA.2015.23.4.887]

-
Lam SK, Ng TB, 2002. Pananotin, a potent antifungal protein from roots of the traditional chinese medicinal herb Panax notoginseng. Planta Med. 68(11):1024-1028.
[https://doi.org/10.1055/s-2002-35649]

-
Lavault M, Landreau A, Larcher G, Bouchara JP, Pagniez F, et al., 2005. Antileishmanial and antifungal activities of xanthanolides isolated from Xanthium macrocarpum. Fitoterapia. 76(3-4):363-366.
[https://doi.org/10.1016/j.fitote.2005.03.019]

-
Lee DG, Lee SJ, Rodriguez JP, Kim IH, Chang T, et al., 2017. Antifungal activity of pinosylvin from Pinus densiflora on turfgrass fungal diseases. J. Appl. Biol.Chem. 60(3):213-218.
[https://doi.org/10.3839/jabc.2017.034]

-
Lee HS, 2007. Fungicidal property of active component derived from Acorus gramineus rhizome against phytopathogenic fungi. Bioresour. Technol. 98(6):1324-1328.
[https://doi.org/10.1016/j.biortech.2006.05.018]

-
Lee JB, Jo Y, You AS, Oh JA, Park S, et al., 2018, Toxicity and safety evaluation of organic agricultural materials allowed in Korea. Korean J. Pestic. Sci. 22(3):184-191. (In Korean)
[https://doi.org/10.7585/kjps.2018.22.3.184]

-
Lee JH, Kim YG, Choi P, Ham J, Park JG, et al., 2018. Antibiofilm and antivirulence activities of 6-gingerol and 6-shogaol against Candida albicans due to hyphal inhibition. Front. Cell. Infect. Microbiol. 8:299.
[https://doi.org/10.3389/fcimb.2018.00299]

-
Lee JH, Lee BK, Kim JH, Lee SH, Hong SK, 2009. Comparison of chemical compositions and antimicrobial activities of essential oils from three conifer trees; Pinus densiflora, Cryptomeria japonica, and Chamaecyparis obtuse. J. Microbiol. Biotechnol. 19(4):391-396.
[https://doi.org/10.4014/jmb.0803.191]

-
Lee JY, Lee JY, Yun BS, Hwang BK, 2004. Antifungal activity of beta-asarone from rhizomes of Acorus gramineus. J. Agric. Food Chem. 52(4):776-780.
[https://doi.org/10.1021/jf035204o]

-
Lee SH, Yoon JS, Kim JK, Park CG, Kim SC, et al., 2017. Aucubin, catalpol, and GABA contents in different plant parts of Rehmannia glutinosa cultivars. Korean J. Medicinal Crop Sci. 25(1):16-21. (In Korean)
[https://doi.org/10.7783/KJMCS.2017.25.1.16]

- Lim JK, Kang HJ, Kang SN, Lee BY, 2009. Antioxidant and antimicrobial activities of various solvent fractions of fine ginseng root. Food Sci. Biotechnol. 18(2):513-518.
-
Liu P, Cheng Y, Yang M, Liu Y, Chen K , et al., 2014. Mechanisms of action for 2-phenylethanol isolated from Kloeckera apiculata in control of Penicillium molds of citrus fruits. BMC Microbiol. 14:242.
[https://doi.org/10.1186/s12866-014-0242-2]

-
Ma YN, Chen CJ, Li QQ, Xu FR, Cheng YX, et al., 2019. Monitoring antifungal agents of Artemisia annua against Fusarium oxysporum and Fusarium solani, associated with Panax notoginseng root-rot disease. Molecules. 24(1):213.
[https://doi.org/10.3390/molecules24010213]

-
Marques JV, Kitamura ROS, Lago JHG, Young MCM, Guimarães EF, et al., 2007. Antifungal amides from Piper scutifolium and Piper hoffmanseggianum. J. Nat. Prod. 70(12):2036-2039.
[https://doi.org/10.1021/np070347g]

-
Merad N, Andreu V, Chaib S, de Carvalho Augusto R, Duval D, et al., 2021. Essential oils from two Apiaceae species as potential agents in organic crops protection. Antibiotics. 10(6):636.
[https://doi.org/10.3390/antibiotics10060636]

- Ministry of Agriculture Food and Rural Affair (MAFRA), 2021. Statistics for agriculture, livestock and food 2021. Sejong, Republic of Korea. (In Korean)
-
Moghaddam M, Taheri P, Pirbalouti AG, Mehdizadeh L, 2015. Chemical composition and antifungal activity of essential oil from the seed of Echinophora platyloba DC. against phytopathogens fungi by two different screening methods. LWT-Food Sci. Technol. 61(2):536-542.
[https://doi.org/10.1016/j.lwt.2014.12.008]

-
Morcia C, Malnati M, Terzi V, 2012. In vitro antifungal activity of terpinen-4-ol, eugenol, carvone, 1,8-cineole (eucalyptol) and thymol against mycotoxigenic plant pathogens. Food Addit. Contam. 29(3):415-422.
[https://doi.org/10.1080/19440049.2011.643458]

- National Agricultural Products Quality Management Service (NAQS), 2021. Public announcement organic agricultural materials inquiry. https://www.naqs.go.kr/contents/contentsTab.do/ (Accessed Sep. 24. 2021).
-
Nazareth TM, Quiles JM, Torrijos R, Luciano F, Manes J, Meca G, 2019. Antifungal and antimycotoxigenic activity of allyl isothiocyanate on barley under different storage conditions. LWT. 112:108237.
[https://doi.org/10.1016/j.lwt.2019.06.004]

-
Ng TB, Wang HX, 2001. Panaxagin, a new protein from Chinese ginseng possesses anti-fungal, anti-viral, translation-inhibiting and ribonuclease activities. Life Sci. 68(7):739-749.
[https://doi.org/10.1016/S0024-3205(00)00970-X]

-
Osman NA, Alsiddeeg SE, Ahmed NE, Ali Elhussein SA, 2014. In vitro antifungal activities of extracts of fruits and other morphological parts of Xanthium strumarium against the plant pathogen, Rhizoctonia solani. Pak, J. Sci. Ind. Res. B: Biol. Sci. 57(1), 11-17.
[https://doi.org/10.52763/PJSIR.BIOL.SCI.57.1.2014.11.17]

-
Park M, Bae J, Lee DS, 2008. Antibacterial activity of [10]-gingerol and [12]-gingerol isolated from ginger rhizome against periodontal bacteria. Phytother. Res. 22(11):1446-1449.
[https://doi.org/10.1002/ptr.2473]

-
Park SJ, Kim GH, Kim HA, Lee H, Gwon HW, et al., 2012. Controlling effect of agriculture organic materials on phytophthora blight and anthracnose in red pepper. Res. Plant Dis. 18(1):1-9. (In Korean)
[https://doi.org/10.5423/RPD.2012.18.1.001]

-
Park WP, Jung JH, Cho SH, Kim CH, 2004. Quality characteristics of Unshiu orange and pear packaged with paper incorporated with antimicrobial agents. J. Korean Soc. Food Sci. Nutr. 33(10):1715-1719. (In Korean)
[https://doi.org/10.3746/jkfn.2004.33.10.1715]

-
Pinel B, Audo G, Mallet S, Lavault M, De La Poype F, et al., 2007. Multi-grams scale purification of xanthanolides from Xanthium macrocarpum. centrifugal partition chromatography versus silica gel chromatography. J. Chromatogr. A. 1151(1-2):14-19.
[https://doi.org/10.1016/j.chroma.2007.02.115]

-
Reina E, Al-Shibani N, Allam E, Gregson KS, Kowolik M, et al., 2013. The effects of plantago major on the activation of the neutrophil respiratory burst. J. Tradit. Complement. Med. 3(4):268-272.
[https://doi.org/10.4103/2225-4110.119706]

-
Ren CG, Dai CC, 2012. Jasmonic acid is involved in the signaling pathway for fungal endophyte-induced volatile oil accumulation of Atractylodes lancea plantlets. BMC Plant Biol. 12:128.
[https://doi.org/10.1186/1471-2229-12-128]

- Schilder AMC, Gillett JM, Sysak RW, Wise JC, 2002. Evaluation of environmentally friendly products for control of fungal diseases of grapes. Proceedings of the 10th international conference on cultivation technique and phytopathological problems in organic fruit-growing and viticulture, Weinsberg, Germany. 4-7 Feb. pp. 163-167.
- Schmitt A, Kunz S, Nandi S, Seddon B, Ernst A, 2002. Use of Reynoutria sachalinensis plant extracts, clay preparations and Brevibacillus brevis against fungal diseases of grape berries. Proceedings of the 10th international conference on cultivation technique and phytopathological problems in organic fruit-growing and viticulture. Weinsberg, Germany. 4-7 Feb. pp. 146-151.
-
Sohn HY, Son KH, Kwon CS, Kwon GS, Kang SS, 2004. Antimicrobial and cytotoxic activity of 18 prenylated flavonoids isolated from medicinal plants: Morus alba L., Morus mongolica Schneider, Broussnetia papyrifera (L.) Vent, Sophora flavescens Ait and Echinosophora koreensis Nakai. Phytomedicine. 11(7-8):666-672.
[https://doi.org/10.1016/j.phymed.2003.09.005]

-
Sultan MZ, Jeon YM, Moon SS, 2008. Labdane-type diterpenes active against acne from pine cones (Pinus densiflora). Planta Med. 74(4):449-452.
[https://doi.org/10.1055/s-2008-1034321]

-
Sung WS, Lee DG, 2008. In vitro candidacidal action of Korean red ginseng saponins against Candida albicans. Biol Pharm Bull. 31(1):139-142.
[https://doi.org/10.1248/bpb.31.139]

-
Tomas-Barberan FA, Cole MD, Garcia-Viguera C, Tomas-Lorente F, Guirado A, 1990. Epicuticular flavonoids from Bellardia trixago and their antifungal fully methylated derivatives. Int. J. Crude Drug Res. 28(1):57-60.
[https://doi.org/10.3109/13880209009082777]

-
Wang Y, Liao D, Qin M, Li X, 2016. Simultaneous determination of catalpol, aucubin, and geniposidic acid in different developmental stages of Rehmannia glutinosa leaves by high performance liquid chromatography. J. Anal. Methods Chem. 2016:1-6.
[https://doi.org/10.1155/2016/4956589]

-
Xu LL, Han T, Wu JZ, Zhang QY, Zhang H, et al., 2009. Comparative research of chemical constituents, antifungal and antitumor properties of ether extracts of Panax ginseng and its endophytic fungus. Phytomedicine. 16(6-7):609-616.
[https://doi.org/10.1016/j.phymed.2009.03.014]

-
Xue P, Yang X, Sun X, Ren G, 2017. Antifungal activity and mechanism of heat-transformed ginsenosides from notoginseng against Epidermophyton floccosum, Trichophyton rubrum, and Trichophyton mentagrophytes. RSC Adv. 7:10939-10946.
[https://doi.org/10.1039/C6RA27542G]

-
You F, Han T, Wu JZ, Huang BK, Qin LP, 2009. Antifungal secondary metabolites from endophytic Verticillium sp.. Biochem. Syst. Ecol. 37(3):162-165.
[https://doi.org/10.1016/j.bse.2009.03.008]

-
You X, Wakana D, Ishikawa K, Hosoe T, Tojo M, 2019. Antifungal activity of compounds isolated from bamboo vermicompost against Rhizoctonia solani AG1-IB. Adv. Microbiol. 9:957-970.
[https://doi.org/10.4236/aim.2019.912061]

-
Zhao M, Tao J, Qian D, Liu P, Shang EX, et al., 2016. Simultaneous determination of loganin, morroniside, catalpol and acteoside in normal and chronic kidney disease rat plasma by UPLC-MS for investigating the pharmacokinetics of Rehmannia glutinosa and Cornus officinalis Sieb drug pair extract. J. Chromatogr. B. 1009-1010:122-129.
[https://doi.org/10.1016/j.jchromb.2015.12.020]

-
Zhou Y, Liu H, Zhao J, Tan M, Sui P, et al., 2008. Poplar stem blister canker and its control strategies by plant extracts. World J. Microbiol. Biotechnol. 24:1579-1584.
[https://doi.org/10.1007/s11274-007-9648-4]

Kyeong-Yeol Oh, Department of Agricultural Chemistry, Institute of Agriculture and Life Science (IALS), Gyeongsang National University, Ph.D. student, https://orcid.org/0000-0002-1699-4164
Dong-Kyu Jeong, Anti-Aging Research Group, Gyeongnam Oriental Anti-Aging Institute, Researcher, https://orcid.org/0000-0001-8030-5389
Yeong Hun Song, Department of Agricultural Chemistry, Institute of Agriculture and Life Science (IALS), Gyeongsang National University, Postdoctoral researcher, https://orcid.org/0000-0003-4095-5621
Deuk-Yeong Lee, Department of Agricultural Chemistry, Institute of Agriculture and Life Science (IALS), Gyeongsang National University, Ph.D. student, http://orcid.org/0000-0001-6047-5276
Dong-Yeol Lee, Anti-Aging Research Group, Gyeongnam Oriental Anti-Aging Institute, Researcher, https://orcid.org/0000-0003-1192-1932
Geun-Hyoung Choi, Department of Agro-food Safety and Crop Protection, National Institute of Agricultural Science, Agricultural Researcher, https://orcid.org/0000-0003-1991-1544
Se-Ri Kim, Department of Agro-food Safety and Crop Protection, National Institute of Agricultural Science, Agricultural Senior Researcher, https://orcid.org/0000-0001-6857-8317
Jin-Hyo Kim, Department of Agricultural Chemistry, Institute of Agriculture and Life Science (IALS), Gyeongsang National University, Professor, https://orcid.org/0000-0002-0341-7085
Oh KY performed the experiments; Jeong DY and Lee DY prepared the extracts; Choi GH, Lee DY, Song YH and Kim SR contributed to the design and discussion of this research; Kim JH supervised and wrote this manuscript.
