고추탄저병 병원균(Colletotrichum coccodes)에 대한 배초향(Agastache rugosa)의 지상부로부터 항진균 활성물질 탐색
초록
고추탄저병의 원인균인 Colletotrichum coccodes에 대한 친환경 농자재 개발을 목적으로 배초향(Agastache Rugosa)의 지상부 추출물로부터 항진균 활성물질을 탐색하였다. 메탄올(MeOH)로 추출한 배초향의 지상부를 hexane, chloroform, ethyl acetate, butanol, aquous로 순차적으로 용매분획 하였고, 생물검정 결과 강한 활성을 보인 hexane fraction에서 silica gel column chromatography를 2회 반복하였다. 활성분획으로 분리한 구조는 (1R,4S,4aS,6R,8aS)-4,8a,9,9-tetramethyldecahydro –1,6-methanonaphthalen-1-ol(Patchouli alcohol)로 구조동정 되었다. 생물검정 결과, Patchouli alcohol의 C. coccodes에 대한 EC50값은 48.9 ppm으로 측정되었으며 배초향 추출물은 식물 탄저병의 원인 진균 중 하나인 C. coccodes에 대해 항진균 활성을 가진 것으로 확인되었다. 따라서 Patchouli alcohol은 친환경 농업자재로 개발 활용이 가능할 것으로 기대된다.
Abstract
To develop an eco-friendly agent against Colletotrichum coccodes, the causative agent of anthracnose, including peppers, in peppers, an attempt was made to develop an antifungal agent using the aerial parts of Agastache rugosa. Based on the aerial parts of the Agastache rugosa extracted with methanol, solvent fractionation was sequentially attempted using solvents of hexane, chloroform, ethyl acetate, butanol, and water. Silica gel column chromatography was repeated twice on the hexane fraction, which showed the highest antifungal activity in the bioassay. The active structure was identified as (1R, 4S, 4aS, 6R, 8aS)-4, 8a, 9, 9-tetramethyldecahydro-1,6-methanonaphthalen-1-ol(Patchouli alcohol) by GC-MS. As a result of bioassay, the EC50 value for C. coccodes of Patchouli alcohol was measured to be 48.9 ppm. Accordingly, the extract of Agastache rugosa was confirmed to exhibit antifungal activity against C. coccodes, one of the causes of plant anthracnose. Therefore, Patchouli alcohol and is therefore expected to be used as an eco-friendly agricultural material.
Keywords:
Agastache rugosa, Antifungal active substance, Colletotrichum coccodes, Identification, Patchouli alcohol키워드:
배초향, 항진균활성물질, 탄저병, 식별, 용매분획서 론
식물탄저병은 Colletotrichum gloeosporioides, C. dematium, C. acutatum, C. coccodes 등의 C. spp.로 분류되는 균주들에 의해 발병한다(Park & Kim, 1992). 그 중 C. coccodes는 Ascomycota문, Sordariomycetes강, Glomerellales목, Glomerellaceae과에 속하는 진균으로써, 균사에 격막이 존재하지 않는 다수의 핵을 가진 균사체를 형성함과 더불어 무성포자에 의해 번식이 이루어지는 식물병원균이다. 주로 감자의 흑점뿌리썩음병(black dot)과 토마토의 탄저병(anthracnose)을 유발하는 것으로 알려져 있고(Thirumalachar, 1967; Mohan & Davis, Dillard, 1989), 박과(cucurbitaceae), 콩과(leguminosae) 및 가지과(solanaceae) 식물의 병균에 해당하며, C. gloeosporioides, C. acutatum 등과 더불어 고추를 포함한 경제적 작물의 생산에 피해를 주는 다범성 진균에 속한다.
식물탄저병 감염의 경우 균류는 검은 반점과 괴사성 병변이 형성(Johnson and Miliczky 1993)되고 식물의 잎과 다른 지상 부분에 검은점병이 발생하여 대량의 포자가 형성되며, 이 포자는 다른 식물 기관으로 고온다습기에 빗방울이나 토양으로 인한 상처와 관련이 있으며 관개수 혹은 바람으로 감염시킨다. 감염된 식물은 시들어 보이고 아래쪽과 가운데 잎은 엽록소가 없어지며 짙은 갈색에서 검은색으로 변한다(Mogan et al.,1992 ; Johnson, 1994).
국내에서는 1988년도 충남에서 발견된 것을 시작으로 국내의 고추와 토마토 등의 가지과 식물에 대해 지속적인 피해를 일으키고 있다(Oh et al., 1988). C. coccodes를 비롯한 C. spp. 속이 일으키는 고추 탄저병의 피해를 막기 위해 농가에서는 경종적 방제, 물리적 방제, 화학적 방제를 비롯한 방법으로 대처하고 있으며, 최근에 는 탄저병의 저항성 모종을 사용한 대처법도 확립되었다. 하지만 현행 농가에서는 여전히 Thiabendazole, Prochloraz, Thiram, Imazalil, Captafol 등을 이용하여 제조된 화학적 방제제를 사용한 대처에 의존하고 있으나 그에 따른 대가로 일부 지역의 균주들에게서 Propineb, Pyraclostrobin, Chlorothalonil 등의 화학적 방제제에 대한 내성균이 발생하는 사례가 보고되고 있으며(Ju et al., 2021), 열매부위의 잔류농약 및 오남용으로 인한 부작용의 위험이 보고되었다. 친환경제제의 경우 Bacillus sp. SW29-2 등의 방선균을 이용한 제제 등이 확인되었으나 그 수가 화학적 방제제에 비해 적은 편에 속한다(Yi et al., 2005). 따라서 탄저병의 주요 원인균이 될 수 있는 C. coccodes에 대한 신규 천연물 방제제의 개발이 필요한 것으로 판단되었다.
배초향(Agastache rugosa, AR)은 Korean mint라고도 불리는 한국, 중국, 일본 등의 동아시아권에서 자생하는 꿀풀과의 식물이다(Park, 2018). 한약재로서 사용될 때는 곽향이라고 불리며 소화불량, 감기 등에 약재로서 쓰인다(Zou, 1832). 배초향에서 유래된 생리활성 물질은 menthone, isomenthone, dihydrocarvone, anethole, vanillin, eugenol, methyl eugenol, β-caryophyllene, β-caryophyllene oxide, estragole 등이 밝혀졌다(Kim & Hong, 2021). 배초향의 메탄올 추출물에서 Bacillus subtilis, Staphylococcus aureus 등의 균주에 대해 항균활성 효과를 나타냈으며(Hong et al., 2020) 성분 중 하나인 estragole은 Cryptococcus neoformans, Blastoschizomyces capitatus 등의 진균에 대해 항진균 활성효과를 나타내었다는 보고가 있다(Kim et al., 1999).
따라서, 본 논문에서는 C. coccodes에 대한 화학적 방제제의 오남용을 줄이기 위한 대처방안으로 친환경 유기농자재를 이용한 방제 가능성의 탐구를 위해 배초향 지상부 유래 항진균 활성물질의 구명 및 항진균 활성을 실시하였다.
재료 및 방법
실험재료
본 연구에서 사용한 고추 탄저병균은 C. coccodes (Wallroth) S. Hughes(KACC 40032)로서 국립농업과학원 농업미생물 은행으로부터 2021년 12월에 분양받아 경북대학교 대학원 생태환경시스템학과 식물자원전공 천연물화학연구실에서 보관 및 계대배양하여 사용하였다. 식물재료인 배초향(Agastache rugosa)은 대구 칠성시장에서 건조된 잎을 구매하여 사용하였다.
시약 및 기기
시료 추출과 용매분획 및 Silica gel column chromatography에서 사용한 methanol(MeOH) n-hexane(hexane), chloroform(CHCl₃), n-butanol(BuOH)은 (주)삼전순약공업의 extra pure grade의 용매를 사용하였으며 ethyl acetate(EtOAc)는 (주)덕산약품공업의 extra pure grade의 것을 사용하였고 H2O는 UMC Scientific Instruments사의 Water Purification System Plus ll (RO/UP) 30 L/hr로 조제하여 사용하였다. Bioassay에서 사용된 potato dextrose agar (PDA)배지는 Becton, Dickinson & Co의 제품을 사용하였고, petri dish는 SPL사의 제품을 사용하였다.
Silica gel (7734)은 Merck사 제품을, thin layer chromatography (TLC)는 Merck Millipore사의 제품을 사용하였으며 여과지 (300 mmΦ, No. 2)는 Advantec사(Toyo Roshi Kaisha) 제품을 사용하였다. Gas chromatography/mass spectrometry(GC/MS)는 Agilent의 7890A 기종을, column은 HP-5MS capillary를, detector는 Agilent의 5975C 기종을 사용하였으며 library는 Wiley (W9N08.L)를 사용하였다.
실험 병원균의 배양 조건
C. coccodes의 배양을 위하여 PDA배지(39 g, 증류수 1,000 ml)를 평판 배지의 형태로 조제하였다. Cork borer를 이용하여 절취한 후 배지의 중앙에 접종하여 25℃에 6일간 배양하였다.
메탄올 추출물 제조
건조된 배초향 시료 478.60 g을 blander(㈜한일전기, HMF-3,260 S, 8,700 rpm)를 이용해 잘게 분쇄하여 99.5% 메탄올 5L로 실온에서 24시간 침지 후 추출하였다. 침지 및 추출 과정을 2회 반복 후 상등액을 filter paper를 이용하여 고형물을 걸러내고 40℃에서 rotary evaporator로 감압 및 농축하여 메탄올 추출물 31.59 g를 얻었다.
용매분획
메탄올 추출물 31.59 g을 증류수 500 ml에 현탁시킨 후 hexane, CHCl₃, EtoAc, BuOH의 순차적으로 각각 500 ml씩 3회 용매분획하여 hexane fraction(9.65 g), CHCl₃ fraction(2.65 g), EtOAc fraction(0.62 g), BuOH fraction(1.26 g), aqueous layer(17.41 g)을 얻었다.
생물검정
고압멸균을 진행한 PDA 배지에 메탄올 추출물의 최종농도가 1,000 ppm이 되도록 첨가한 것과 용매분획의 결과물을 최종농도가 100 ppm이 되도록 조정하여 첨가한 것을 petri dish(60 mm∅×15 mm)에 분주하여 평판배지를 조제하였다. 또한 대조군으로서 PDA배지에 1%가 되도록 MeOH를 섞은 것을 사용하였다. 완전히 굳어진 배지의 중앙부에 cork borer(5 mm)로 채취한 C. coccodes를 치상한 후 25℃ incubator에서 6일간 배양 후 균사의 직경을 측정하였다.
항진균 활성물질 분리 및 정제
활성이 가장 강한 것으로 나타난 hexane fraction으로부터 활성물질을 분리하기 위하여 glass column(40 mm×720 mm)에 silica gel (7734) 300 g을 충진한 후 hexane fraction(9.65 g)을 loading시켜 CHCl3:MeOH (9:1,v/v)의 용매계로 isocratic elute 방식으로 순차적으로 용출하여 50 ml씩 30개의 fraction(HS-1~HS-30)을 얻었다. 이 중 활성이 우수한 HS-3 fraction 1.9 g을 얻었다.
1차 open column chromatography에서 얻은 활성분획 HS-3 1.9g을 다시 silica gel(7734, 250 g)이 충진된 glass column (30 mm×900 mm)에 loading하여 CHCl3:MeOH(9:1,v/v)의 용매계로 순차적으로 용출시켜 10ml씩 20개의 subfraction(HSS-1~HSS-20)을 얻었다.
20개의 subfraction을 bioassay한 결과 HSS-13 subfraction에서 활성이 나타났으며, 최종적으로 HSS-13 subfraction 0.14 g의 활성물질을 얻었다.
항진균 활성물질 구명
Open column chromatography를 통해 분리한 20개의 subfractions 중 항진균 활성이 높은 HSS-13 subfraction을 대상으로 GC-MS 분석을 실시하였다. 그 결과, 해당 subfraction의 주요 물질로 추정되는 Patchouli alcohol의 표준품 시약을 구매하여 서로간의 retention time(RT)과 mass spectrum을 비교 분석하여 활성물질의 화학적 구조를 구명하였다.
항진균 활성 평가
Patchouli alcohol의 균사생장 억제능을 확인하기 위하여 Patchouli alcohol 표준품을 0, 1, 10, 50, 100 ppm이 되도록 고압 멸균한 PDA에 첨가하여 plate media를 조제하였다. 완전하게 굳어진 배지의 중앙부에 cork borer(5 mm)로 절취한 C. coccodes를 치상하여 25℃ incubator에서 6일간 배양한 이후 균사생장 억제능의 검정을 진행하였다. 실험으로 얻어진 성적을 EC₅₀ (effective concentration inhibiting by 50% of mycelial growth)값을 산출하였다.
결과 및 고찰
배초향(Agastache rugosa) 지상부에서 추출한 배초향 메탄올 추출물은 고추 탄저병의 원인균 중 하나인 C. coccodes에 대하여 강한 활성을 나타내는 것으로 나타났다(Fig.1).
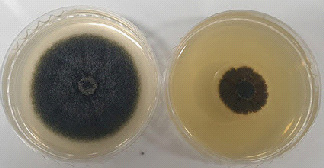
Antifungal activity of MeOH extract against C. coccodes at 1,000 ppm concentration. A: Control, B: MeOH extract.
A. rugosa 지상부의 항진균 활성물질을 구명하기 위하여 A. rugosa 지상부의 메탄올 추출물을 n-hexane, CHCl₃, EtOAc, BuOH, H2O로 용매분획하여 얻은 각각의 fraction들을 대상으로 100 ppm농도에서 항진균 활성을 검정한 결과, hexane fraction에서 가장 강한 활성을 나타내었다(Fig.2).
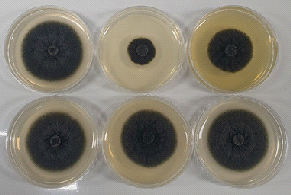
Antifungal activities of solvent fractions from MeOH extract against C. coccodes at 100ppm concentration.A: Control, B: Hexane fraction, C: CHCl₃ fraction, D: EtOAc fraction, E: BuOH fraction, F: Aqueous layer.
Hexane fraction 9.65 g을 silica gel (7734) 300 g이 충진된 silica gel column chromatography에 loading하고 CHCl3:MeOH (9:1, v/v)의 용매계로 isocratic elute 방식으로 순차적으로 용출하여 50 ml씩 30개의 fraction(HS-1~HS-30)을 얻었다. 30개의 fraction들을 대상으로 항진균 활성검정을 진행한 결과 강한 활성을 나타낸 HS-3 fraction 1.9 g을 얻었다.
1.9 g의 HS-3 fraction을 2차로 silica gel(7734) 250 g이 충진된 open column chromatography에 loading하고 CHCl3:MeOH(9:1,v/v)의 용매계로 순차적으로 용출하여 10 ml씩 20개의 subfraction (HSS-1~HSS-20)을 얻었다. 20개의 subfraction들을 대상으로 항진균 활성검정을 진행한 결과 HSS-13 subfraction에서 강한 활성을 나타내어 최종적으로 활성분획 HSS-13 subfraction 0.14 g을 순수 분리·정제하였다.
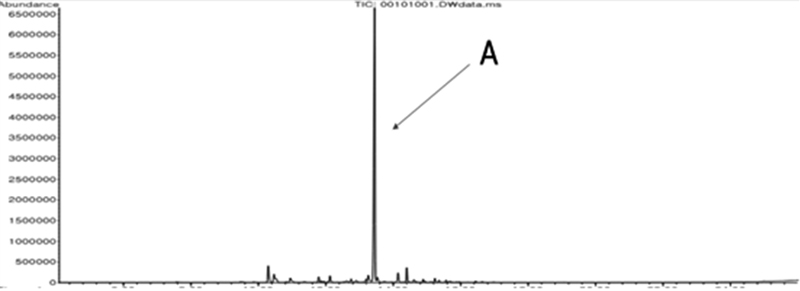
항진균 활성이 확인된 HSS-13 subfraction을 GC/MS로 분석한 결과 GC chromatogram에서 13.45 min에서 나타난 A peak가 main peak로 확인되었다(Fig.3).
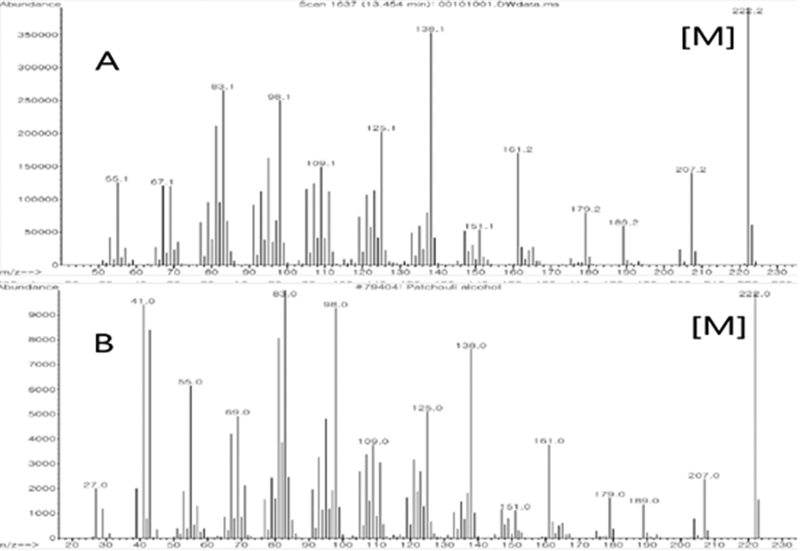
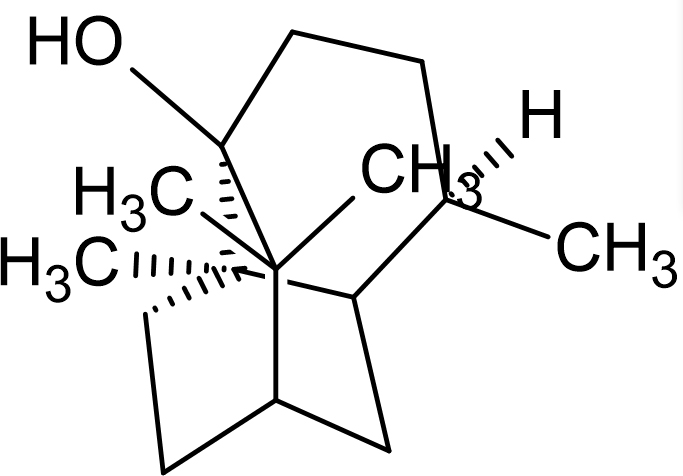
HSS-13 subfraction의 GC chromatogram 상에서 13.45 min에 나타난 A peak의 mass spectrum과 Wiley library의 mass spectrum을 비교 분석한 결과, A peak는 87% quality로 (1R,4S,4aS,6R,8aS)-4,8a,9,9-tetramethyldecahydro-1,6-methanonaphthalen-1-ol(Patchouli alcohol)화합물로 추정되었다(Fig.4).
이 항진균 활성물질로 추정되는 화합물을 명확히 구명하기 위하여 시판되고 있는 표준품 Patchouli alcohol을 ChemFaces사에서 구매하여 GC-MS로 비교 분석을 진행하였다.
분석결과 표준품 Patchouli alcohol는 13.385min에서 peak가 확인되었으며(Fig.5) 해당 peak의 MS spectrum(Fig.6)과 HSS-13 subfraction A peak의 MS spectrum의 비교분석을 진행한 결과 일치하였다.
따라서, HSS-13 subfraction에서 분리된 항균활성 화합물은 Patchouli alcohol로 동정되었다.
Patchouli alcohol은 1869년도에 Gal이 Patchouli에서 처음으로 분리하였으며 해당물질의 화학적 조성을 Montgolfier가 C15H26O로 구명하였다(Büchi et al., 1961). Patchouli alcohol은 대장암, 유방암, 췌장암 등의 종양형성과 염증반응을 억제하고, 경구 투여했을 경우 식세포 능력의 향상 및 체액성 면역 반응 증가에 영향을 끼쳐 임상용 면역 조절제로서 연구되어지고 있으며 쥐를 대상으로 한 실험에서 LD50값이 4.693 g/kg로 확인되어 생물에 대한 독성이 낮은 것으로 알려져 있다(Liao et al., 2013). 항균효과에 대해서 Escherichia coli, Pseudomonas aeruginosa, Bacillus proteus, Shigella dysenteriae, Bacillus thuringiensis 등에 강한 항균활성을 가지는 것으로 보고된 바 있으며(Yang et al., 2013) anti-influenza virus 실험에서도 인플루엔자 바이러스에 대해 억제반응을 내는 것으로 알려져 있고(Kiyohara et al., 2012) 항진균 실험에서는 Aspergillus flavus, Aspergillus oryzae 등의 곰팡이에 대해 무성번식을 억제함으로써 곰팡이 군집의 성장률을 감소시키는 것으로 확인되었다(Kocevski et al., 2013).
항진균 활성 평가
A. rugosa 지상부로부터 활성물질로 분리 동정된 Patchouli alcohol 화합물의 C. coccodes에 대한 정확한 항균활성을 검정하기 위하여 표준품 Patchouli alcohol을 메탄올 용매에 녹인 후 최종농도가 0, 1, 10, 50, 100 ppm이 되도록 PDA배지에 첨가하여 실험배지를 제조하였다. 시험균주를 배지 중앙에 치상하여 25℃ incubator에서 6일간 배양 후 항진균 활성을 검정하여(Fig. 8) EC50값을 산출하였다.
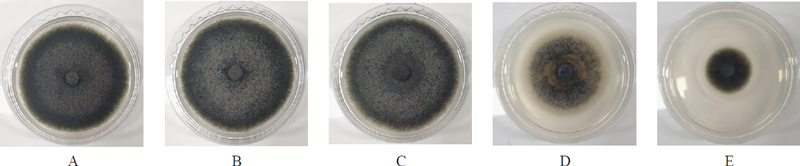
Antifungal activities of Patchouli alcohol against C. coccodes.A, Control ; B, 1 ppm ; C, 10 ppm ; D, 50 ppm ; E, 100 ppm.
생물검정을 진행한 결과 Patchouli alcohol은 C. coccodes에 대해 50 ppm 이상 농도에서 항진균 활성을 나타냈으며 100 ppm 이상의 농도에서 C. coccodes 균주 생육을 확연하게 억제되는 것이 확인되었다. Patchouli alcohol EC50 값을 측정한 결과 48.911 ppm에서 50% 이상의 활성을 나타내는 것으로 확인하였다.
A. rugosa 지상부로부터 분리 및 동정된 Patchouli alcohol은 포도나무와 담배에 괴사성병변을 일으키는 주요원인균인 Botrytis cinerea에 대하여 200 ppm의 농도에서 생장을 억제하는 것으로도 확인되었다(Vallejo et al., 2001).
결과적으로 A. rugosa 지상부로부터 분리 및 동정된 Patchouli alcohol은 C. coccodes에 대한 항진균억제능이 확인되었기에 친환경 유기농자재로서의 개발이 가능할 것으로 판단되었다.
이해상충관계
저자는 이해 상충관계가 없음을 선언합니다.
References
- AAT Bioquest, Inc. 2024, April 8. Quest Graph™ EC50 Calculator. AAT Bioquest. https://www.aatbio.com/tools/ec50-calculator, .
-
A. K. Lees, A. J. Hilton. (2003), Black dot (Colletotrichum coccodes): an increasingly important disease of potato, 20 January 2003.
[https://doi.org/10.1046/j.1365-3059.2003.00793.x]

-
Büchi, G., Erickson, R., & Wakabayashi, N. (1961). Terpenes. XVI. 1, 2 constitution of Patchouli alcohol and absolute configuration of cedrene. Journal of the American Chemical Society, 83(4), 927-938.
[https://doi.org/10.1021/ja01465a042]

- Choi, J. S., Lee, D. W., & Choi, Y. H. (2020). Isolation of Antifungal Activity Substance from Rheum australe D. Don Roots against Fusarium oxysporum f. sp. lycopersici (Saccardo) Snyder & Hansen. Korean Journal of Organic Agriculture, 28(1), 95-108.
-
Han, K. S., Park, J. H., Han, Y. K., & Hwang, J. H. (2009). Pathogenicity and Occurrence of Pepper Seedling Anthracnose Caused by Colletotrichum acutatum. Research in Plant Disease, 15(2), 88-93.
[https://doi.org/10.5423/RPD.2009.15.2.088]

-
Hong, M. J., Kim, J. H., Kim, H. Y., Kim, M. J., & Kim, S. M. (2020). Chemical composition and biological activity of essential oil of Agastache rugosa (Fisch. & CA Mey.) O. Kuntze. Korean Journal of Medicinal Crop Science, 28(2), 95-110.
[https://doi.org/10.7783/KJMCS.2020.28.2.95]

-
Hu, G., Peng, C., Xie, X., Zhang, S., & Cao, X. (2017). Availability, pharmaceutics, security, pharmacokinetics, and pharmacological activities of Patchouli alcohol. Evidence-based complementary and alternative medicine, 2017.
[https://doi.org/10.1155/2017/4850612]

-
Jeon, K. M., & Choi, Y. H., (2023). Antifungal Activity Substances from Mesua ferrea L. fruit against Colletotrichum fructicola. The Korean Journal of Pesticide Science. 27(3), 202-209.
[https://doi.org/10.7585/kjps.2023.27.3.202]

-
Johnson and Miliczky (1993), Potato Black Dot – The Elusive Pathogen, Disease evelopment and Management, American Journal of Potato Research, Volume 95, pages 340–350, (2018).
[https://doi.org/10.1007/s12230-018-9633-5]

-
11. Ju, H. Y., Son, M. R., & Kim, J. W. (2021). Response to Fungicides of Colletotrichum spp. Isolated from Red Peppers in Sunchang, Korea. Research in Plant Disease, 27(4), 164-171.
[https://doi.org/10.5423/RPD.2021.27.4.164]

- Kim, J. B., Cho, K. J., Hwang, Y. S., Park, R. D., & Kim, J. B. (1999). Isolation, identification, and activity of rosmarinic acid, a potent antioxidant extracted from Korean Agastache rugosa. Applied Biological Chemistry, 42(3), 262-266.
- Kim, J. Y., Woon, J. S., Kim, H. J., & Kim, S. H. (2018). Molecular markers for the rapid detection of Colletotrichum coccodes, an anthracnose pathogen of tomato. The Korean Journal of Mycology, 46(2), 186-192.
-
Kiyohara, H., Ichino, C., Kawamura, Y., Nagai, T., Sato, N., & Yamada, H. (2012). Patchouli alcohol: in vitro direct anti-influenza virus sesquiterpene in Pogostemon cablin Benth. Journal of Natural Medicines, 66, 55-61.
[https://doi.org/10.1007/s11418-011-0550-x]

-
Kocevski, D., Du, M., Kan, J., Jing, C., Lačanin, I., & Pavlović, H. (2013). Antifungal effect of Allium tuberosum, Cinnamomum cassia, and Pogostemon cablin essential oils and their components against population of Aspergillus species. Journal of Food Science, 78(5), M731-M737.
[https://doi.org/10.1111/1750-3841.12118]

-
Liao, J. B., Wu, D. W., Peng, S. Z., Xie, J. H., Li, Y. C., Su, J. Y., Chen, J. N., & Su, Z. R. (2013). Immunomodulatory potential of Patchouli alcohol isolated from Pogostemon cablin (Blanco) Benth (Lamiaceae) in mice. Tropical Journal of Pharmaceutical Research, 12(4), 559-565.
[https://doi.org/10.4314/tjpr.v12i4.18]

- Oh, I. S., In, M. S., Woo, I. S., Lee, S. K., & Yu, S. H. (1988). Anthracnose of Pepper seedling caused by Colletotrichum coccodes (Wallr.) Hughes. The Korean Journal of Mycology, 16(3), 151-156.
- Park, K. S., & Kim, C. H. (1992). Identification, distribution and etiological characteristics of anthracnose fungi of red pepper in Korea. The Plant Pathology Journal, 8(1), 61-69.
- Park, S., Kwon, T., Lim, Y., Jung, K., & Choi, B. (1996). Disease survey in melon, watermelon, and cucumber with different successive cropping periods under vinylhouse conditions. Korean Journal of Plant Pathology, 12(4), 428-431.
-
Ragucci, S., Castaldi, S., Landi, N., Isticato, R., & Di Maro, A. (2023). Antifungal Activity of Ageritin, a Ribotoxin-like Protein from Cyclocybe aegerita Edible Mushroom, against Phytopathogenic Fungi. Toxins, 15(9), 578.
[https://doi.org/10.3390/toxins15090578]

- Song, J. H., Kim, M. J., Kwon, K. D., Lee, W. K., & Park, I. H. (1999). Antimicrobial activity and characterization of volatile flavor extracts from Agastache rugosa. Preventive Nutrition and Food Science, 4(2), 97-102.
-
Weyerstahl, P., Gansau, C., & Marschall, H. (1993). Structure–odour correlation. Part XVIII. 1 Partial structures of patchoulol with bicyclo [2.2. 2] octane skeleton. Flavour and fragrance journal, 8(6), 297-306.
[https://doi.org/10.1002/ffj.2730080603]

- Yang, X., Zhang, X., Yang, S. P., & Liu, W. Q. (2013). Evaluation of the antibacterial activity of Patchouli oil. Iranian journal of pharmaceutical research: IJPR, 12(3), 307.
- Yi, Y. S., Kim, H. S., Choi, G. J., Cho, K. Y., & Lim, Y. H. (2005). Antifungal activity of Bacillus sp. against pepper anthracnose. Journal of Applied Biological Chemistry, 48(3), 151-152.
- H., Park, J. S., Oh, I. S., Wu, I. S., Mathur, S.B. (1987). Colletotrichum coccodes found in seeds of Capsicum annuum and pathogenicity to Solanaceae plants. Korean Journal of Mycology, 15(3), 183-186.
Hong-Goo Park, Department of Ecology and Environmental System, Kyungpook National University, Master, https://orcid.org/0009-0007-5264-6224
Kyong-Mi Jeon, Ecological Assessment Institute, Daejeon 34410, Korea https://orcid.org/0009-0005-1345-2158
Yong-Hwa Choi, Department of Ecology and Environmental System, Kyungpook National University, Professor, https://orcid.org/0000-0002-5675-9417