과수화상병 방제를 위해 수간주입한 스트렙토마이신의 잔류특성
 ; Kwang-Sik Kang ; Eun-Seo Park ; Woo-Sik Park ; Young-Joon Choi*
; Kwang-Sik Kang ; Eun-Seo Park ; Woo-Sik Park ; Young-Joon Choi* ; Han-Ju Jeong ; Min-Su Kang ; Tae-Yong Yun ; Hyeok-Woo Nam
; Han-Ju Jeong ; Min-Su Kang ; Tae-Yong Yun ; Hyeok-Woo Nam
초록
화상병은 도입 금지 병원균으로써 과수 전체를 고사시키는 등 치명적인 영향을 광범위하게 끼치며 발병시 완전박멸과 치료가 사실상 불가능하다. 따라서 농가에 경제적·정신적 손실을 초래하기 때문에 이를 보완하기 위해 더욱 효과적인 약제 개발을 위해 본 연구를 진행하였다. 기존에 경엽처리로 등록되어 꾸준히 사용되고 있는 농약들 중 병원균 제어에 효과적인 streptomycin을 대상약제로 선정한 후 살포방법을 보다 직접적으로 영향을 미치는 방법으로 변경하여 사과나무 및 배나무에 개화직전 수간주사 처리하였다. 시간경과 및 나무의 높이에 따라 시료를 채취하여 전처리 방법 및 기기분석법을 확립하였다. 이후 나무의 생리적 특성과 주입물질의 물리화학적 특성 및 확립된 잔류분석을 통한 결과를 토대로 이동성과 지속성을 판단하였을 때 사과나무 및 배나무에서 모두 양호하였다. 이를 토대로 약효의 발현 시점을 화상병의 생활환에 비교·추정하여 약제처리 후 10일 이내인 만개시점보다 30일 이후 신초로 확산되는 과정에 더욱 뛰어날것으로 판단하였다. 허나, 제한적인 실험 방법으로 정확한 결과를 도출하기 어려워 streptomycin의 화상병 억제농도 규명 및 약효 발현 시점 등 추가적인 연구를 통해 더욱 효과적인 약제 개발의 필요성이 있다.
Abstract
Fire blight is a prohibited plant pathogen with a wide range of fatal effects, including withering of the entire tree. Once a fire blight break-out occurs, it is virtually impossible to treat and completely eradicate . Fire blight causes significant economic and psychological damage to farms. Therefore, this study was conducted to develop more effective pesticide treatments by supplementing the pesticides that have been previously used . Among the registered pesticides used continuously for foliar treatment, streptomycin (1%) SL, an effective treatment for controlling pathogens, was selected as the target pesticide. The spraying method was changed to truck injection, a more direct application method, and the apple and pear trees were injected right before flowering. Samples were collected and the methods of pretreatment and instrumental analysis were established according to the elapsed time and the height of the tree. Then, mobility and sustainability factors were judged based on the physiological characteristics of the tree, the physicochemical properties of the injected pesticide, and established residual analysis results The results for both apple and pear trees were positive. Based on this, the onset time of the drugʼs efficacy was compared with the life cycle of fire blight. It was determined that the treatment would be more effective in the process of spreading to new shoots 30 to 50 days after the initial pesticide injection than within 10 days of full bloom. However, there is a need for more research and effective development as it is difficult to derive accurate results with limited experimental methods.
Keywords:
Fire blight, Streptomycin, Trunk injection, Residue키워드:
화상병, 스트렙토마이신, 수간주사, 잔류서 론
과수 화상병은 사과, 배 등 장미과 기주에 병원균인 Erwinia amylovora에 의해 감염되어 일으키는 병으로 발병된 나무는 잎, 꽃, 가지, 과실 등이 불에 탄 것처럼 마름 증상이 나타나며 과수 전체에 고사를 일으킨다(Billing, 2011). 또한, 발병한 과원은 폐원 후 발생한 감염주는 물론 인접주까지 매몰조치 되므로 농업인의 경제적·정신적 피해가 상당하다. 따라서 화상병균은 위험도가 매우 높아 식물방역법상 도입 금지 병원균으로 지정 및 관리되고 있다.
화상병은 1780년 미국의 뉴욕에서 최초 발생 보고된 후 뉴질랜드, 유럽, 중앙아시아 등 세계의 여러 나라에서 발생하고 있으며(van der Zwet et al., 2012), 우리나라의 경우 2015년 경기도 안성 소재의 배 과원에서 화상병 발병이 최초로 보고된 후(Park et al., 2016) 안성, 천안의 배 과원 및 제천, 천안의 사과 과원에서 화상병 발병이 연달아 보고된 바 있다(Myung et al., 2016).
화상병균의 안착을 막기 위해 방제권역별 설정된 공적방제 범위에 따라 발생지역 또는 발생주 100 m 이내 과원을 방제구역으로 설정하여 기주식물은 매몰·폐기 되며, 주변 2 km 이내는 위험구역으로 설정하여 적극적인 화학적 방제와 발생 상황 예찰을 실시하고있다. 또한, 5 km 이내는 관리구역으로 설정하여 화학적 방제 및 주기적인 모니터링을 통해 예방하고있다(Park et al., 2017). 우리나라의 관리 방법과 비슷한 외국의 사례의 경우 대표적으로 스위스와 이스라엘이 있다. 두 나라 모두 화상병 발병 후 완전 박멸을 위해 기주식물 매몰 및 방제 등 국가적 총력에도 불구하고 산발적으로 확산된 후 전국적으로 확대되었다(Ham et al., 2020).
화상병은 완벽한 예방과 박멸이 어려우며, 잠복기가 길고 전염성 또한 강하여 확산을 최소화 시키거나 치료 목적의 약제 개발 등 추가적인 연구가 필요한 실정이다. 그러나, 화상병은 도입 금지 검역병으로써 일반적인 포장시험은 불가능하여 격리된 시설 또는 시험구역에서 진행되어야 하지만(Ham at al., 2023), 과수 재배환경 특성상 비·바람 등 환경적인 요인에 의한 감염과 확산에 매우 취약하여 시험시설의 섭외는 사실상 불가능에 가깝다. 이에 따라, 화상병에 등록되어 사용되는 대부분의 약제는 국내의 사과와 배에 다른 병해충 방제로 등록된 약제를 약해 시험만을 거쳐 직권등록한 후 사용되고 있는 실정이다(Lee at al., 2018).
화상병의 예찰·방제 방법에는 시기에 따라 물리적, 생물학적, 화학적 방제로 나뉜다. 이 중 화학적 방제는 대부분 항생제를 활용한 경엽처리로 이루어지며 약제는 대표적으로 스트렙토마이신(Streptomycin), 옥시테트라사이클린 (Oxytetracycline) 옥솔린산(Oxolinic acid) 등이 있다.
과수 재배 환경 특성상 경엽처리는 기상 조건의 영향을 받아 비산에 의한 약제의 손실이 있을 수 있으며, 약액이 표면에 붙어 수체 내부로 침투·이행되는 양이 적다. 반면, 수간주입법은 나무에 천공을 뚫고 약제를 직접 주입하기 때문에 손실 없이 모든 부위에 침투시켜 경엽처리 대비 병원균 제어에 더욱 효과적이다(Lee et al., 2009, Cha et al., 2020).
Streptomycin은 아미노글리코사이드계 항생제로써 광범위한 병원균의 단백질 합성을 저해시키며, 선행연구에 따라 단제의 경우 화상병을 대상으로 한 방제가가 가장 높아 효과가 입증되어 연구·개발 대상약제로 선정되었다(Sundin et al., 2008; Tancos et al., 2016, Ham et al., 2023).
따라서 본 연구는 streptomycin을 사과나무와 배나무에 수간주입한 후 수체 내 이동성과 지속성을 확인하여 약제 개발 가능성을 검토하고자 하였다.
재료 및 방법
시약 및 기구
Streptomycin sulfate (89.9%)는 Dr. Ehrenstorper GmbH (Augsburg, Germany)사에서 dihydrostreptomycin sesquisulfate (98.0%)는 Sigma-Aldrich (St. Louis, MO, USA)사에서 구매하여 사용하였다. Acetonitrile 및 methanol은 J.T. Baker (Philliosbug, NJ, USA)의 HPLC급을 사용하였으며 ammonium formate (97%), formic acid (95%), heptafluoro-butric acid (99.5%)는 Sigma-Aldrich (St. Louis, MO, USA)사 제품을 사용하였다. 또한 SPE-HLB (0.5 g, 6 cc)는 Waters (Milford, MA, USA)사, syringe filter (PTFE, 0.22 µm)는 Thermo Fisher Scientific (Waltham, MA, USA)사의 제품을 사용하였다. 전지가위(35 mm)는 Narion (Seoul, Korea)사, 원심분리기는 Hanil Science (Gimpo, Korea)사의 Combi R545, 진탕추출기는 Collomix GmbH (Gaimersheim, Germany)사의 viba 330, 분쇄기는 SHMF-3260S (Seoul, Korea)를 사용하였다. 시험농약은 aminoglycoside계 항생물질인 streptomycin 1% 액제를 ㈜동방아그로에서 직접 제조하여 사용하였다.
수간주사 방법
선행 연구에 따르면 화상병의 발병 후 확산은 수령이 10년 이하인 과수에서 빠르다는 보고가 있었다(Johnson & Temple., 2016). 또한, 수령이 5년인 사과 과원과 수령이 10년 이하인 배 과원에서 감염 확산이 빠르다는 보고가 있었다(Lee at al., 2020). 간접적으로 수령이 어린 나무에서 확산이 빠르다는 것을 추정하여 본 연구에서도 수령이 어린 나무를 대상 작물로 선택하였다.
대상 작물의 수령과 품종은 사과나무의 경우 수령이 4년인 감홍(흉고직경 2~3 cm, 평균수고 2 m)이었으며, 배나무의 경우 수령이 4년인 신고(흉고직경 3~4 cm, 평균 수고 1.5 m)를 대상으로 하였다.
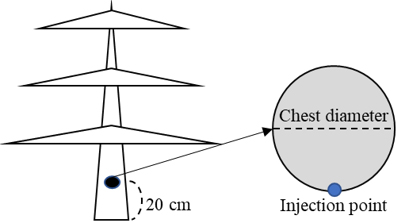
수간주사 방법은 사과나무는 2022년 4월 23일, 배나무는 2022년 4월 7일 지상부 20 cm에 전동드릴(3 mm)을 이용하여 한 개의 천공을 한 다음, 5 mL 사이즈의 원뿔형 팁을 꽂은 후 streptomycin 1% 액제를 흉고직경(cm) 당 원액 1 mL씩 중력에 의해 주입하였다(Fig. 1).
시료채취 방법
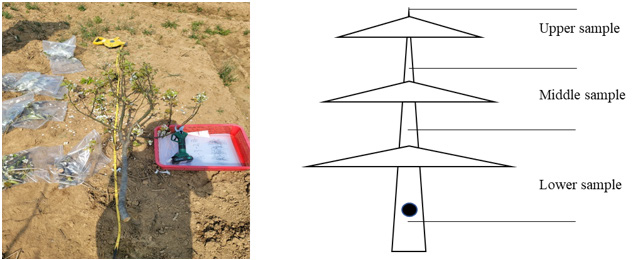
수간주입 후 10, 20, 30 및 50일 차에 뿌리를 제외한 지상부 10 cm 위로 나무를 절단하였다(Fig. 2). 절단한 나무의 총 높이를 동일한 비율로 상, 중, 하를 나누어 전지가위를 사용하여 부위별로 잘랐다. 이후 잎을 제거한 다음 나무의 몸통과 가지부분만 분쇄기로 마쇄하여 분석 전까지 -20oC 냉동고에 보관하였다.
표준원액 및 표준용액 조제
표준품의 순도를 고려하여 streptomycin sulfate 11.0 mg 및 dihydrostreptomycin sesquisulfate 10.2 mg을 20 mL의 deionized water에 녹여 500 mg/L의 stock solution을 만들었다. 이를 deionized water로 희석하여 혼합표준용액 2 mg/L를 조제한 다음 단계적으로 희석하여 0.005, 0.01, 0.02, 0.05, 0.1 및 0.2 mg/L의 working solution을 조제하였다. 이후 각각의 working solution을 무처리 시료 추출액과 혼합하여 matrix-matched 혼합표준용액 0.00025, 0.0005, 0.001, 0.002, 0.005 및 0.01 mg/L를 조제하였다. 또한, 아미노글리코사이드 항생제는 유리에 흡착성이 있으므로 전처리에 사용된 모든 시험도구는 polypropylene 재질을 사용하였다.
전처리법
마쇄한 사과나무와 배나무 시료 10 g에 20 mM ammonium formate 및 0.1% fomic acid가 함유된 deionized water (이하 추출용매) 40 mL를 첨가한 후 30분간 습윤화시켰다. 이후 1시간 동안 800 rpm으로 진탕추출한 다음 부흐너 깔때기로 감압여과하고 추출용매를 이용하여 총 부피가 50 mL가 되도록 정용하였다. 이 후 Methanol 5 mL와 water 5 mL를 차례로 흘려 활성화시킨 HLB catridge (0.5 g, 6 cc)에 앞서 50 mL로 정용한 시료 중 5 mL를 loading한 다음 water 5 mL를 차례로 흘려 streptomycin 및 dihydrostreptomycin을 한번에 용출한 후 최종 부피를 400 mL로 정용하였다. 정용한 시료를 syringe filter로 여과한 다음 LC-MS/MS로 기기분석 하였다. 이 후 chromatogram 상에 나타난 peak의 면적을 측정한 다음 표준 검량선에 대입하여 농도를 산출하였다.
LC-MS/MS 기기분석 조건
Streptomycin 및 dihydrostreptomycin의 분석은 Shimadzu(Kyoto, Japan)사의 액체크로마토그래프(Nexera UPLC)와 질량분석기(LCMS-8060)를 사용하였다. 기기분석에 사용된 칼럼은 streptomycin의 경우 Waters(Milford, MA, USA)사의 Xbridge® Amide (3.5 µm, 2.1 I.D.×100 mm L.)를 사용하였으며, dihydrostreptomycin의 경우 OKAKA SODA (Osaka, Japan)사의 CAPCELL PAK C18 MG III (5 µm, 2.0 mm I.D.×100 mm L.)를 사용하였으며 기기분석 조건은 Table 1과 같다.
두 성분 모두 각 성분에 맞는 이동상으로 기울기 용리 방식을 통해 분석 대상 물질을 분리시켰으며, ESI (Electrospray ionization)의 positive mode로 cone voltage, collision energy 및 정량이온과 정성이온을 선택하였다. 확립된 질량분석 조건은 Table 2와 같다.
잔류분석법 검증
확립된 전처리 방법과 기기분석법으로 정확성(Accuracy), 재현성(Reproducibility), 직선성(Linearity), 검출한계(Limit of detection) 와 정량한계(Limit of quantitation)를 검증하였다. 표준용액과 무처리 시료의 기기분석 결과를 비교하여 간섭물질의 영향이 없음을 확인하였으며(Fig. 3), 무처리 시료와 표준용액으로 matrix-matched하여 분석한 다음 peak의 면적으로 검량선을 작성한 후 결정계수(R2, Coefficients of determination)를 산출하였다. 또한, 검출한계 및 정량한계의 최소검출량을 peak의 S/N (Signal-to-noise ratio)비가 각각 3과 10 이상으로 나타났음을 확인하였다. 검출한계와 정량한계는 최소검출량, 시료 무게, 희석배수, 주입량을 사용하여 산출하였다. 분석법의 정확성을 판단하기 위해 정량한계와 정량한계의 10배 수준에 해당되는 스트렙토마이신 및 디히드로스트렙토마이신 혼합표준용액을 첨가하여 상기 분석법과 동일하게 3반복으로 분석한 다음 회수율의 평균과 상대표준편차(Relative standard deviation, RSD)를 산출하였다.
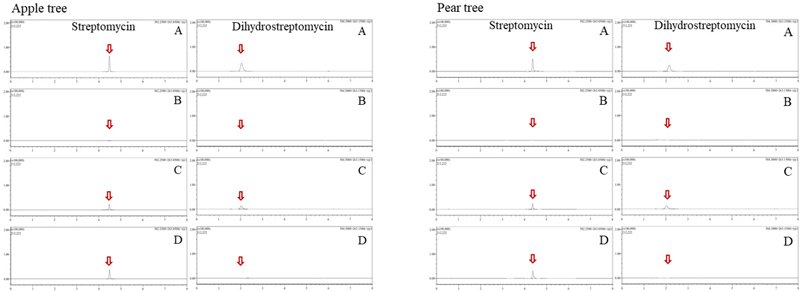
Chromatograms of streptomycin and dihydrostreptomycin. (A) matrix-matched standard 0.1 ng, (B) control, (C) recovery test 0.2 mg/kg, (D) sample
본 시험에 사용된 표준물질은 streptomycin sulfate 및 dihydrostreptomycin sesquisulfate를 사용하였으므로 각각 streptomycin, dihydrostreptomycin으로 환산하였으며, streptomycin의 잔류물의 정의는 streptomycin 모화합물과 dihydrostreptomycin의 합이므로 streptomycin의 잔류량 값에 dihydrostreptomycin의 잔류량에 환산계수를 곱한 값을 더하여 최종 산출하였다.
- Total streptomycin = [streptomycin의 잔류량 × 1)환산계수(1.25)] + [Dihydrostreptomycin 잔류량 × 2)환산계수(1.25) × 3)환산계수(0.997)]
- 1)환산계수(1.25) = 1457.3 (Streptomycin sulfate의 분자량) / 581.6 (Streptomycin의 분자량) × 2분자
- 2)환산계수(1.25) = 730.7(Dihydrostreptomycin sesquisulfate의 분자량) / 583.6(Dihydrostreptomycin의 분자량)
- 3) 환산계수(0.997) = 581.3(Streptomycin의 분자량) / 583.6 (Dihydrostreptomycin의 분자량)
결과 및 고찰
분석법의 유효성 검증
Streptomycin 및 dihydrostreptomycin 두 성분 모두 머무름 시간에 방해물질이 검출되지 않아 높은 분리능과 선택성으로 분석을 진행하였다. Matrix가 90% 함유된 0.0005 mg/L 부터 0.02 mg/L의 matrix-matched standard를 이용하여 검량선을 작성하였다. 결정계수(r2) 값은 0.99 이상으로 높은 직선성을 나타냈다. 검출한계는 0.01 mg/kg, 정량한계는 0.02 mg/kg이었다. 회수율 시험 결과는 평균 70~120% 이내로 나타났으며, 상대표준편차는 20% 미만으로 산출되어 Codex 가이드라인의 잔류농약 분석 기준(CAC/GL 40-1993, 2003) 및 농촌진흥청의 농약 및 원제의 등록기준에 적합하였다(Table 3).
- 정량한계(mg/kg)= 1)정량한계 최소검출량(ng) × (최종정용부피(mL) / 시료무게(g)) × (1 / 주입량(µL))= 0.005 ng × (400 mL / 10 g) × (1 / 10 µL) = 0.02 mg/kg1) 정량한계 최소검출량= 기기상 정량한계(ng/µL) × 주입량(µL)
Streptomycin의 이동성과 지속성
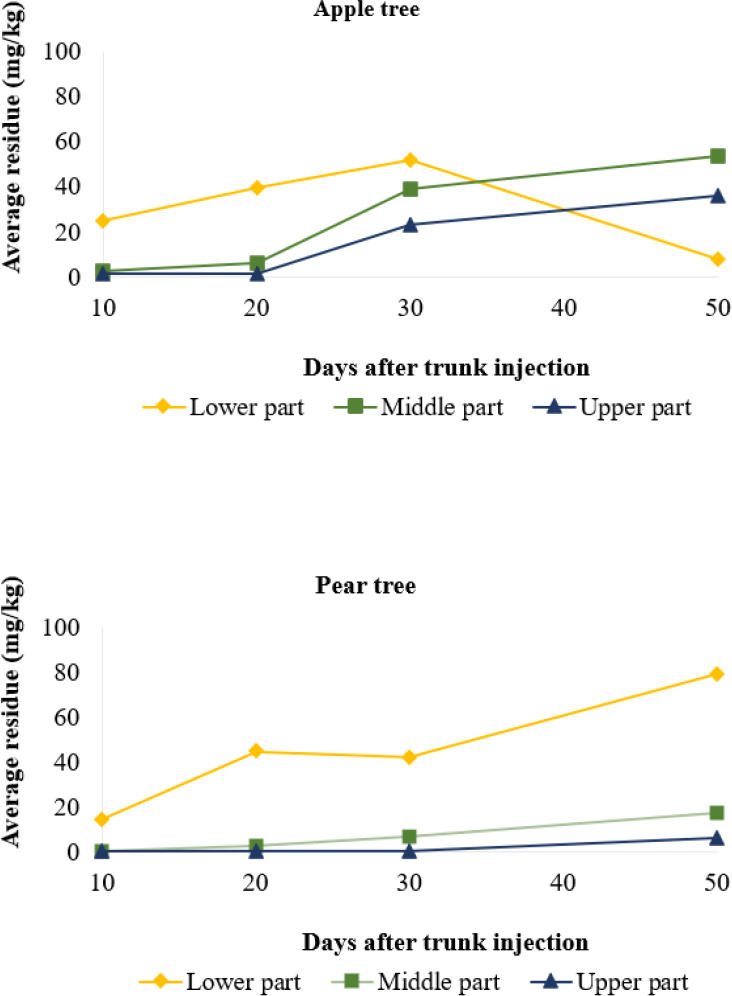
나무 내 유효성분의 이동성과 지속성을 조사하기 위해 수간주입 후 시간 경과 및 나무의 높이에 따라 시료를 채취한 뒤 잔류량을 조사하였다. 결과는 Table 4와 같으며 대사체인 dihydrostreptomycin은 사과나무와 배나무 모든 시료에서 정량한계 미만으로 검출되었다.
수간주입 후 streptomycin은 사과나무의 경우 10일차 시료부터, 배나무의 경우 20일차 시료부터 중·상부에 잔류가 확인되어 수체 내 이동성을 가졌음을 알 수 있었다. 또한, 사과나무와 배나무 모두 30일차 시료부터 중·상부에서 잔류량이 확연히 증가하는 것을 확인하였다(Table 4). 이는 시간 경과에 따라 꽃의 만개와 함께 잎의 수도 많아지므로 활발한 광합성에 의해 하부에서 상부로 이동하는 물의 양 또한 많아지는 것이 원인이라 판단하였다.
그러나, 시간경과에 따른 사과나무와 배나무의 잔류분포 양상은 다르게 나타났다(Fig. 4). 사과나무의 경우 30일 이후부터 하부의 잔류량이 감소하고 중·상부의 잔류량이 점차 증가하는 경향을 보인 반면, 배나무의 경우 50일차까지 하·중·상부의 잔류량이 전부 증가하는 양상으로 나타났다. 이는, 수체 내 증산류는 언제나 아래에서 위, 뿌리에서 잎으로 이동한다고 알려져 있으므로 시간 경과에 따른 잔류 양상은 하부에서 점차 소실되고, 상부에서 대부분의 잔류가 확인되었어야 한다. 그러나, 많은 선행연구에 따라 수간주입된 물질은 모든 방향으로의 이동성을 가진 것이 확인된 바 있으며(Tattar and Tattar, 1999, VanWoerkom, 2012, Lee et al., 2014, Cha et al., 2019), 사과나무와 배나무의 생육 과정과 수체 내부의 특성 등 여러 요인에 의한 결과로 사료된다.
주입된 약액의 이동성을 결정하는 요인은 나무의 생리적 특성, 목질부의 형태, 수관의 상태, 기후 및 토성 환경, 물질의 화학적 특성 및 제형 등이 있다(Reil, 1979, Perry et al., 1991, Tattar, 1989, Sánchez-Zamora and Fernández-Escobar, 2000, Sur and Stork, 2003; VanWoerkom, 2012, Aćimović et al., 2016).
나무의 생리적 특성에서 수종에 따른 목질부의 형태와 구조는 이동성에 큰 영향을 미친다. 목질부의 구성 세포로는 도관(vessel), 가도관(tracheid), 섬유(fiber) 및 유조직(peranchyma) 등 네 가지로 이루어져있으며, 목질부의 구성에 따라 이동량 차이가 있다. 도관은 지름이 커서 많은 양의 이동성을 가지며(Chaney, 1986), 가도관은 도관에 비해 좁고 끝이 막혀있는 구조이므로 상대적으로 이동성이 낮다(Sinclair, 1981). 통도세포에 따른 나무의 재(wood)는 산공재(Diffusive porous wood), 환공재(Ring porous wood), 무공재(Non-porous wood) 등이 있다. 수체 내 물의 이동속도는 대략적으로 환공재 > 산공재 > 무공재 순이다. 또한, 침엽수와 활엽수에서 오는 차이점도 있다. 활엽수는 도관과 가도관이 적절히 혼합되어 있는 반면, 침엽수는 주로 가도관으로 이루어져있다. 사과나무와 배나무는 산공재 활엽수에 해당되어(VanWoerkom, 2012) 수체 내 물의 이동에 따라 약액이 상층부까지 적절히 이동되는 것을 알 수 있었다.
또한, streptomycin의 물리화학적 특성 중 물에 대한 용해도는 >2×104 mg/L (pH 7, 28oC)으로 높은 극성을 가졌고(MacBean, 2013), 사용한 농약의 제형은 액제로써 streptomycin을 물에 녹인 다음 계면활성제를 첨가하여 제제화한 액상제형으로 물에 대한 용해도가 높다. 따라서 수관 내 물관에 효율적으로 이행되어 양호한 이동성을 가졌을 것이라 사료된다.
주입 시기와 환경 또한 약액의 이동성에 큰 영향을 미친다. 선행연구에 따르면 사과나무와 자두나무에서 열매를 수확 후 곧바로 수간주입 했을 때 보다 월동 후 발아직전 또는 개화기에 수간주입 했을 때 약액이 물관부로만 이동하여 이동성이 뛰어났다(Clifford et al., 1987). 또한, 그 밖의 많은 연구에서도 생육 후기보다 초기에 수간주입이 더 적절하다고 보고되었다(Cha et al., 2003, Sánchez-Zamora and Fernández-Escobar, 2000 , Tattar and Tattar, 2007).
시료 수확 최대 기간인 50일차 까지 잔류가 지속되었음을 확인하였다(Table 4). 지속성을 결정하는 요인은 수간주입시 약제의 양이 적고 수용성이 높을수록 수체 내 약효 지속시간도 길어진다고 보고된 바 있다(Lee at al., 2020). 따라서, 개화전 streptomycin 액제를 흉고직경당 1 mL씩 수간주입 하였을 때 나무의 생리적 특성, 주입 시기와 환경 특성, 물질의 물리화학적 특성, 제형의 특성, 약제 주입량 및 잔류분석 결과를 토대로 수체 내 이동성과 지속성에 미치는 영향들은 모두 양호하다고 판단하였다. 그러나, 사과나무와 배나무의 이동성 차이의 원인 규명을 위해 잎과 뿌리 등 분석 부위 추가, 50일 이후 약액의 지속성과 잔류분포 양상 확인을 위한 시료 채취 기간의 증가 등 추가연구가 필요하다.
수간주사 방제시기 예측
과수 화상병의 생활환은 궤양 조직 또는 병든 식물에서 월동한 세균이 습도가 높아지는 봄에 궤양 부위에 세균액을 형성하고 해당 세균액과 접촉한 곤충, 비와 바람, 사람의 영농 활동 등으로 기공과 상처를 통해 빠르게 전염된다. 이후 꽃, 줄기와 가지에서 신초로 전염·확산되며 나무의 궤양으로 발전되고 세균이 죽은 잔가지 등에 매달려 월동을 반복하게 된다. 화상병을 방제하기 위해 동계기 궤양 조직이나 식물에서의 전염원을 제거하거나, 개화기 전 약제 처리를 통해 꽃이나 신초로 확산되는 것을 사전에 차단할 필요성이 있다(Ham et al., 2023).
Streptomycin을 사과나무와 배나무에 개화직전 수간주입 후 시간경과에 따른 잔류량 조사에 따르면 사과나무의 경우 10일 이내에서 하단에서 상단으로의 약액의 이동성이 확인되었으며, 30일 이후에 많은 양이 이동한 것을 알 수 있었다. 배나무의 경우 10~20일 이내에 하단에서 중·상단으로 이동이 확인되었으나, 30일 이후부터 비교적 활발하였다고 볼 수 있다(Table 4). 따라서 화상병의 생활환에 비교하여 10일 전·후 만개 시점에 약효의 발현보다 30일 이후 신초로 확산·감염된 시점에 더욱 방제 효과가 좋을것으로 사료된다.
또한, 현재 화상병의 예방을 위한 화학적 방제 체계는 개화시부터 낙화전까지 경엽살포로 이루어지고 있으며 화상병 예측 정보의 위험 경보 수준에 따라 ‘매우위험’ 경고값이 되면 추가적인 약제 살포가 필요하다. 그러나, 중복살포에 의한 나무와 과실에 약해의 우려가 있어 쉽사리 사용하지 못하는 실정이다. 따라서 기존의 방제 방법에서 약해 및 약효 모두 개선된 예방법이 필요하여 본 연구는 이미 등록되어 사용되고 있는 농약에서 제형과 살포방법을 변경하여 수행 되었다. 수간주입한 결과 약액이 양방향으로 이동성을 가진것과 수체 내에서 수십일간 지속적으로 잔류한 것으로 확인하였다. 이 결과를 토대로 화상병을 효과적으로 제어하기 위해 수간주사를 통한 화상병 억제 또는 제거 농도의 규명 및 정확한 약효의 발현 시점 등 추가적인 연구가 수행되면 화상병의 예방 및 방제기술 개발에 큰 도움이 될 것이다.
Acknowledgments
본 연구는 농촌진흥청의 연구비 지원에 의하여 수행되었습니다(PJ015059).
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
-
Aćimović, S. G., VanWoerkom, A. H., Garavaglia, T., Vandervoort, C., Sundin, G. W., & Wise, J. C. (2016). Seasonal and cross-seasonal timing of fungicide trunk injections in apple trees to optimize management of apple scab. Plant Disease, 100(8), 1606-1616.
[https://doi.org/10.1094/PDIS-09-15-1061-RE]

-
Billing, E. (2011). Fire blight. Why do views on host invasion by Erwinia amylovora differ?. Plant Pathology, 60(2), 178-189.
[https://doi.org/10.1111/j.1365-3059.2010.02382.x]

-
Cha, B., Kim, M., Kim, J., Kim, C., & Lee, K. J. (2019). Influence of the injection wound size and the crown condition on the trunkinjection efficiency in Zelkova trees. The Journal of Agriculutre Life Science 53(1), 73-84.
[https://doi.org/10.14397/jals.2019.53.1.73]

-
Cha, B. J., Han, S. S, Kim, K. W, Kim, D. S & Lee, D. W. (2020). Improving Strategies for Trunk Injection Considering Tree Anatomy and Physiology. The Korean Journal of Pesticide Science, 24(2), 344-351
[https://doi.org/10.7585/kjps.2020.24.2.218]

-
Chaney, W. R. (1986). Anatomy and physiology related to chemical movement in trees. Arboriculture & Urban Forestry (AUF), 12(4), 85-91.
[https://doi.org/10.48044/jauf.1986.019]

-
Clifford, D. R., Gendle, P., & Holgate, M. E. (1987). Uptake and movement of the fungicide imazalil following trunk injection into apple and plum trees by a novel, rapid technique. Annals of applied biology, 111(3), 541-551.
[https://doi.org/10.1111/j.1744-7348.1987.tb02012.x]

-
Ham, H. H, Lee, K. J., Hong, S. J., Kong, H. G., Lee, M. H., Kim, H. R., & Lee, Y. H. (2020). Outbreak of fire blight of apple and pear and its characteristics in Korea in 2019. Research in Plant Disease, 26(4), 239-249.
[https://doi.org/10.5423/RPD.2020.26.4.239]

-
Ham, H. H, Lee M. H., Roh, E. J., Lee, W. H., Choi, H. W., Yang, M. S., & Lee, Y. H. (2023). Effect of the Registered Control Agents for Fire Blight on Fire Blight Disease at Flowering Stage of Apple in Korea. The Korean Journal of Pesticide Science, 27(4), 344-351.
[https://doi.org/10.7585/kjps.2023.27.4.344]

-
Heo, G. I., Shin, D. S., Son, S. H., Oh, C. S., Park, D. H., Lee, Y. K., & Cha, J. S. (2017). On-site diagnosis of fire blight with antibody-based diagnostic strips. Research in Plant Disease, 23(4), 306-313.
[https://doi.org/10.5423/RPD.2017.23.4.306]

-
Johnson, K. B., & Temple, T. N. (2016). Comparison of methods of acibenzolar-S-methyl application for post-infection fire blight suppression in pear and apple. Plant Disease, 100(6), 1125-1131.
[https://doi.org/10.1094/PDIS-09-15-1062-RE]

-
Lee, H. S., Do, J. A., Park, J. S., Park, S. M., Cho, S. M., Shin, H. S., Jang, D. E., Choi, Y. N., & Lee, K. (2019). Development of simultaneous analytical method for streptomycin and dihydrostreptomycin detection in agricultural products using LC-MS/MS. Journal of Food Hygiene and Safety, 34(1), 13-21.
[https://doi.org/10.13103/JFHS.2019.34.1.13]

- Lee, S. M., Kim, D. S., Kim, C. S., Choo, H. Y., & Lee, D. W. (2008). Possibility of simultaneous control of pine wilt disease and Thecodiplosis japonensis and or Matsucoccus thunbergianae on black pine (Pinus thunbergii) by abamectin and emamectin benzoate. The Korean Journal of Pesticide Science, 12(4), 363-367.
- Lee, S. M., Kim D. S., Kim, C. S., Cho K. S., Choo H. Y., & Lee D. W. (2009). Persistence and Distribution of Trunk-Injected Abamectin in Pinus thunbergii and Pinus koraiensis Tissues. The Korean Journal of Pesticide Science, 13(3), 190-196.
- MacBean, C. (Ed.). (2012). The pesticide manual: a world compendium. Cambridge: BCPC.
- MacBean C, 2012. The pesticide manual: a world com pendium. BCPC. pp.1070-1071.
-
Park, D. H., Yu, J. G., Oh, E. J., Han, K. S., Yea, M. C., Lee, S. J., ... & Oh, C. S. (2016). First report of fire blight disease on Asian pear caused by Erwinia amylovora in Korea. Plant Disease, 100(9), 1946-1946.
[https://doi.org/10.1094/PDIS-11-15-1364-PDN]

- Park, D. H., Lee, Y. G., Kim, J. S., Cha, J. S., & Oh, C. S. (2017). Current status of fire blight caused by Erwinia amylovora and action for its management in Korea. Journal of plant pathology, 59-63.
-
Perry, T. O., Santamour, F. S., Stipes, R. J., Shear, T., & Shigo, A. L. (1991). Exploring alternatives to tree injection. Journal of Arboriculture, 17(8), 217-226.
[https://doi.org/10.48044/jauf.1991.052]

- Reil, W. (1979). Pressure-injecting chemicals into trees. California Agriculture, 33(6), 16-19.
-
Sinclair, W. A., & Larsen, A. O. (1981). Wood characteristics related to'injectability'of trees.
[https://doi.org/10.48044/jauf.1981.002]

-
Sundin, G. W., Werner, N. A., Yoder, K. S., & Aldwinckle, H. S. (2009). Field evaluation of biological control of fire blight in the eastern United States. Plant Disease, 93(4), 386-394.
[https://doi.org/10.1094/PDIS-93-4-0386]

- Sur, R., & Stork, A. (2003). Uptake, translocation and metabolism of imidacloprid in plants. Bulletin of insectology, 56, 35-40.
-
Tancos, K. A., & Cox, K. D. (2016). Exploring diversity and origins of streptomycin-resistant Erwinia amylovora isolates in New York through CRISPR spacer arrays. Plant Disease, 100(7), 1307-1313.
[https://doi.org/10.1094/PDIS-01-16-0088-RE]

-
Tattar, T. A., & Tattar, S. J. (1999). Evidence for the downward movement of materials injected into trees. Journal of Arboriculture, 25, 325-332.
[https://doi.org/10.48044/jauf.1999.043]

- Tattar, T. A. (2012). Diseases of shade trees. Elsevier.
-
Van der Zwet, T., Orolaza-Halbrendt, N., & Zeller, W. (2012). CHAPTER 6: Growth and Physiology of Erwinia amylovora. In Fire Blight: History, Biology, and Management . The American Phytopathological Society. 83-108
[https://doi.org/10.1094/9780890544839.008]

- Van Der Zwet, T., & Keil, H. L. (1979). Fire blight: A bacterial disease of rosaceous plants (No. 510). US Department of Agriculture.
- VanWoerkom AH, 2012. Trunk injection: a new and innovative technique for pesticide delivery in tree fruits. Masters Thesis. Michigan State University, Ann Arbor, 150pp.
-
Zamora, M. S., & Escobar, R. F. (2000). Injector-size and the time of application affects uptake of tree trunk-injected solutions. Scientia Horticulturae, 84(1-2), 163-177.
[https://doi.org/10.1016/S0304-4238(99)00095-3]

-
Zillmer, R. E., Chaney, W. R., & Holt, H. A. (1991). Structural and biological effects of trunk injected paclobutrazol in yellow poplar. Arboriculture & Urban Forestry (AUF), 17(10), 261-268.
[https://doi.org/10.48044/jauf.1991.060]

Jae-In Lee, Department of Residue, Dongbang-agro, Researcher, https://orcid.org/0000-0002-5968-2689
Yong-Joon Choi, Department of Residue, Dongbang-agro, Senior Researcher, https://orcid.org/0009-0001-7157-1332
Eun-Seo Park, Department of Residue, Dongbang-agro, Junior Researcher
Woo-Sik Park, Department of Residue, Dongbang-agro, Junior Researcher
Tae-Yong Yun, Department of Residue, Dongbang-agro, Senior Researcher
Han-Ju Jeong, Department of Residue, Dongbang-agro, Senior Researcher
Min-Su Kang, Department of Residue, Dongbang-agro, Junior Researcher
Hyeok-Woo Nam, Department of Residue, Dongbang-agro, Junior Researcher
Kwang-Sik Kang, Department of Residue, Dongbang-agro, Principal Researcher