살균제 사용량과 기상학적 발병 위험도가 고추 탄저병균의 Fluazinam 저항성 발생 정도에 미치는 영향에 대한 혼합효과모델링 연구
초록
탄저병은 Colletotrichum 속에 의해 발생하며, 경제적으로 중요한 과일이나 채소에 심각한 피해를 일으키는 병해이다. 탄저병을 관리하기 위하여 화학 살균제가 오랜 기간 사용되어 왔으나, 이는 살균제 저항성 균주 발생이라는 새로운 문제가 발생하였다. 살균제 저항성 균주의 발생 기작을 구명하기 위한 연구가 진행되고 있지만, 아직까지 살균제 사용량과 병 발생 위험이 저항성 균주 발생에 미치는 영향에 관하여 연구된 바 없다. 본 연구에서는 데이터 기반 통계적 혼합효과모델을 활용하여, 살균제 사용량과 고추 탄저병 발생 위험도가 균사 생장 억제율에 미치는 영향을 평가하였다. 혼합효과모델을 통한 분석 결과, 저농도(0.1 ppm) 플루아지남에서의 균사 생장 억제율은 고추 탄저병 발생 위험도나 사용된 플루아지남 유효성분량에 의해 독립적으로 영향을 받지 않았다. 그러나 고추 탄저병 발생 위험도와 사용된 플루아지남 유효성분량 간 상호작용은 균사 생장 억제율에 유의미한 양의 영향을 미치는 것으로 확인되었다. 본 연구는 저항성 균주 발생에 대한 새로운 관점을 제시한다.
Abstract
Anthracnose, caused by Colletotrichum spp., is a devastating disease that occurs in and damages many economically important fruits and vegetables. To control anthracnose, several chemical fungicides have been used for an extended period, but this led to a new problem which is development of fungicide-resistant strains. Although research has been done in the past to elucidate the mechanisms of emergence of the fungicide-resistant strains, no study has been reported to-date on the influence of fungicide usage amounts and risk of disease on the occurrence of resistant strains. In the present study, the impact of fungicide (fluazinam) amount used and risk of pepper anthracnose on the mycelial growth inhibition ratio were evaluated using a data-driven statistical mixed-effects model. Results revealed that at a low concentration (0.1 ppm) of fluazinam, the mycelial growth inhibition ratio was not independently affected by the risk of pepper anthracnose or fluazinam usage amount. However, the interaction between the risk of pepper anthracnose and fluazinam usage amounts showed a significant positive impact on the growth inhibition ratio. This study provides a new perspective on the emergence of resistant strains.
Keywords:
Fluazinam, Mixed effect model, Pepper anthracnose키워드:
플루아지남, 혼합효과모델, 고추 탄저병서 론
Colletotrichum spp.에 의해 발생하는 탄저병은 전 세계의 다양한 작물에 심각한 경제적 피해를 초래하는 것으로 보고되고 있다(Bosland and Votava, 2012; Shin et al., 2022). 국내 고추 재배 농가에서도 지속적으로 탄저병이 발생하고 있으며 연간 20~30%에 달하는 수량 손실이 발생하는 것으로 알려져있다(Kim et al., 2008). 또한, Ahn et al. (2014) 이 수행한 기후변화 영향평가에 의하면 2050년대까지 국내 고추 탄저병의 발병 위험도가 지속적으로 증가할 것으로 예상되었다.
전세계적으로 고추 탄저병을 효과적으로 관리 및 방제하기 위해 오랜 기간 화학 농약이 사용되어왔다(Lamsal et al., 2011). 국내에서 고추 탄저병 방제를 위해 등록된 살균제는 총 513종으로, 이 중 피라클로스트로빈(pyraclostrobin)계열이 93종, 플루아지남(fluazinam)이 40종, 테부코나졸(tebuconazole)이 106종, 프로클로라즈(prochloraz)가 11종이다(Rural Development Administration, 2024). 페닐피리디아민(phenylpyridinamines)계열에 속하는 플루아지남은 식물 병원성 곰팡이의 미토콘드리아에서 산화적 인산화를 저해함으로써 에너지 생성 효율을 낮추어 세포 사멸을 유도하는 것으로 알려져 있다(Vitoratos, 2014). 이러한 화학 살균제의 광범위한 사용은 식물병 관리 및 방제에는 효과적이었으나, 동시에 살균제 저항성 균주 출현이라는 새로운 문제를 야기했다(Beever et al., 1989; Raposo et al., 2000). 최근까지 Colletotrichum spp. 균주에서도 살균제 저항성이 보고되었으며, 특히 methyl-benzimidazole carbamates, 퀴논 외부 저해제(QoI), 그리고 탈메틸화(demethylation) 저해제에 대한 저항성이 확인되었다(Cortaga et al., 2023). 살균제 저항성 균주의 출현 원인 중 하나는 특정 생화학적 기작에 영향을 주는 살균제를 빈번하게 사용함으로써 저항성 선택압을 증가시켰기 때문이다(Cortaga et al., 2023; Genet et al., 2006). 한편, Zhang et al. (2017) 은 고온과 아졸계 성분이 많은 환경에서 열충격으로 자낭포자 발아가 유도되며, 이는 유전자 재조합에 대한 선택압을 증가시키는 결과를 보여주었다. 이는 살균제 저항성 균주 발현에 살균제 사용량뿐 아니라 기온과 같은 환경요인도 영향을 미칠 수 있음을 나타낸다. 실제로 다양한 연구 결과로부터 포장에서의 기상환경 혹은 식물병의 발병률 정도가 살균제 저항성 균주의 발생정도에 영향을 미칠 수 있음을 추정할 수 있다(Brent and Hollomon, 1998; Hahn, 2014; Salazar-Hamm and Torres-Cruz, 2024; Van Rhijn and Bromley, 2021). 따라서, 본 연구에서는 데이터 기반 혼합효과모델(mixed effect model)을 활용하여 살균제 사용량과 기상학적 발병 위험도가 고추 탄저병균의 플루아지남 저항성 발생 정도에 미치는 영향을 구명하고자 한다.
재료 및 방법
고추 탄저병 균주 분리, 배양 및 보관
전국의 고추 재배 지역을 중심으로 2022년과 2023년의 2년간에 걸쳐서 총 164개 지점에서 고추 탄저병이 발병한 고추를 채집하였다. 고추탄저병균은 병징 상에 형성된 병원균의 포자를 단포자를 분리하였다. 고압 멸균한 이쑤시개를 이용하여 채집한 고추 열매의 병징 부위에서 분생포자를 떼어 멸균증류수(300 μg/mL의 streptomycin 첨가)에 넣고 포자 현탁액을 만들었다. 포자 현탁액의 포자 밀도를 1 × 104개/mL로 조절한 후, 300 μg/mL의 streptomycin이 첨가된 PDA 배지(potato dextrose agar; Becton, Dickinson and Company, DifcoTM)에 50 μL씩 도말한 후 25oC 배양기에서 2일간 배양하였다. 배지에 형성된 단균총을 분리하는 방법으로 병원균의 단포자를 분리하였다. 분리한 병원균은 PDA 배지에 배양하여 4oC에서 보관하며 실험에 사용하였다.
병원균의 동정
고추탄저병균의 동정을 위해서 Table 1과 같은 4개 유전자를 증폭하여 염기서열을 분석하였다. 수확한 탄저병균의 균사체를 2 mL tube에 glass beads (지름; 0.1 mm)와 함께 넣어 -70oC에서 12시간 이상 동결 건조하고 bead beater(bullet blender, NEXTADVANCE, USA)에서 마쇄하였다. Exgene Plant SV kit (ExgeneTM Plant SV, GENEALL BIOTECHNOLOGY, KOREA)를 이용하여 마쇄한 균사체에서 gDNA를 추출한 후, -20oC에서 보관하며 실험에 사용하였다. 추출한 gDNA는 nano drop (OPTIAEN NanoQ, KLAB, KOREA)를 사용해 순도와 농도를 확인하였고, 모든 gDNA는 50 ng/mL로 희석하여 실험에 이용하였다. 유전자증폭을 위하여 희석된 gDNA 2 μL, EzPCRTM 5x PCR Master Mix 4 μL, 각각의 primer 1 μL, 멸균증류수 12 μL를 혼합해 총 20 μL의 PCR 반응액을 준비하였다. 각 유전자의 영역을 증폭하기 위한 반응 조건은 94oC에서 5분간 pre-denaturation을 수행한 뒤, 94oC에서 1분간의 denaturation 단계, 1분간의 annealing 단계, 72oC에서 1분간의 extension 단계를 총 35회 반복하였고, 72oC에서 7분간의 final extension 단계를 거친 뒤 반응을 종료하였다. Annealing 온도는 각각의 primer마다 달랐으며, ACT 61oC, CHS-1 58oC, GAPDH 56oC, ITS는 55oC로 실시하였다. PCR 산물의 확인은 ITS영역의 유전자 증폭 시와 동일하였으며, ExpinTM PCR SV kit (ExpinTM PCR SV kit, GENEALL BIOTECHNOLOGY, KOREA)를 사용하여 정제한 후, Macrogen (Daejen, Korea)에 분석을 의뢰하였다. 분석한 염기서열을 가지고 MEGA X v. 11.0.10로 Construct/Test Maximum Likelihood tree로 다중 유전자 계통 분석을 실시하여 병원균을 동정하였다.
플루아지남에 대한 균사 생장 억제율 측정
살균제에 대한 효과 검정은 대량 한천희석법을 통해서 실시하였다. 플루아지남은 0.1 ppm 농도에서 Colletotrichum을 억제 효과를 보였으므로 본 연구에서는 한천희석법 수행시 플루아지남의 농도를 0.1 ppm로 설정하였다(Komyoji et al., 1995). 플루아지남(a.i. 50%, WP)을 멸균증류수에 현탁하여 최종 농도가 0.1 μg/mL가 되도록 멸균한 PDA 배지에 첨가하였다. 세균 오염을 방지하기 위해 PDA 배지에 300 μg/mL의 streptomycin을 첨가하였다. 고추탄저병균을 25oC의 P DA 배지에서 14일간 배양한 균총 선단에서 직경 3 mm의 균사 조각을 떼어 접종원으로 사용하였다. 살균제를 농도별로 첨가한 PDA 배지의 중앙에 균총 선단에서 떼어낸 균사조각의 균사면이 배지를 향하도록 뒤집어서 접종하였다. 병원균을 접종한 배지는 25oC의 암조건에서 3~4일간 배양한 후, 살균제를 첨가하지 않은 배지에서 균총의 직경이 약 30 mm 전후가 되었을 때, 직경을 조사하고, 아래 식에 의해서 살균제의 균사생장 억제율(%)을 계산하였다.
살균제 사용량 추정 방법
지역별 정확한 살균제 사용량을 정확히 파악하는 데 한계가 있지만, 다양한 데이터를 활용하여 이를 추정할 수 있다. 시군 별 고추 재배 농가의 단위 면적당 플루아지남 사용량(kg/ha 또는 L/ha)을 추정하기 위해, 2023~2024년 고추 재배 항목으로 판매된 살균제 데이터를 농촌진흥청(personal communication)을 통해 확보하였다. 본 연구에서는 살균제 판매량 데이터 중 시군구 별 플루아지남의 유효성분(kg 또는 L) 데이터를 추출하여 사용하였다. 다음으로 단위 면적 당 플루아지남 유효성분 사용량을 추정하기 위해, 2021년 시군구 별 고추 재배 면적(ha) 자료를 통계청 국가통계포털(https://kosis.kr)에서 확보하여 사용하였다. 물론 판매량이 실제 사용량과 정확히 같지는 않겠지만, 본 연구에서는 농가가 해당 연도에 구매한 모든 살균제를 사용했다고 가정하고 연구를 수행하였다.
고추 탄저병 발병 정도 추정 방법
시군 별 고추 탄저병 발병률 자료를 확보하는 것이 불가능했기 때문에, 본 연구에서는 기상조건으로부터 고추 탄저병 발병 정도를 추정하기 위하여 Ahn et al. (2008)이 개발한 병 위험도 예측모델을 사용하였다. 이 모델은 시간별 온도와 잎의 습윤 시간을 바탕으로 다양한 온도 조건에서 10%의 부착기 형성이 이루어지기 위한 누적 감염 위험도(DRS)을 계산한다(Ahn et al., 2008). 모델 구동을 위한 기상데이터(시간별 온도(oC), 강수량(mm), 및 상대 습도(%) 데이터)는 기상청에서 제공하는 500 m 격자 기반 자료를 사용하였다. 고추 탄저병 발병 정도는 2022년과 2023년의 8월 10일부터 9월 20일까지 균주가 채집된 지점을 대상으로 추정되었다. 혼합효과모델에서는 각 지역별 DRS의 최댓값을 고추 탄저병 발병 정도를 나타내는 독립변수로서 사용하였다.
혼합효과모델 개발
혼합효과모델은 고정효과와 랜덤효과를 모두 포함하는 통계 모델이다(Pinheiro and Bates, 2000). 이 모델은 데이터가 여러 그룹(예를 들어, 지역 등)에서 수집된 경우, 그룹별 특성을 고려하면서 전체적인 패턴을 추정할 수 있는 장점이 있다. 본 연구에서는 살균제 사용량과 고추 탄저병 발병 정도가 균사 생장 억제율에 미치는 영향을 조사하기 위하여 다음과 같은 혼합효과모델을 개발하였다.
GIR = β0 + β1 × DRS + β2 × FUA + β3 × DRS × FUA + Di + ε
GIR (Growth Inhibition Rate)은 0.1 μg/mL 플루아지남의 균사 생장 억제율을 의미한다. DRS (Disease Risk Score)은 지점별 고추 탄저병 발병 정도를 나타내며, FUA(Fluazinam Usage Amount)는 농가의 단위 면적 당 사용된 플루아지남 유효성분량을 나타낸다. DRS × FUA는 DRS과 FUA의 상호작용 항을 의미한다. Di는 랜덤효과를 나타내며 본 연구에서는 지역 간 차이를 반영하기 위하여 지역(시군구)를 랜덤효과로 설정하였다. β0는 모델의 절편이며, ε는 모델의 오류항을 나타낸다. 모델 개발 후 랜덤효과는 평균이 0이고 분산이 인 정규분포를 따르는 것을 확인하여 혼합효과모델의 가정에 부합함을 확인하였다.
통계 분석
본 연구결과에서 상관관계 분석을 위해 R 소프트웨어(버전3.4.1)를 사용하였다. 상관관계 분석 시 Pearson 상관계수를 확인하여 변수 간 관계를 확인하였다. 모델의 적합도를 평가하기 위하여, 실측값과 모델의 예측값이 얼마나 일치하는지 확인하였다. 평가 지표로는 결정계수(R2)를 사용하였다.
결과 및 고찰
병원균의 분리 및 동정
병든 고추를 채집한 각 포장 당 대표 균주를 1균주씩 선발하여 총 164개의 병원균을 실험에 사용하였다. 실험에 사용한 병원균을 4개의 유전자 염기서열을 가지고서 동정한 결과, 실험에 사용한 모든 고추탄저병균은 Colletotrichum scovilei로 동정되었다.
데이터의 공간 분포 조사
2022년과 2023년에 걸쳐 전국에서 채집된 균주들에 대해서 저농도(0.1 μg/mL) 플루아지남에서의 균사 생장 억제율(GIR)을 지역(시군구) 단위로 평균을 내어 조사하였다. 2022년에는 정선, 예천 등에서 채집된 균주들이 30% 미만의 억제율을 보였고, 안동, 진안, 음성에서 채집한 균주들이 50% 초과의 억제율을 보였다(Fig. 1A). 한편, 2023년에는 고창, 정읍, 임실, 괴산 등에서 20% 미만의 낮은 억제율을 보였고, 의왕, 보은, 평창, 영양 등에서는 55% 초과의 높은 억제율을 보였다(Fig. 1D). 결과적으로 2년간 채집한 균주들의 억제율은 높은 억제율부터 낮은 억제율까지 다양한 분포를 보이는 것을 확인하였다. 이러한 결과를 토대로 저농도의 플루아지남에서 균주 별 살균제에 대한 저항성 정도가 다르다는 사실을 도출하였다. 또한, 전국에서 채집한 균주들 중 약 절반의 균주들이 50% 이상의 억제율을 보이고 있음을 확인하였으므로 저농도 살균제에서의 균사 생장 억제율에 관한 모델 제작이 가능할 것이라고 판단하였다.
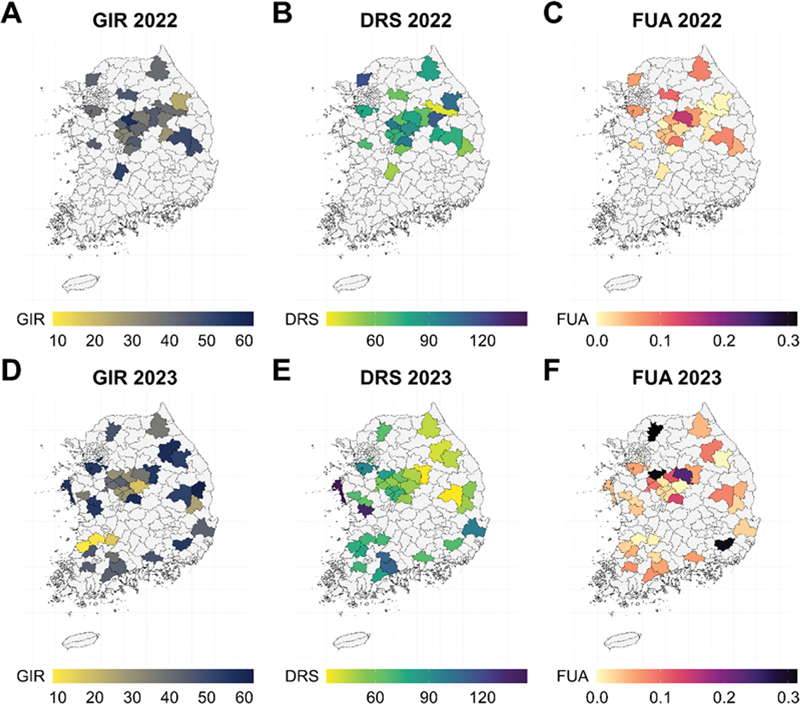
Spatial distribution of Growth Inhibition Ratio (GIR), Disease Risk Score (DRS), and Fungicide Usage Amount (FUA). (A), (B), and (C) represent data from 2022, while (D), (E), and (F) show data from 2023. (A) and (D) represent GIR data, (B) and (E) show DRS data, and (C) and (F) represent FUA data. The maps display mean values for each variable at the district (si-gun-gu) level. District not surveyed are shown in light gray.
한편, 모델을 활용해 추정한 고추 탄저병 발병 위험도(DRS)는 2022년 영월, 진안 등에서 50 미만의 낮은 수치를 보였고, 진천, 정선, 단양, 파주 등에서는 100초과의 높은 수치를 보였다(Fig. 1B). 2023년의 경우 제천, 안동 등에서는 40 이하의 낮은 수치를 보였고, 곡성, 순천, 부여, 태안 등에서는 100 이상의 높은 수치를 보였다(Fig. 1E).
2022년 농가의 단위 면적 당 사용된 플루아지남의 유효성분량(FUA)은 양평과 충주 지역 외 다른 지역에서는 0.1 kg/ha(또는 L/ha) 미만으로 추정되었다(Fig. 1C). 반면 2023년에는 총 6개 지역에서 0.1 kg/ha(또는 L/ha) 초과의 플루아지남이 사용된 것으로 보였고, 그 중 밀양, 안성, 포천 등의 지역은 0.3 kg/ha(또는 L/ha) 이상이 사용된 것으로 추정되었다(Fig. 1F).
GIR과 DRS 및 FUA와의 관계 분석
저농도의 플루아지남에서의 GIR와 FUA의 관계를 Pearson 상관관계 분석을 통해 분석하였다. 분석 결과, FUA와 GIR의 상관관계는 0.1로 상관관계가 없었다(Fig. 2A). DRS과 GIR 간 상관관계 또한 -0.04로 서로 간 상관관계가 없음을 확인할 수 있었다(Fig. 2B). 이러한 낮은 상관관계가 나온이유 중 하나는 수집한 데이터에 연구에서 고려하지 못하고 있는 노이즈가 존재하기 때문으로 생각되어진다.
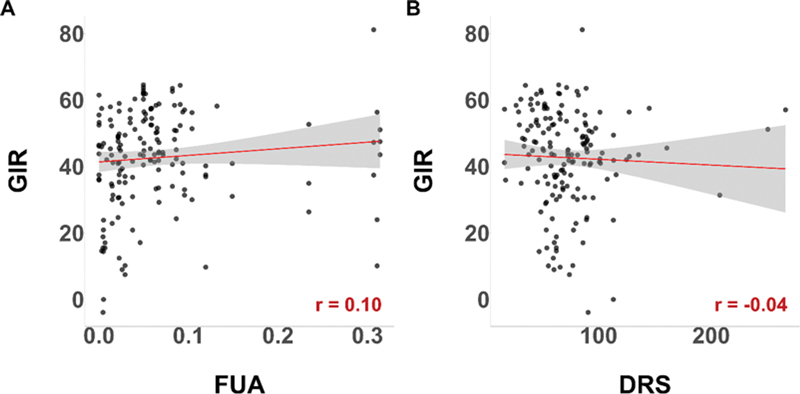
Analysis of the relationships between GIR and FUA, and GIR and DRS. (A) shows the relationship between GIR and FUA, while (B) shows the relationship between GIR and DRS using scatter plots. The red lines represent the regression equations for the two variables. r indicates the Pearson correlation coefficient.
혼합효과모델 개발 및 모델 적합도 평가
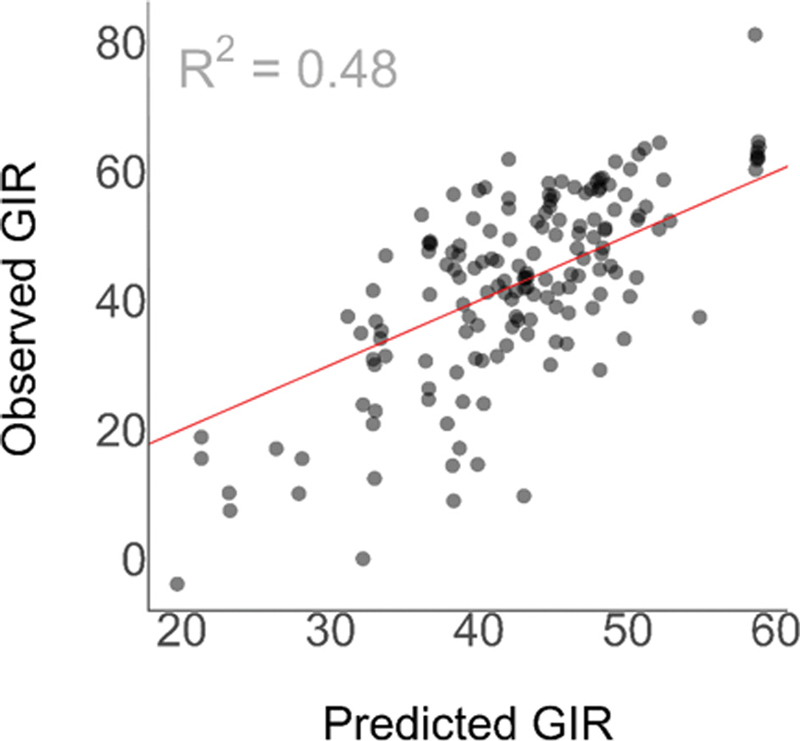
본 연구에서 활용한 균주 및 데이터는 국내 전국에서 확보한 것으로 연구에서 고려하지 못하는 지역 특이적인 효과가 존재할 수 있다고 판단하였다. 다양한 지역에 따른 효과를 추가로 고려하기 위하여 혼합효과모델을 분석에 활용하였다. 만들어진 모델의 적합도(goodness of fit)는 48% 정도로 준수한 성능을 보이는 것을 확인하였다(Fig. 3).
모델을 활용한 변수 간 관계 분석
개발된 모델을 활용하여 변수간 관계를 분석한 결과, 고추 탄저병 발병 정도(DRS)와 단위 면적 당 사용된 플루아지남의 유효성분량(FUA)은 독립적으로 균사 생장 억제율(GIR)에 유의미한 영향을 미치지 않는 것으로 나타났다(Table 2). 하지만, DRS와 FUA의 상호작용(Interaction)은 GIR에 유의미한 양의 영향을 미치는 것을 확인하였다(Table 2). 균사 생장 억제율(GIR)과 살균제 내성과는 음의 관계를 가지므로, 살균제 내성은 DRS과 FUA의 상호작용과 음의 관계를 가질 것으로 생각되어진다. 즉, 고추 탄저병 발병률이 낮았을 때 살균제 사용량이 증가한다면 저농도에 대한 살균제 내성 균주 발생 가능성이 높아질 수 있다고 해석할 수 있다. 또한, 고추 탄저병 발병률이 낮았을 때 살균제 사용량이 감소한다면 살균제 내성 균주 발생 가능성도 같이 낮아질 수 있음을 시사한다. 흥미로운 점은 살균제 사용량이 높더라도 고추 탄저병 발병률이 높다면 살균제 내성 균주 발생 비율이 낮아질 수도 있다는 점이다. 실제로 본 연구에서 조사된 데이터에 의하면, 2023년 안성의 살균제 사용량은 2년간 조사된 지점 중 2번째로 많은 량의 살균제가 살포되었지만 발병률이 매우 높았고 균사 생장 억제율은 50% 이상의 높은 억제율을 보이며 낮은 살균제 내성을 보였다.
결 론
플루아지남이 작용하는 부위는 multisite이므로, 단일 site인 다른 살균제 등에 비교하였을 때 상대적으로 저항성 발생 가능성이 낮다고 여겨진다(Gisi and Sierotzki, 2008). 그럼에도 불구하고 일부 식물 병원균에서는 플루아지남에 대한 저항성 균주가 드물게 보고된 바 있다(Leroux et al., 2007; Li et al., 2020). 지금까지 국내 고추 탄저병원균 중 플루아지남 저항성 균주는 없는 것으로 알려져 있다. 하지만 우리는 저농도의 플루아지남에서 균주 별로 균사 생장억제율에 차이가 발생하기 시작되었다는 것을 알 수 있었으며, 이에 플루아지남 내성 균주 발생 기작을 혼합효과모델을 활용하여 이해하고자 하였다. 모델을 활용한 분석 결과, 저농도에 대한 플루아지남 내성 균주는 살균제 사용량과 탄저병 발병 정도의 복합적인 영향을 받는 것으로 나타났다.
일반적으로 살균제 사용량은 저항성 균주 비율을 높이는 것으로 알려져 있다(Cortaga et al., 2023). 그러나 본 연구에서 제시한 모델은 이러한 생태적 특성을 반영하지 못하고 있는데(Table 2), 이러한 결과가 도출된 원인 중 하나는 본 연구에서 활용되고 있는 데이터의 한계로 생각된다. 연구에 활용된 살균제 사용량 데이터는 샘플이 채집된 지점 특이적인 데이터가 아닌 더 큰 범위(시군구 단위)에서 조사된 데이터이므로 지점 특이적인 미세한 변동을 모두 반영하기에 한계가 있었을 것으로 생각되어진다.
본 연구는 엄밀하게 통제된 실험 조건에서 수행된 연구가 아닌 관측 데이터에 기반한 연구이지만, 이러한 연구는 경제학 및 생태학 등 다양한 분야에서 독립변수와 종속변수의 관계를 파악할 때 널리 사용되는 방식이다(Jeong et al., 2014; Jiménez et al., 2016; Shah et al., 2019). 나아가 고추탄저병균의 저항성 발생에 탄저병 발병과 살균제 사용량이 상호작용하여 영향을 미칠 수도 있다는 새로운 시각을 제시하였다는 점에서 의의가 있다. 본 연구를 기반으로 통제된 실험 등을 통한 추가적인 연구가 진행되어 이 관계에 대해 명확히 구명된다면, 살균제 저항성 균주 발생 방지를 위한 전략 수립에 활용 가치가 있을 것으로 사료된다.
Acknowledgments
본 연구는 농촌진흥청의 연구과제(RS-2022-RD010350)의 지원으로 수행되었습니다.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
-
Ahn MI, Kang WS, Park EW, Yun SC, 2008. Validation of an anthracnose forecaster to schedule fungicide spraying for pepper. Plant Pathol. J. 24(1):46-51.
[https://doi.org/10.5423/PPJ.2008.24.1.046]

- Ahn MI, Kim SK, Han YK, Shin YS, Kim GH, 2014. Evaluation of climate change impact on pepper anthracnose according to RCP 4.5 & 8.5 scenario. Proceedings of The Korean Society of Agricultural and Forest Meteorology Conference 168-172.
-
Beever RE, Laracy EP, Pak HA, 1989. Strains of Botrytis cinerea resistant to dicarboximide and benzimidazole fungicides in New Zealand vineyards. Plant Pathol. 38(3): 427-437.
[https://doi.org/10.1111/j.1365-3059.1989.tb02163.x]

-
Bosland PW, Votava EJ, 2012. Peppers: Vegetable and spice capsicums (2nd ed.). CABI.
[https://doi.org/10.1079/9781845938253.0000]

- Brent KJ, Hollomon DW, 1998. Fungicide resistance: The assessment of risk (Vol. 2). Global Crop Protection Federation Brussels, Belgium: Global Crop Protection Federation.
-
Cortaga CQ, Cordez BWP, Dacones LS, Balendres MAO, Dela Cueva FM, 2023. Mutations associated with fungicide resistance in Colletotrichum species: A Review. Phytoparasitica 51(3):569-592.
[https://doi.org/10.1007/s12600-023-01063-0]

-
Genet J, Jaworska G, Deparis F, 2006. Effect of dose rate and mixtures of fungicides on selection for QoI resistance in populations of Plasmopara viticola. Pest Manag. Sci. 62(2):188-194.
[https://doi.org/10.1002/ps.1146]

-
Gisi U, Sierotzki H, 2008. Fungicide modes of action and resistance in downy mildews. Eur. J. Plant Pathol. 122:157-167.
[https://doi.org/10.1007/s10658-008-9290-5]

-
Hahn M, 2014. The rising threat of fungicide resistance in plant pathogenic fungi: Botrytis as a case study. J. Chem. Biol. 7(4):133-141.
[https://doi.org/10.1007/s12154-014-0113-1]

-
Jeong HK, Kim CG, Moon DH, 2014. An Analysis of impacts of climate change on rice damage occurrence by insect pests and disease. Korean J. Environ. Agricul. 33(1):52-56. (In Korean)
[https://doi.org/10.5338/KJEA.2014.33.1.52]

-
Jiménez D, Dorado H, Cock J, Prager SD, Delerce S, et al., 2016. From observation to information: Data-driven understanding of on farm yield variation. PloS One, 11(3): e0150015.
[https://doi.org/10.1371/journal.pone.0150015]

-
Kim JT, Park SY, Choi W, Lee YH, Kim HT, 2008. Characterization of Colletotrichum isolates causing anthracnose of pepper in Korea. Plant Pathol. J. 24(1):17-23.
[https://doi.org/10.5423/PPJ.2008.24.1.017]

-
Komyoji T, Sugimoto K, Mitani S, Matsuo N, Kazumi S, 1995. Biological properties of a new fungicide, fluazinam. J. Pesticide Sci. 20:129-135.
[https://doi.org/10.1584/jpestics.20.129]

-
Lamsal K, Kim SW, Jung JH, Kim YS, Kim KS, et al., 2011. Application of silver nanoparticles for the control of Colletotrichum species in vitro and pepper anthracnose disease in field. Mycobiology 39(3):194-199.
[https://doi.org/10.5941/MYCO.2011.39.3.194]

-
Leroux P, 2007. Chemical control of Botrytis and its resistance to chemical fungicides. pp. 195-222. In : Elad Y, Williamson B, Tudzynski P, Delen N. Botrytis: Biology, Pathology and Control. Springer.
[https://doi.org/10.1007/978-1-4020-2626-3_12]

-
Li T, Xiu Q, Zhang J, Wang JX, Duan YB, et al., 2020. Pharmacological characteristics and efficacy of fluazinam against Corynespora cassiicola, causing cucumber target spot in greenhouses. Plant Dis. 104(9):2449-2454.
[https://doi.org/10.1094/PDIS-12-19-2649-RE]

-
Pinheiro JC, Bates DM, 2000. Linear mixed-effects models: basic concepts and examples. Mixed-Effects Models in S and S-PLUS, 3-56.
[https://doi.org/10.1007/978-1-4419-0318-1_1]

-
Raposo R, Gomez V, Urrutia T, Melgarejo P, 2000. Fitness of Botrytis cinerea associated with dicarboximide resistance. Phytopathology 90(11):1246-1249.
[https://doi.org/10.1094/PHYTO.2000.90.11.1246]

- Rural Development Administration, 2024. Pesticide Safety Information System. https://psis.rda.go.kr/psis/index.ps, (Accessed Nov. 13. 2024).
-
Salazar-Hamm P, Torres-Cruz TJ, 2024. The impact of climate change on human fungal pathogen distribution and disease incidence. Curr. Clin. Microbiol. Rep. 11(3):140-152.
[https://doi.org/10.1007/s40588-024-00224-x]

-
Shah DA, Paul PA, De Wolf ED, Madden LV, 2019. Predicting plant disease epidemics from functionally represented weather series. Philos. Trans. R. Soc. Lond. B Biol. Sci. 374(1775):20180273.
[https://doi.org/10.1098/rstb.2018.0273]

-
Shin JH, Kim HY, Fu T, Lee KH, Kim KS, 2022. CsPOM1, a DYRK family kinase, plays diverse roles in fungal development, virulence, and stress tolerance in the anthracnose pathogen Colletotrichum scovillei. Front. Cell. Infect. Microbiol. 12:861915.
[https://doi.org/10.3389/fcimb.2022.861915]

-
Van Rhijn N, Bromley M, 2021. The consequences of our changing environment on life threatening and debilitating fungal diseases in humans. J. Fungi 7(5):367.
[https://doi.org/10.3390/jof7050367]

-
Vitoratos AG, 2014. Mode of action and genetic analysis of resistance to fluazinam in Ustilago maydis. J. Phytopathol. 162(11-12):737-746.
[https://doi.org/10.1111/jph.12254]

-
Zhang J, Snelders E, Zwaan BJ, Schoustra SE, Meis JF, et al., 2017. A novel environmental azole resistance mutation in Aspergillus fumigatus and a possible role of sexual reproduction in its emergence. mBio 8(3):e00791-17.
[https://doi.org/10.1128/mBio.00791-17]

Noh-Hyun Lee, Department of Agricultural Biotechnology, College of Agriculture and Life Sciences, Seoul National University, Graduate student (Ph.D. course), https://orcid.org/0000-0003-4815-6912 Experimental participation and writing original paper
Hyeon-Deok Kang, Department of Applied Biology and Chemistry, College of Agriculture and Life Sciences, Seoul National University, Undergraduate student, Experimental participation
An Sohyeon, Department of Plant Medicine, College of Agriculture, Life and Environment Science, Chungbuk National University, Graduate student (Master’s course), https://orcid.org/0000-0001-5622-8627 Experimental participation
Heung Tae Kim, Department of Plant Medicine, College of Agriculture, Life and Environment Science, Chungbuk National University, Professor, https://orcid.org/0000-0001-7132-0587 Analysis of data, writing original paper and editing
Kwang-Hyung Kim, Department of Agricultural Biotechnology, College of Agriculture and Life Sciences, Seoul National University, Professor, https://orcid.org/0000-0001-0607-1964 Establishment of experimental plan and methodology proposal