
고추 역병과 탄저병에 대한 인산염 화합물의 방제 효과
초록
6종의 인산염 화합물을 선발하여 고추 역병균 P. capsici JHAW 1-2와 탄저병균 C. acutatum JC24에 대한 항균활성 및 역병과 탄저병에 대한 방제효과를 조사하였다. 실험한 6종의 인산염 화합물은 고추 탄저병균보다는 역병균에 대한 항균활성이 더 우수하였다. 역병균에 대해서도 균사생장에 대한 억제효과보다는 P. capsici JHAW 1-2의 유주포자 나출, 유주포자낭 발아, 유주포자 발아 등에 대한 억제효과가 우수하였다. 6종의 인산염 화합물 중에서는 P. capsici JHAW 1-2에 대해서 H3PO3와 H3PO4가 가장 우수한 항균활성을 보였다. 유묘와 열매를 가지고서 실시한 병 방제 효과 검정에서도 실험에 사용한 6종의 인산염 화합물은 탄저병보다는 역병에 대한 방제효과가 우수하였다. H3PO3를 고추 유묘에 100 μg mL−1의 농도로 관주처리하였을 때에는 약해가 발생하여 유묘가 고사하였지만, 10 μg mL−1의 농도를 관주처리하였을 때는 100% 방제효과를 보였다. 하지만 H3PO4는 우수한 항균활성을 보였음에도 불구하고 100 μg mL−1의 농도에서조차 56.7%로 효과가 낮았다. C. acutatum JC24를 고추 열매에 상처와 무상처 접종하며 인산염의 병방제 효가를 조사하였다. 6종의 화합물 중에서 H3PO3와 H3PO4의 100 μg mL−1의 처리구에서만 70% 이상의 효과를 보였을 뿐 다른 처리구에서의 효과는 미미하거나 인정할 수 없었다.
Abstract
Antimicrobial activity of 6 phosphate compounds as H3PO3, H3PO4, K3PO4, K2HPO4, KH2PO4 and NH4H2PO4 against Phytophthora capsici JHAW 1-2 and Colletotrichum acutatum JC24 was investigated in this study. Inhibitory effect on zoospore release, zoosporangia germination and zoospore germination was superior than mycelial growth. Among 6 compounds, H3PO3 and H3PO4 showed the best antimicrobial activity against P. capsici JHAW 1-2. Diseases controlling activity of the phosphate compounds tested on seedling and fruit of pepper against Phytophthora blight was also better than those against anthracnose. When H3PO3 was applied to the pepper seedlings at a concentration of 100 μg mL−1, severe phytotoxicity was occurred. However, with applying 10 μg mL−1 of H3PO3 showed 100% the disease control efficacy. In case of 100 μg mL−1 H3PO4 application showed excellent antimicrobial activity against P. capsici JHAW 1-2, and 56.7% of the disease control efficacy with no phytotoxicity. To investigate the control efficacy against anthracnose, conidia suspension was inoculated with non-wound and wound inoculation method on pepper fruit. Among 6 compounds, only 100 μg mL−1 of H3PO3 and H3PO4 had a activity of more than 70%, but the control activity on other treatments was minimal or unacceptable.
Keywords:
Anthracnose, Pepper, Phosphate compounds, Phytophthora blight키워드:
고추, 인산염 화합물, 역병, 탄저병서 론
고추는 국내에서 재배되는 채소작물 중에서 생산액이 가장 높은 중요한 작물이지만, 재배 작기가 길기 때문에 여러 가지 병이 발생하고, 이런 다양한 병해에 의해서 고추 생산량이 위협 받기도 한다. 그 중에서도 중요한 병은 역병과 탄저병인데, 농가 현장에서는 이들을 방제하기 위해서 살균제를 사용하는 화학적 방제가 일반적으로 행해지고 있다. 고추 탄저병의 경우 최근 몇 년간은 강수량과 강우일수가 적어서 전국적으로 병 발생이 적었지만, 병이 발생하게 되면 방제하기 어려운 상황이 닥칠 수도 있다는 불안감이 현장에서 살균제를 과용하는 원인이 될 수도 있다. 하지만 소비자들의 안전한 친환경 농산물에 대한 관심도가 높아지고, 포장에서 살균제 저항성균이 발생하면서 화학 살균제를 사용하여 탄저병을 방제하는 것이 어려워지고 있다. 역병의 경우는 저항성 품종을 재배하면서 피해를 크게 줄이고 있지만, 고추 품질이 저하하는 문제 때문에 일부 농가에서는 여전히 감수성 품종 재배를 고집하는 경우도 있다.
소비자들의 요구와 농산물 생산의 주요한 목표가 생산량의 증대에서 안전한 농산물의 생산과 고품질 농산물에 대한 공급으로 변화되기 시작하면, 기존의 방제 방법을 대체하거나 상호보완적인 관계에서 사용할 수 있는 방제 방법의 개발이 필요하게 된다. 특히 친환경 재배를 하면서 고추 생산량을 유지하기 위해서는 토양의 개선과 저항성 품종의 개발 등이 기본적으로 갖추어져야 하는 요건이지만, 더불어 재배 기간 중에 발생하는 병해를 제어할 수 있는 병 방제용 친환경자재의 개발이 필요하다. 친환경 자재를 개발하기 위해서 다양한 유용미생물, 식물 추출물, 무기염류 등의 병해 방제효과에 대한 많은 연구가 진행되어 왔다(Park et al., 2012).
특히 무기염류의 식물병에 대한 효과 검정 실험이 많이 진행되어 있는데, 34종의 무기화합물이 35종의 작물에서 문제가 되는 49종의 식물진균병에 대해 효과가 있다(Deliopoulos et al., 2010). 실제 인산염과 중탄산염은 밀의 지상부 병, Septoria 점무늬병, 흰가루병 등에 대해서 우수한 방제효과를 보인다(Kettlewell et al., 1992; Ziv and Zitter, 1992; Mann et al., 2004; Mitchell and Walters, 2004). 규소 역시 식물병 방제효과가 있다. Anderson et al. (2004)은 아보카도 탄저병을 방제하기 위해 규소를 나무에 주입하고 아보카도 열매를 분석한 결과, Mn이 높은 수준으로 축적되었다. Mn은 리그닌과 페놀을 합성하는데 주요한 보조인자로 작용할 뿐만 아니라, 식물병원성 진균의 펙틴분해효소 생성을 억제하여 식물병을 방제한다(Fawe et al., 1998). Bekker et al. (2006)도 식물체에 규소를 처리한 결과, 항균성 대사산물이 합성되어, 기주식물이 병원균에 대해서 저항성을 가지게 된다고 보고하였다. 무기염 중에 하나인 인산은 세포 분열과 뿌리의 초기 생육을 촉진하는 중요한 원소 중의 하나이다(Deliopoulos et al., 2010). 또한 인은 세포 내에서 에너지 전달 과정에서 중요한 역할을 할 뿐만 아니라 ATP, 핵산, 조효소, 인지질 등을 구성하는 성분으로서 역할도 담당하고 있다. 인산을 처리하게 되면 식물에서 전신유도저항성이 발현되어 병원균에 대한 방어 기작이 나타날 뿐만 아니라(Hammerschmidt, 1999), 식물병원균의 생장과 분화에 영향을 미치기도 한다(Walters and Bingham, 2007). 인산염 화합물인 K3PO4, K2HPO4, KH2PO4은 포도, 망고, 복숭아 등에 처리하여 흰가루병을 방제하기도 하였다(Reuveni and Reuveni, 1995a; 1995b; 1998). 이처럼 무기염은 처리하는 농도를 일정하게 맞출 수 있고, 비교적 균일한 효과를 나타낼 수 있는 장점을 지니고 있기 때문에, 살균제를 대신해서 식물병을 방제할 수 있는 친환경 자재로 개발할 수 있는 가능성이 크다.
따라서 본 연구에서는 무기염류 중에 하나인 인산염 화합물을 사용하여 고추 역병균과 탄저병균의 생장에 미치는 항균활성과 역병과 탄저병에 대한 방제효과를 조사하여, 포장에서 사용 가능성을 알아보고자 하였다.
재료 및 방법
실험에 사용한 병원균과 병원균의 포자 형성
병든 고추에서 고추 역병균(Phytophthora capsici JHAW1-2)과 고추 탄저병균(Colletotrichum acutatum JC24)을 단포자 분리하여 실험에 사용하였다. 고추 역병균은 20oC의 V8-juice 배지(V8-juice, 200 mL; CaCO3, 1 g; agar, 17 g; 증류수, 1 L)에 5일간 배양하였으며, 고추 탄저병균은 균사 조각을 PDA (potato starch, 4 g; dextrose, 20 g; agar, 15 g; 증류수, 1 L)) 배지에 접종하여 25oC에서 7일간 배양한 후, 실험에 사용하였다. P. capsici JHAW1-2의 유주자낭을 얻기 위해 병원균을 Oatmeal 배지(oatmeal, 60 g; agar, 12.5 g; 증류수, 1 L)에 접종하여 20oC에서 7일간 배양하였다. 멸균한 시약 스푼으로 병원균의 공중균사를 제거하고 2일간 광을 조사한 후 형성된 유주포자낭을 멸균 증류수로 수확하여 실험에 사용하였다. C. acutatum JC24의 분생포자는 25oC의 PDA에서 10일간 배양한 병원균의 균총 표면에 형성된 분생포자를 수확하여 사용하였다.
고추 역병균과 탄저병균의 균사생장 억제효과 검정
실험에 사용한 인산염 화합물의 최종 농도가 각각 100, 10, 1, 0.1, 0.01, 0,001 mM 이 되도록 조절하여 배지에 첨가하고, 병원균의 균사선단에서 떼어낸 균사조각(직경 3 mm)을 균사 면이 아래로 가도록 뒤집어서 접종하였다. 이때 PDA배지에는 세균의 오염을 방지하기 위해서 300 μg mL−1의 streptomycin을 첨가하였다. 병원균을 접종한 배지는 C. acutatum JC24의 경우 25oC의 암조건에서 7일간 배양 후 균사의 직경을 조사하였고, P. capsici JHAW 1-2는 20oC에서 5일간 배양한 다음 균사의 직경을 조사하였다.
고추 역병균의 유주포자 나출, 유주포자낭 발아와 유주포자 발아에 미치는 효과 검정
멸균증류수를 Oatmeal 배지에 부어 수확한 현탁액에서 유주포자낭의 밀도는 5 × 104개 mL−1로 조절하였으며, 인산염 화합물은 최종 농도가 각각 100, 10, 1 mM이 되도록 처리하였다. 모든 처리는 3반복으로 실시하였으며 반복 당 150개의 유주포자낭 혹은 유주포자를 조사하였다.
유주포자의 나출율을 조사하기 위해서 인산염 화합물을 정해진 농도로 처리한 유주포자낭의 현탁액을 멸균한 slide glass에 50 μL씩 점적한 후 습실처리한 상태로 4oC에서 한 시간, 25oC에서 30분 동안 보관하였다. 유주포자 나출률을 조사하기 위해서 광학현미경으로 반복 당 150개의 유주포 자낭을 관찰하였다. 유주포자낭 150개 당 유주포자가 나출된 유주포자낭의 수를 조사하여 유주포자 나출률을 구하였다. 유주포자낭의 직접 발아에 미치는 효과를 알아보기 위해서, 유주포자낭의 현탁액을 점적한 slide glass를 25oC에서 4시간 보관한 다음, 현미경으로 반복 당 150개의 유주포자를 관찰하여 발아율을 조사하였다. 유주포자의 발아율을 조사하기 위해서 수확한 유주포자낭을 4oC에서 한 시간, 25oC에서 30분 동안 처리하여 유주포자를 나출 시켰다. 멸균된 거즈에 현탁액을 여과하여 빈 유주포자낭을 제거하고, 1분간 교반하여 유주포자의 편모를 제거하였다. 유주포자현탁액에 인산염 화합물을 위와 동일한 농도가 되도록 처리하고 slide glass에 50 μL씩 점적 후, 25oC에서 4시간 배양하여 발아한 유주포자의 수를 조사하였다.
고추 탄저병균의 포자발아 억제효과 검정
멸균한 여과지를 페트리 접시에 깔고 멸균증류수를 2 mL씩 부어 습실처리를 한 다음, 그 위에 멸균한 셀로판막(가로× 세로 2 × 2 cm)을 올려놓았다. PDA 배지에서 수확한 병원균 현탁액의 포자 밀도를 1 × 106개 mL−1로 조절한 다음, 앞의 실험과 동일한 농도로 인산염 화합물을 처리하였다. 인산염 화합물을 처리한 포자현탁액은 한 개의 셀로판막 위에 60 μL씩 점적하고, 25oC에서 12시간 배양하였다. 실험에서 모든 처리는 3반복으로 실시하였으며, 반복 당 150개의 포자를 현미경으로 조사하여 발아율을 구하였다.
고추 역병 방제 효과 검정
실온에서 최아 시킨 고추 종자를 연결폿트에 파종하여 3엽기까지 재배한 후, 새로운 폿트(직경 7 cm, 높이 6.5 cm)에 정식하여 5엽기까지 재배한 후, 실험에 사용하였다. 고추 품종은 왕대박을 사용하였다. 인산염 화합물의 병 방제 효과를 조사하기 위해서, 각 용액의 농도를 100, 10, 1 mM로 조절하여 토양에 10 mL씩 관주처리하였다. 병원균의 접종원은 화합물을 토양에 관주처리하고 1일 후에, 역병균의 유주포자낭에서 유주포자를 나출시켜 토양에 관주하여 접종하였다. 접종원의 준비를 위해서 oatmeal 배지에서 수확한 P. capsici JHAW 1-2의 유주포자낭 현탁액에서 유주포자낭의 밀도를 1 × 104개 mL−1로 조절한 후, 4oC에서 한 시간 그리고 25oC에서 다시 30분간 처리하여 유주포자낭으로부터 유주포자를 나출시켰다. 고추를 재배한 각 폿트에 유주포자 현탁액을 10 mL씩 토양에 관주 접종하였으며, 접종한 고추 재배 폿트는 온실에서 저면관수하면서 병이 발생하도록 관리하였다. 병 조사는 병원균을 접종하고 5일 후부터 조사하기 시작하여 10일 후까지 조사하였다. 실험의 모든 처리의 반복에는 고추유묘를 10주씩 사용하였다.
고추 탄저병 방제 효과 검정
고추 열매는 온실에서 재배한 녹광 품종의 푸른 열매를 사용하였다. 실험에 사용한 인산염 화합물의 농도를 100, 10, 1 mM로 조절하여 고추 열매에 분무처리하고 1일간 상온에서 풍건하였다. 접종원은 25oC의 PDA배지에서 10일간 배양한 병원균의 균총으로부터 수확한 분생포자를 사용하였다. 접종원 현탁액에서 분생포자 밀도는 1 × 106개 mL−1로 조절하였으며, 고추 열매에는 무상처 또는 상처 접종하였다. 병원균을 무상처 접종하기 위해서 미리 준비한 탄저병균의 분생포자 현탁액을 분무하여 접종하였다. 상처 접종의 경우에는 혈당측정용 바늘을 이용하여 열매 표면에 상처를 내고 준비한 분생포자 현탁액을 5 μL씩 상처 위에 점적하여 접종하였다. 접종한 고추 열매는 탄저병 발생을 유도하기 위해 바닥에 두 겹의 종이타올을 깔고 100 mL의 증류수를 부은 플라스틱 상자(가로 28 cm, 세로 22 cm, 높이 8 cm)에 넣고, 포화습도를 유지하기 위해서 뚜껑을 덮어 25oC에서 보관하였다. 접종한 고추 열매는 5일간 습실처리 하였고 상자의 뚜껑을 열어 5일간을 더 보관하면서 열매에 형성된 병반 면적을 조사하였다. 상처 접종의 경우에는 상처로부터 형성된 병반의 장경을 측정하였으며, 무상처 접종의 경우에는 열매 표면에 형성된 병반을 발병 지수로 조사하였다.
통계 분석
본 실험은 3반복 실험을 통하여 얻어진 결과를 SAS ver. 9.3(SAS Institute Inc., Cary, NC, USA) 통계프로그램을 사용하여 분석하였다.
결과 및 고찰
인산염 화합물의 고추 역병균과 탄저병균의 균사생장 억제효과
실험한 인산염 화합물 중에서 H3PO3와 H3PO4가 역병균인 P. capsici JHAW 1-2에 대한 균사생장 억제효과가 가장 우수하였다(Fig. 1). 두 화합물 모두 100 μg mL−1의 농도에서는 100% 균사 생장을 억제하였으며, 10 μg mL−1의 농도에서도 각각 93.9%와 86.1%의 효과가 있었다. 이 두 화합물은 탄저병균인 C. acutatum JC24에 대해서도 동등한 효과를 나타내고 있는데, 10 μg mL−1의 농도에서 82.5%와 76.4%의 효과를 보였다. K3PO4는 10 μg mL−1 처리구에서 P. capsici JHAW 1-2에 대한 효과는 전혀 없었으며 C. acutatum JC24에 대해서도 20.4%의 저조한 효과를 보였지만, 100 μg mL−1에서는 두 병원균에 대해서 각각 89.9%와 100%로 효과가 급등하였다. 하지만 나머지 3가지 화합물인 K2HPO4, KH2PO4, NH4H2PO4는 두 병원균에 대한 균사생장 억제효과가 매우 미미하였다.
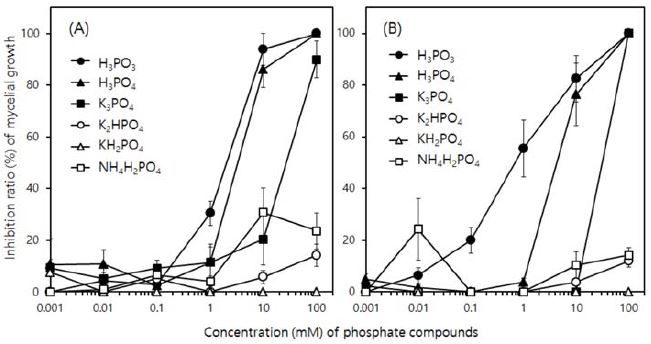
Effect of phosphate compounds on the mycelial growth of Phytophthora capsici JHAW 1-2 causing Phytophthora blight (A) and Colletotrichum acutatum JC24 causing anthracnose of pepper (B) on PDA medium. The colony diameter of P. capsici JHAW 1-2 and C. acutatum JC24 were investigated 5 and 7 days after incubation at 20 and 25oC, respectively. The inhibition ratio (%) of mycelial growth was obtained by calculating the ratio of the colony diameter on PDA amended with each phosphate compound by that on PDA without any phosphate compound. Bars are the standard deviation.
고추 역병균의 유주포자 나출, 유주포자낭 발아 및 유주포자 발아에 대한 인산염 화합물의 억제효과
H3PO3는 고추 역병균의 유주포자 나출, 유주포자낭 발아, 유주포자 발아에 대한 억제효과가 아주 우수하였다(Fig. 2). 역병균은 기주식물을 침입할 때 온도에 따라서 유주포자낭이 직접 발아하는 형태와 유주포자를 나출하여 유주포자가 발아하여 침입하는 두 가지 형태의 침입 양상을 보인다. 두 가지 침입 양상에 대한 H3PO3의 효과를 알아보기 위해서 1 mM을 처리한 경우, P. capsici JHAW 1-2의 유주포자 나출과 유주포자낭 발아는 85.5%와 72.5%가 억제되었으나, 유주포자 발아는 27.5% 억제하였다. H3PO3를 처리하였을 때 유주포자 발아에 대한 억제효과가 저조하였으나, 유주포자낭으로부터 유주포자의 나출이 이미 85.5%로 억제되기 때문에, H3PO3는 고추 역병균인 P. capsici JHAW 1-2가 기주식물을 침입하는 단계의 두 가지 형태를 모두 억제할 수 있는 화합물임을 알 수 있다. H3PO4도 P. capsici JHAW 1-2의 유주포자 나출, 유주포자낭 발아, 그리고 유주포자 발아를 H3PO3의 수준으로 억제하였다. K3PO4 역시 10 mM의 처리구에서는 역병균의 모든 침입 기구를 H3PO3과 H3PO4과 같이 90% 이상 억제하였지만, 1 mM의 처리구에서는 두 화합물에 비하여 효과가 감소하여, 유주포자낭 발아는 억제하지 못하였으며, 유주포자 나출과 유주포자 발아도 각각 49.4%와 10.5% 억제하는 수준에서 그쳤다. KH2PO4와 K2HPO4 그리고 NH4H2PO4는 처리하는 농도가 감소함에 따라 P. capsici JHAW 1-2의 유주포자 나출, 유주포자낭 발아, 유주포자 발아에 대한 효과가 현저히 감소하였다. 실험에 사용한 6가지의 인산염 화합물은 공통적으로 유주포자 발아에 대한 억제효과가 유주포자 나출과 유주포자낭의 발아에 대한 효과보다 낮은 경향을 보였다. 또한 Fig. 1에서 보는 것과 같이 동일한 처리 농도에서 균사생장에 대한 효과가 낮은 것을 보면, 인산염 화합물을 고추 역병에 사용하기 위해서는 병원균이 기주식물을 침입하는 초기 단계에 예방적인 처리로 사용하는 것이 우수한 효과를 얻을 수 있을 것으로 생각한다.
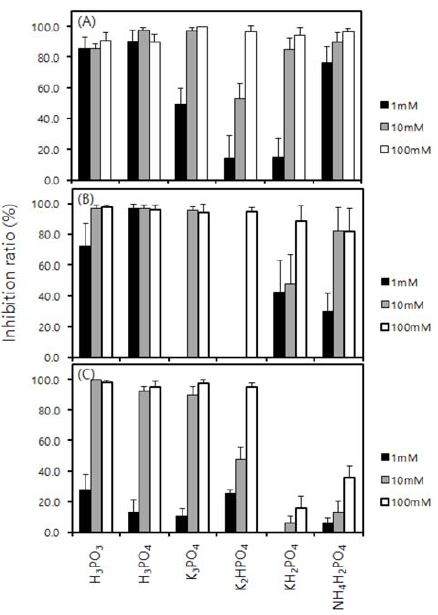
Inhibition ration of phosphate compounds against zoospore release from zoosporangium (A), zoosporangium germination (B) and zoospore germination (C) of Phytophthora capsici JHAW 1-2. The density of zoosporangium was adjusted to 1 × 104 zoosporangia mL−1 in zoosporangia suspension. Zoospores were released from the zoosporangium by keeping at 4oC for 1 hour and at 25oC for 30 minutes continuously. Bars are the standard deviation.
고추 탄저병균의 포자발아 억제효과
인산염 화합물의 고추 역병균 P. capsici JHAW 1-2에 대한 효과와 고추 탄저병균 C. acutatum JC24에 대한 효과를 비교하면, 균사생장에 대한 억제효과는 비슷하면서 포자에 미치는 효과는 차이가 있었다. Fig. 3에서 보는 것과 같이 H3PO3를 제외한 나머지 화합물 중에서 H3PO4와 K3PO4만이 100 mM의 높은 농도에서 97.8%의 효과가 있었을 뿐, 나머지 화합물들에서는 거의 효과가 나타나지 않았다. 역병균에서는 H3PO3와 대등한 효과를 보이던 H3PO4도 포자발아를 억제하는 효과가 많이 감소하였다.
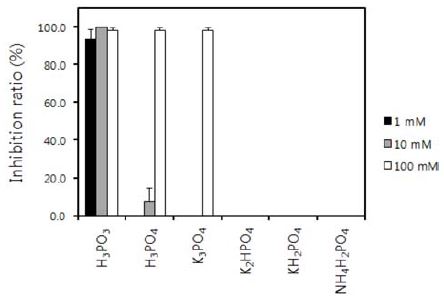
Inhibition ratio (%) of phosphate compounds against the conidial germination of Colletotrichum acutatum JC24 causing pepper anthracnose on a cellophane membrane. The density of conidia in the suspension was adjusted to 1 × 106 conidia mL−1. Each compound was treated into the conidial suspension to the indicated concentrations. After incubation for 12 hrs, conidial germination was investigated under a light microscope. Bars are the standard deviation.
고추 역병과 탄저병 방제 효과
H3PO3를 처리하였을 때 고추 역병에 대한 방제효과가 가장 우수하였다(Table 2). H3PO3를 10 mM과 1 mM의 농도로 처리할 경우 고추 유묘에서 역병을 각각 100%와 60% 방제할 수 있었지만, 100 mM의 농도를 토양에 관주하였을 때에는 고추 유묘의 지제부가 하얗게 변하는 약해 증상이 나타나며 결국 유묘는 고사하였다. 역병균인 P. capsici JHAW 1-2의 균사생장과 유주포자낭의 생장에 대해서 H3PO3만큼 우수한 효과를 보였던 H3PO4는 유묘를 사용한 온실 검정에서 100 mM 처리구에서 조차 56.7%의 효과만을 보였으나, K3PO4, K2HPO4, KH2PO4는 병원균에 대한 억제효과는 크지 않았으나, 병 방제효과는 H3PO3 다음으로 우수하였다. 하지만 대부분의 인산염 화합물은 고추 탄저병에 대한 방제효과는 역병 방제효과에 비하여 많이 떨어지는 것으로 나타났다. 인산염 화합물을 열매에 처리하고 C. acutatum JC24를 무상처 또는 상처 접종할 경우 H3PO3와 H3PO4의 100 mM 처리구에서만 70% 이상의 효과를 보였을 뿐, 다른 모든 처리 농도에서 50% 이하의 낮은 효과를 보이거나, 전혀 효과가 없었다.

Controlling activity of phosphate compounds against Phytophthora blight and anthracnose of pepper in a greenhouse
본래 Phytophthora 속 병원균의 균사생장 억제효과가 우수한 H3PO3은 병원균의 생육을 직접 억제하기도 하지만, 식물체에서 저항성을 유발하는 간접적인 효과가 크다고 알려져 있었다. 하지만 화학물질 처리를 하여 얻은 P. capsici의 돌연변이 균주가 H3PO3를 처리한 식물체에서 병을 일으켰을 뿐만 아니라, 식물체에서 저항성을 일으키는 것으로 보고되어 있는 fosetyl-Al에 대해서도 저항성 반응을 보이면서, Phytophthora 속에 대한 H3PO3의 작용기작이 식물체에서 저항성을 유기는 간접적인 효과뿐만 아니라 병원균의 생육을 직접 억제하는 효과도 있음이 알려졌다(Bower and Coffey, 1985; Ouimette and Coffey, 1989; Guest and Grant, 1991; Jee et al., 2002). 하지만 Phytophthora 속에 속하는 병원균의 종에 따라서 H3PO3에 대한 반응은 매우 다르다.
Coffey와 Bower (1984)는 8가지 종의 Phytophthora 균주를 선발하여 H3PO3와의 반응을 조사하였는데, 각 종의 EC50값은 5.2에서 224.4 μg mL−1로 매우 다양하였다. 감수성 반응을 나타내는 균주는 P. citrophthora M143, P. citricola P1287, P. cinnamomi Pc97 등이었으며, 나머지 균주들의 감수성 정도는 떨어졌다. P. capsici P1091과 P1314 균주의 EC50값은 각각 18.5와 30.6 μg mL−1로 감수성 그룹에 속하는 종에 비해서 감수성이 떨어지는 것으로 나타났다. 본 실험에 사용한 P. capsici JHAW1-2는 metalaxyl에 대해서 저항성 반응을 보이는 균주임에도 불구하고 H3PO3 처리에 의해서 균사생장이 억제되어, 포장에서 발생한 살균제 저항성균의 방제에도 작용기작이 다른 인산염 화합물을 사용할 수 있음을 보여 주었다.
살균제의 대용품으로 유기농재배에서 사용되는 무기화합물은 중탄산염, 인산염, 규산염, 염화물, 아인산염에 속하는 34종의 화합물이었으며, 이들은 35종의 작물에서 49종의 식물병에 대한 효과가 있었다(Deliopoulos et al., 2010). 하지만 기존 살균제의 병방제 효과와 비교하면 본 실험에서 고추 역병과 탄저병 방제를 위해서 사용한 인산염 화합물의 효과가 낮기 때문에 살균제의 사용을 완전히 대체할 수는 없지만, 살균제 처리 체계에서 기존 살균제를 대신하여 처리함으로써 살균제 사용량을 감소시킬 가능성이 있기 때문에, 특정 식물병의 병방제 프로그램에 포함하여 사용하는 것이 타당하다고 본다.
Acknowledgments
이 논문은 2014년도 충북대학교 학술연구지원사업의 연구비 지원에 의하여 연구되었습니다.
References
- Anderson, J. M., K. G. Pegg, L. M. Coates, E. K. Dann, A. W. Cooke, L. A. Smith, and J. R. Dean, (2004), Silicon and disease management in avocados, Talking Avocados, 15, p23-25.
- Bekker, T. F., C. Kaiser, R. Van der Merwe, and N. Lavuschagne, (2006), In-vitro inhibition of mycelial growth of several phytopathogenic fungi by soluble silicon, S. A. J. Plant Soil, 26, p169-172.
-
Bower, L. A., and M. D. Coffey, (1985), Development of laboratory tolerance to phosphorous acid, fosetyl-Al and metalaxyl in Phytophthora capsici, Can. J. Plant Pathol, 7, p1-6.
[https://doi.org/10.1080/07060668509501507]

-
Coffey, M. D., and L. A. Bower, (1984), In vitro variability among isolates of eight Phytophthora species in response to phosphorous acid, Phytopathology, 74, p738-742.
[https://doi.org/10.1094/phyto-74-738]

-
Deliopoulos, T., P. S. Kettlewell, and M. C. Hare, (2010), Fungal disease suppression by inorganic salts: A review, Crop Prot, 29, p1059-1075.
[https://doi.org/10.1016/j.cropro.2010.05.011]

-
Fawe, A., M. Abou-Zaid, J. G. Menzies, and R. R. Belanger, (1998), Silicon-mediated accumulation of flavonoid phytoalexins in cucumber, Phytopathology, 88, p396-401.
[https://doi.org/10.1094/phyto.1998.88.5.396]

-
Guest, D. I., and B. R. Gran, (1991), The complex action of phosphonates as antifungal agents, Biol. Rev, 66, p159-187.
[https://doi.org/10.1111/j.1469-185x.1991.tb01139.x]

- Hammerschmidt, R., (1999), Induced disease resistance: how do induced plants stop pathogens? Physiol, Mol. Plant Pathol, 55, p77-84.
-
Jee, H-J., W-D. Cho, and C-H. Kim, (2002), Effect of potassium phosphonate on the control of Phytophthora root rot of lettuce in hydroponics, Plant Pathol. J, 18, p142-146.
[https://doi.org/10.5423/ppj.2002.18.3.142]

- Kettlewell, P. S., P. Blouin, and G. L. Boulby, (1992), Evaluation of potassium chloride solution against leaf diseases in barley, Ann. Appl. Biol, 120, p18-19.
-
Mann, R. L., P. S. Kettlewell, and R. Jenkinson, (2004), Effect of foliar-applied potassium chloride on septoria leaf blotch of winter wheat, Plant Pathol, 53, p653-659.
[https://doi.org/10.1111/j.1365-3059.2004.01063.x]

-
Mitchell, A. F., and D. R. Walters, (2004), Potassium phosphate induces systemic protection in barley to powdery mildew infection, Pest Manag. Sci, 60, p126-134.
[https://doi.org/10.1002/ps.795]

-
Ouimette, D. G., and M. D. Coffey, (1989), Comparative antifungal activity of four phosphonate compounds against isolates of nine Phytophthora species, Phytopathology, 79, p761-767.
[https://doi.org/10.1094/phyto-79-761]

-
Park, S-J., G. Kim, A. H. Kim, H. Lee, H. Gwon, J. Kim, K. H. Lee, and H. T. Kim, (2012), Controlling effect of agricultural organic materials on Phytophthora blight and anthracnose in red pepper, Res. Plant Dis, 18, p1-9, (in Korean).
[https://doi.org/10.5423/rpd.2012.18.1.001]

- Reuveni, M., and R. Reuveni, (1995a), Efficacy of foliar application of phosphates in controlling powdery mildew fungus on field-grown wine grapes: effects on cluster yield and peroxidase activity in berries, J. Phytopathol, 143, p21-25.
- Reuveni, M., and R. Reuveni, (1995b), Efficacy of foliar sprays of phosphates in controlling powdery mildews in fieldgrown nectarine, mango trees and grapevines, Crop Prot, 14, p311-314.
-
Reuveni, M., and R. Reuveni, (1998), Foliar applications of mono-potassium phosphate fertilizer inhibit powdery mildew development in nectarine trees, Can. J. Plant Pathol, 20, p253-258.
[https://doi.org/10.1080/07060669809500391]

-
Walters, D. R., and I. J. Bingham, (2007), Influence of nutrition on disease development caused by fungal pathogens: implications for plant disease control, Ann. Appl. Biol, 151, p307-324.
[https://doi.org/10.1111/j.1744-7348.2007.00176.x]

-
Ziv, O., and T. A. Zitter, (1992), Effects of bicarbonates and film-forming polymers on cucurbit foliar diseases, Plant Dis, 76, p513-517.
[https://doi.org/10.1094/pd-76-0513]

