
몇 가지 살균제에 대한 콩균핵마름병균 Macrophomina phaseolina의 감수성 변화
초록
콩 균핵마름병을 일으키는 Macrophomina phaseolina를 시기 별로 2016년부터 2018년까지 그리고 2020년과 2021년에 각각 분리하여, benomyl, fluazinam, fludioxonil, tebuconazole, metconazole, prochloraz 등 7종의 살균제에 대한 감수성 정도를 비교하였다. 앞의 집단(2018년까지 채집한 균주 집단)과 비교하여 뒤의 집단은 benomyl, fludioxonil, metconazole, tebuconazole의 평균 EC50값이 2배 이상 증가하였다. EC50값이 단봉 분포를 하던 2018년까지 집단의 M. phaseolina는 2020년 이후 집단에서는 쌍봉 분포를 보이는 경향이 나타났으며, fludioxonil은 2020년 이후 집단에서 EC50값이 증가하면서 분포도가 고농도 쪽으로 이동하는 경향을 보였다. 2021년 9월 제주 지역에서 채집한 균주를 같은 해 제주 이외 지역에서 채집한 균주 집단의 EC50값을 비교할 때, benomyl과 pyraclostrobin을 제외한 5종의 살균제에서 제주 지역 집단이 제주 이외 지역 집단보다 낮은 EC50값을 나타내었다. 각 살균제 간의 결정 계수를 비교한 결과, tebuconazole, metconazole, prochloraz 간에 높은 교차 저항성이 있음을 알 수 있었다. 본 연구처럼 살균제가 등록되어 사용되기 이전의 집단과 이후 집단의 살균제에 대한 감수성 변화를 경시적으로 조사한 결과는, 병 방제를 위해서 우수한 살균제를 선발할 때와 살균제 저항성을 관리할 때에 효과적인 정보를 제공할 수 있을 것으로 생각한다.
Abstract
Macrophomina phaseolina, which causes soybean sclerotia blight, was isolated from 2016 to 2018, and in 2020 and 2021, respectively, and their sensitivity to 7 fungicides, including benomyl, fluazinam, fludioxonil, tebuconazole, metconazole, and prochlora, was compared by using an agar dilution method. Compared with the former (the population of isolates collected from 2016 to 2018), the mean EC50 value of benomyl, fludioxonil, metconazole, and tebuconazole increased more than twice in the latter (the population of isolates collected in 2020 and 2021). In the population of M. phaseolina collected until 2018, the EC50 value had a unimodal distribution, but the population after 2020 showed a tendency to form a bimodal distribution. As the EC50 value for fludioxonil increased in the population after 2020, the distribution showed a tendency to shift toward higher concentrations. When comparing the EC50 values of the isolates (n=20) collected in Jeju in September 2021 and the isolates (n=13) collected outside of Jeju in 2021, the Jeju local group had a lower EC50 value than the non-Jeju group in the five fungicides except for benomyl and pyraclostrobin. Comparing the coefficient of determination between each fungicide, it was found that there was high cross-resistance between tebuconazole, metconazole, and prochloraz. As depicted in this study, the changes in sensitivity to fungicides in the population of M. phaseolina isolates before and after the fungicide was registered will provide effective information when selecting an excellent fungicides for disease control and managing fungicide resistance.
Keywords:
Soybean charcoal rot, Macrophomina phaseolina, The change of the sensitivity to fungicides, Cross resistance.키워드:
콩 균핵마름병, 살균제에 대한 감수성 변화, 교차 저항성서 론
Macrophomina phaseolina는 토양 전반을 하는 식물병원균으로 옥수수, 수수, 콩, 땅콩, 완두, 목화, 참깨, 해바라기 등 284개 이상의 식물을 침입하면서 경제적으로 큰 피해를 입힌다(Odvody and Dunkle, 1979; Baird and Brock, 1999; Saleh et al., 2010; Mahmoud and Budak, 2011; Kaur et al., 2012; Ijaz et al., 2013; Ibrahim and Abdel-Azeem, 2015; Marquez et al., 2021; Rai et al., 2022). M. phaseolina는 뿌리나 줄기에 형성된 소립균핵이 접종원의 역할을 하며, 토양에서 15년 이상 생존이 가능한 것으로 알려져 있다(Short et al., 1980). 소립균핵은 주로 토양 표면에 군집하지만, 표토층에서부터 0 – 20 cm 사이에도 존재하며, 30oC 이상의 고온 및 수분 함량과 영양분이 낮은 조건에서도 생존이 가능하다(Campbell and Van der Gaag, 1993). M. phaseolina의 생장 적온이 30 – 35oC이다보니, 기후 변화 시나리오에 의해서 고온 건조한 기후가 될 경우 문제가 더욱 심각해질 수 있는 식물병으로 예측하고 있다(Cohen et al., 2022). M. phaseolina에 의한 병은 기주식물이 극한 환경 스트레스를 받았을 때 발생하기 시작하기 때문에, 병 방제를 위한 방법이 기주식물에 영향을 미치는 환경 스트레스를 줄이는 방법에 맞추어져 실험되고 있다(Cohen et al., 2022). 콩 재배 포장에서 목화, 수수, 옥수수 등과 콩을 윤작함으로써 M. phaseolina의 포장 밀도를 감소시키는 방법도 그 하나지만(Francl et al., 1988), 이스라엘의 멜론 재배 지역에서는 멜론 재배 시기에 윤작이 가능한 작물들이 M. phaseolina의 기주식물이다 보니 방제에 한계가 있다(Cohen et al., 2022). 관수를 통하여 M. phaseolina에 의한 병 발생을 방제하고자 하였지만, 관수가 콩 뿌리에서 M. phaseolina의 정착을 낮출 수는 있었지만, 방제 효과는 적었다(Kendig et al., 2000). 온실에서 콩과 해바라기를 대상으로 관수의 M. phaseolina 병 발생 억제 시험에는 개화기까지 발병에는 영향을 미치지 않았지만, 성숙기에는 병 발생을 억제했다는 보고도 있다(Jordaan et al., 2019). 멜론의 경우 접목을 통하여 1,000 m2 당 1,398 kg이었던 수확량이 6,174 kg까지 증가하기도 하였다(Cohen et al., 2012). 그런데 위에서 설명하는 경종적인 방제 방법은 재배하는 작물과 재배 지역의 기후 등에 따라서 일반화하기가 어렵다. 그러다 보니 저항성 품종을 재배하고자 하지만, 뚜렷한 저항성을 보이는 품종이 없어, 저항성 유전자를 탐색하는 연구들도 진행되어 왔다. Mengistu 등(2011)은 149개의 콩 유전자형에 대한 저항성 검정을 실시하여 DT97-4290과 유사한 정도의 중도 저항성을 보이는 6개의 유전자형을 선발하였고, 저항성 육종에 사용하였다. Cross 등(2012)은 몇 가지 콩의 유전자형에 대한 저항성 정도를 조사한 결과, DT97-4290보다 저항성이 큰 PI 567562A를 선발하기도 하였다(Cross et al., 2012). 최근에는 양적 형질 유전자좌(quantitative trait loci, QTL) 지도를 작성하여 얻은 균핵마름병과 밀접한 연관이 있는 QTL을 이용하여 육종 과정 중에서 저항성 개체를 정확하게 선발하는데 이용하지만(da Silva et al., 2019), 아직까지 저항성 효과가 우수한 품종의 개발은 이루어지지 않았다. 작물 재배 현장에서 신속하고 용이하게 접근할 수 있는 방제 방법 중의 하나가 살균제 처리이다. 그런데 M. phaseolina를 대상으로 개발된 살균제가 없다보니, in vitro에서 병원균에 효과적인 살균제의 선발부터(Tonin et al., 2013; Chamorro et al., 2015; Parmar et al., 2017; Lokesh et al., 2020), 종자 처리, 토양 소독, 토양 관주처리와 같은 다양한 처리에 의한 방제 효과가 포장에서 검정되고 있다(Cohen et al., 2012; Chamorro et al., 2015; Reznikov et al., 2016). 국내에서도 콩에서의 피해가 보고되면서 우수한 살균제의 선발과 종자 및 토양 처리 효과에 대한 온실 검정의 결과가 보고되었다(Ko et al., 2020). 하지만 아직까지 전 세계적으로 M. phaseolina에 의한 병의 방제가 효과적이지 못하기 때문에 더 많은 연구가 필요한 상황이다.
국내에서는 농촌진흥청의 농약직권등록시험에 의해서 2021년도에 pyraclostrobin과 fludioxonil이 등록되어 방제에 사용되고 있다. 하지만, 두 종류의 살균제만 등록되어, 병 발생에 대한 관리뿐만 아니라, 살균제 저항성 병원균이 발생할 경우 관리가 어려울 수 있다. 그렇기 때문에 우수한 효과를 가진 더 많은 살균제의 선발과 포장 사용 방법, 살균제 저항성 관리 등의 연구가 필요하다. 본 연구에서는 in vitro 실험을 통하여 M. phaseolina만을 목표로 하지 않고, 콩의 생육 후반기에 고사를 유발하는 Diaporthe longicolla, Calonectria ilicicola, Fusarium oxysporum 등의 균사 생장을 억제하는 살균제를 선발하고자 하였다. 또한 살균제 저항성 문제의 관리를 위해서 병원균의 감수성 기준을 정하고, 등록 시험이 진행되기 이전의 균주 집단과 이후 균주 집단의 살균제에 대한 반응의 경시적인 변화를 조사하고자 하였다. 특히 제주도의 균핵마름병이 심하게 발생한 지역에서 M. phaseolina 균주를 채집하여, 동일한 시기에 채집한 제주도 이외 지역의 균주 집단과 살균제에 대한 감수성을 비교하였다.
재료 및 방법
고사한 콩의 채집 및 병원균 분리
콩 시료는 2016년부터 2021년까지 전국의 콩 재배지에서 채집하였다. 매년 8월부터 10월 사이에 경기 화성, 충북 제천 등지의 콩 포장에서 고사한 콩을 채집하고, 채집한 콩을 지제부, 원뿌리, 곁뿌리로 구분하여 병원균을 분리하였다. 콩의 각 부위에서 병든 조직을 길이 5 mm 정도로 잘라내어, 70% 에탄올과 1% 차아염소산나트륨 용액에서 30초간씩 표면살균하고, 멸균수로 1분간 세척한 후, 멸균한 여과지에 올려 수분을 제거하였다. 표면 살균한 병든 조직은 1% 물한천배지(water agar, WA)에 치상하여 암 조건에서 일정 기간 동안 배양하였다. 병든 조직으로부터 자라나온 균사를 해부 현미경에서 관찰하며 단균사의 끝 부분의 조각을 떼어 300 μg/mL의 streptomycin을 첨가한 PDA 배지(potato dextrose agar; Becton, Dickinson and Company, DifoTM)에 접종하고, 다시 암 조건에서 배양하였다. M. phaseolina는 35oC에서 분리를 실시하였으며, M. phaseolina 이외 병원균의 균주는 25oC에서 분리하였다. 분리한 병원균은 ITS(Internal Transcribed Spacer) 영역을 ITS1 (5'-TCC GTA GGT GAA CCT GCG G-3')과 ITS4 (5'-TCC TCC GCT TAT TGA TAT GC-3') 를 사용하여 증폭하여 동정하였다(White 등, 1990).
실험에 사용한 균주
살균제 선발 실험을 위해서 콩균핵마름병균인 M. phaseolina ASH20-001, 미라병균인 D. longicolla DI20-001, 검은뿌리썩음병균인 C. ilicicola CA20-008, 시들음병균인 F. oxysporum FO20-001 등 콩의 주요 병의 원인이 되는 4종의 병원균 균주를 실험에 사용하였다. 선발한 7종의 살균제에 대한 감수성의 변화를 조사하기 위해서 단균사 분리한 M. phaseolina는 2016년부터 2018년까지 화성을 비롯한 전국 재배지에서 분리한 37균주와 2020년에는 24균주, 2021년에는 13균주를 사용하였다. 분리한 균주는 2020년 콩 균핵마름병을 처음 보고한 연도를 중심으로, 2016년과 2018년에 분리한 균주와 2020년과 2021년에 분리한 균주로 나누어 살균제에 대한 감수성 정도를 비교하였다. 또한 2021년 9월에 제주도의 균핵마름병 발생 지역에서 분리한 20균주는 2021년 제주도를 제외한 지역에서 분리한 균주와 감수성 정도를 비교하였다.
실험에 사용한 살균제
고사한 콩에서 분리한 4종의 병원균에 대한 살균제의 효과를 검정하기 위하여 작용기작이 다른 29종의 살균제를 선발하여 실험에 사용하였다(Table 1). 세포 분열을 억제하는 B1, 세포 호흡을억제하는 C2, C3, C4, C5, 신호 전달을 저해하는 E2, E3, 스테롤 생합성을 저해하는 G1, G3 그룹과 다작용점을 억제하는 보호살균제(M 그룹)를 선발하여 균사생장 억제효과를 조사하였다.
연도 별로 분리한 M. phaseolina의 살균제에 대한 감수성 변화는 병원균에 대한 EC50값이 0.5 μg/mL 이하인 살균제 중에서 적용 병원균의 범위가 넓은 7종의 살균제를 우선으로 선발하여 조사하였다. 선발한 7종의 살균제는 B1 그룹인 benomyl, C3 그룹인 pyraclostrobin, C5 그룹인 fluazinam, E2 그룹인 fludioxonil, G1 그룹인 metconazole, prochloraz, tebuconazole 등이었다.
살균제 효과 검정
선발한 살균제의 효과는 병원균에 대한 균사생장 억제효과를 한천희석법으로 조사하였다. 공시한 살균제 중에서 5종의 살균제는 PDA 배지에 0.01, 0.1, 1.0, 10.0, 100.0 μg/mL가 되도록 첨가하였으며, 살균제를 첨가하기 전에 세균에 의한 오염을 방지하기 위해서 300 μg/mL의 streptomycin을 첨가하였다. 다만 fluazinam과 fludioxonil의 경우는 최종 농도가 0.001, 0.01, 0.1, 1.0, 10.0 μg/mL가 되도록 첨가하였다. M. phaseolina는 30oC의 PDA배지에서 3일간 배양하여 접종원으로 사용하였다. 균총 선단에서 직경 3 mm의 균사 조각을 떼어내어 살균제를 첨가한 PDA 배지에 균사 면이 배지 쪽으로 가도록 뒤집어서 접종하고, 30oC에서 2일간 배양하였다. 살균제의 균사생장 억제효과는 살균제 첨가 및 무첨가 PDA배지에서 병원균의 균총 직경을 조사하여 아래 식으로 계산하였다.
각 살균제의 처리 농도에서 병원균에 대한 균사생장 억제효과를 구한 후, 엑셀 프로그램을 이용하여 살균제 농도와 억제효과 간의 회귀식을 구하였다. 회귀식을 이용하여 병원균의 균사생장을 50% 억제하는 농도를 구하여, 각 살균제의 효과를 비교하였다.
살균제 간의 교차 저항성 조사
제주도를 포함하여 2016년부터 2021년까지 채집한 94개 균주의 살균제에 대한 EC50값을 가지고 실험에 사용한 7종의 살균제 간의 감수성에 대한 상관 관계를 회귀 분석을 통하여 조사하였다. 상관계수의 통계적 유의성을 계산하여 살균제 간에 교차 저항성 관계가 성립하는 지를 분석하였다.
통계 분석
이 논문에서의 모든 실험 데이터는 IBM SPSS Statistics 26 통계처리 프로그램을 이용하여 일원분산분석을 실시하였으며, 분산분석 후 사후 검정으로 DMRT를 실시하였다. 또한 살균제에 대한 M. phaseolina의 교차 저항성 가능성을 확인하기 위하여 상관 분석을 실시하여 상관계수를 구하고 비교하였다.
결과 및 고찰
콩 주요 병원균에 대한 살균제의 균사생장 억제효과
본 연구에서는 콩균핵마름병균 뿐만 아니라 콩이 고사하는 유사한 병징을 보이는 미라병균, 검은뿌리썩음병균, 시들음병균에 대한 억제효과도 우수한 살균제를 선발하기 위해서, 4종의 콩 병원균에 대한 살균제의 균사생장 억제효과를 조사하였다. Metconazole과 prochloraz는 M. phaseolina ASH20-001, D. longicolla DI20-001, C. ilicicola CA20-008, F. oxysporum FO20-001 모두에 대해서 EC50값이 0.5 μg/mL 이하로, 우수한 균사 생장 억제효과를 보였다. 특히 M. phaseolina ASH20-001에 대한 EC50값은 metconazole이 0.18 μg/mL, prochloraz가 0.4 μg/mL이었다. Benomyl, fluazinam, fludioxonil, tebuconazole 등은 4종의 병원균 중에서 3종의 병원균에 대한 EC50값이 0.5 μg/mL 이하였지만, benomyl과 fluazinam은 F. oxysporum FO20-001에 대해서 EC50값이 1.91과 0.63 μg/mL이었으며, fludioxonil과 tebuconazole은 C. ilicicola CA20-008에 대한 EC50값이 1.67과 0.79 μg/mL로. 0.5 μg/mL 이상이었다. 하지만 M. phaseolina ASH20-001에 대한 benomyl, fluazinam, fludioxonil, tebuconazole의 EC50값은 0.15, < 0.01, 0.01, 0.24 μg/mL로 우수하였다. Pyraclostrobin은 M. phaseolina ASH20-001과 D. longicolla DI20-001에 대한 EC50값은 0.02와 <0.01 μg/mL로 매우 우수하였으나, C. ilicicola CA20-008과 F. oxysporum FO20-001에 대해서는 14.10과 3.56μg/mL로 저조하였다. 병원균 4종 모두에 대해서 우수한 균사생장 억제효과를 보인 metconazole과 prochloraz는 식물병원곰팡이의 에르고스테롤 생합성을 저해하는 살균제이다. 특히 metconazole은 Fusarium에 의한 붉은곰팡이병 방제를 위해서 사용하는 살균제로서(Magan et al., 2002; Paul et al., 2008; Tateishi et al., 2010; Spolti et al., 2012), 에르고스테롤 생합성 과정의 효소인 C14-demethylase의 활성을 저해한다(Ito et al., 1999). 본 연구를 통해서 metaconazole의 M. phaseolina에 대한 균사생장 억제효과가 처음 보고되지만, 실험실 내에서 병원균을 가지고 실험한 결과이기 때문에, 병 방제에 실제 적용하기 위해서는 온실과 포장에서 효과 검정해야 할 뿐만 아니라, 작물에 대한 약해 여부까지도 조사되어야 한다.
살균제에 대한 Macrophomina phaseolina의 연도 별 감수성 변화
병원균은 콩 균핵마름병에 대한 포장 방제 실험을 시작하여 살균제를 등록하기 이전인 2016년부터 2018년까지 채집한 병원균 그룹과 2020년 이후에 채집한 그룹으로 나누어, 7종 살균제의 균사생장 억제효과를 비교하였다(Table 3). 그 결과, 채집 시기가 달랐던 두 집단의 benomyl과 fludioxonil, 그리고 tebuconazole과 metconazole에 대한 EC50값의 차이가 통계적으로 유의하였으며(P<0.01), 2020년 이후 그룹이 2018년까지 그룹과 비교하여 평균 EC50값이 2배 이상 증가하였다. 작용기작이 동일한 prochloraz는 tebuconazole과 metconazole과는 다르게 시기별 집단 간에 유의차 있는 EC50값의 변화가 인정되지는 않았다. 연도 별 그룹에 대한 prochloraz, pyraclostrobin, fluazinam의 EC50값 변화는 통계적으로 유의하지 못하였다.

Fungicide sensitivitya between the Macrophomina phaseolina isolate populationb collected by 2018 and after 2020
2018년까지 채집한 M. phaseolina의 집단과 2020년 이후에 채집한 집단에 대한 EC50값의 분포를 비교하였다. Benomyl의 EC50값 분포는 0.5 - 0.6 μg/mL의 구간에서 2020년 이후 채집한 M. phaseolina 균주의 수가 증가하면서 2018년까지 집단에서 보여주던 단봉 분포가 쌍봉 분포의 형태로 변화하기 시작하였다(Fig. 1A). EC50값이 상승한 M. phaseolina 균주의 β-tubulin 유전자를 분석한 결과, 특정 위치에서 아미노산의 치환은 발견되지 않았다(결과 미발표). Fludioxonil의 경우 살균제에 대한 병원균의 감수성이 저하하면서, EC50값의 분포가 전체적으로 고농도 쪽으로 이동하여, 0.01 – 0.03 μg/mL이었던 최빈값 구간이, 2020년 이후 균주 집단에서는 0.05 – 0.07 μg/mL로 상승하였다(Fig. 1G). 에르고스테롤 생합성을 저해하는 prochloraz, tebuconazole, metconazole에서는 0.7 μg/mL 이상인 EC50값을 갖는 균주의 수가 증가하며, 고농도 구간의 균주 수가 전체적으로 조금씩 증가하는 경향을 보였다(Fig. 1B, 1C와 1D). Fig. 1C에서 보면 2020년 이후 M. phaseolina 균주 중에서 tebuconazole에 대한 EC50값이 1.0μg mL 이상인 균주는 5균주이었으며, 그 중 4균주는 2021년에 분리한 균주로, M. phaseolina ASH21-025와 ASH21-027은 충북 제천에서, M. phaseolina A SH21-030과 ASH21-032은 경기 화성에서 분리하였다. Tebuconazole에 대한 EC50값은 1.098, 1.232, 1.327, 1.389 μg/mL이었으며, prochloraz에 대해서는 ASH21-025와 ASH21-032가 1.211과 1.193 μg/mL, ASH21-027과 ASH21-030은 0.856과 0.775 μg/mL이었고, metconazole에 대해서는 21-025, 210-027, 21-030이 1.135, 1.346, 1.447 μg/mL, 그리고 21-032가 0.94 μg/mL이었다. Tebuconazole에 대한 감수성이 떨어진 4균주는 동일한 작용기작을 갖는 prochloraz와 metconazole에 대해서도 감수성이 저하되며 EC50값이 증가하였다.
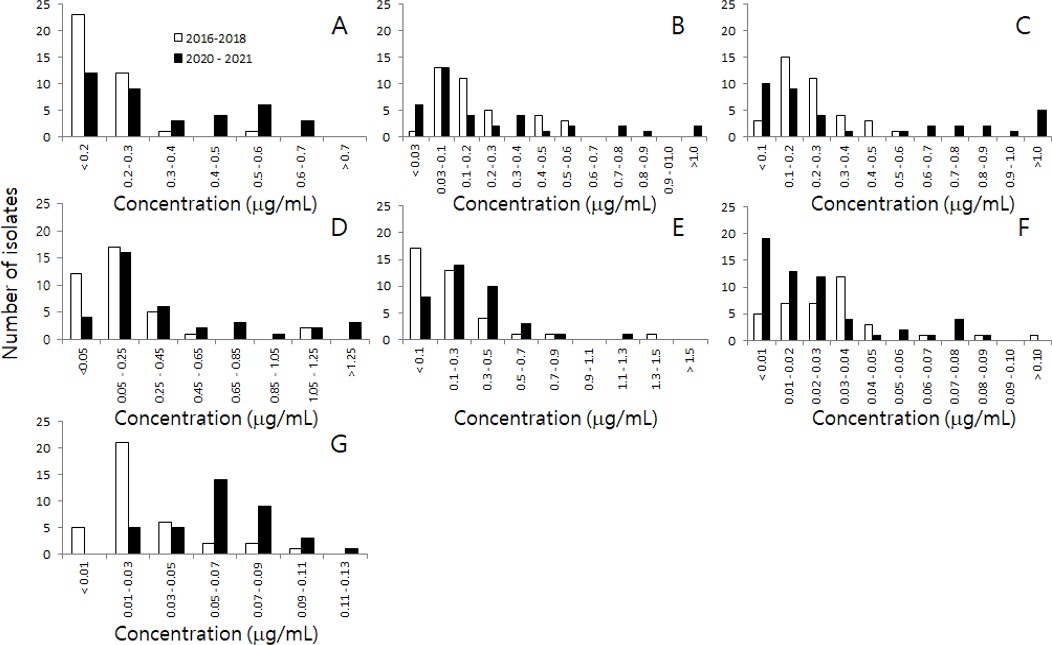
Distribution of sensitivity of two populations of Macrophomina phaseolina to several fungicides. For the two populations of pathogens, the first was the population collected from 2016 to 2018, and the other was the one collected in 2020 and 2021. Isolates were randomly collected from soybean fields across Korea. A; benomyl, B; prochloraz, C; tebuconazole, D; metconazole, E; pyraclostrobin, F; fluazinam, and G; fludioxonil.
병원균의 살균제에 대한 EC50값의 분포 양상을 가지고 저항성을 질적 저항성과 양적 저항성으로 구분한다(Brent and Hollomon, 2007). 질적 저항성은 작용점 유전자의 돌연변이가 저항성 발생 기작인 살균제에서 나타나는데, 감수성과 저항성 균주의 EC50값의 차이가 뚜렷하기 때문에, EC50값의 분포가 쌍봉 분포를 이루게 된다. 이에 비해서 양적 저항성은 병원균의 EC50값이 전체적으로 높아지면서 EC50값의 분포가 고농도 쪽으로 이동하는 양상을 보이는데, ABC transporter가 살균제를 방출하거나 또는 작용점 유전자의 과다 발현 등에 의해서 저항성이 발생할 경우 나타나게 된다(Brent and Hollomon, 2007). 본 연구 결과에서도 β-tubulin 유전자의 점 돌연변이에 의해서 저항성이 나타나는 benomyl의 경우가 질적 저항성을 보이는데, 2020년 이후 균주 집단의 분포가 쌍봉 분포 형태를 보이기 시작하였다. Fludioxonil의 작용기작은 아직까지 정확하게 규명되지 않았지만, Botrytis cinerea에서 삼투압 조절 유전자인 bos1, bcsak1, BcOS4, bos5, BRRG-1의 돌연변이와 ABC(ATP-binding cassette) transporter에 의한 다중 저항성 기작으로 설명하고 있다(Vigntelli et al., 2002; Kretschmer et al., 2009; Leroch et al., 2013). Fig. 1G에서 보는 것과 같이 fludioxonil의 EC50값 분포가 양적 저항성의 특징을 보이는 것 같아, ABC transporter에 의한 다중 저항성 기작이 M. phaseolina에도 작동되는 것이 아닌가 하는 생각을 갖게 한다. 하지만 fludioxonil 저항성을 정확하게 설명하기 위해서는 포장 병원균에 대한 경시적인 저항성 모니터링과 발현 기작 연구가 더 진행되어야 한다. 양적 저항성의 발현은 Fusarium graminearum에서도 보고되어 있다(Zhou et al., 2020). 이런 결과는 fludioxonil의 방제 효과가 급작스럽게 감소하지는 않겠지만, 지속적인 사용으로 농도가 높아지면, 살균제의 사용량이 증가하면서 저항성 문제가 심화될 수도 있다.
제주도 지역과 제주도 이외 지역에서 분리한 Macrophomina phaseolina 집단의 감수성 차이
2021년 9월에 제주 북부 지역에서 채집한 고사한 콩에서 M. phaseolina를 분리하여, 제주도 이외 지역에서 분리한 균주와 살균제에 대한 반응을 비교하였다. Fig. 2에서 보는 것과 같이 7종의 살균제 중에서 benomyl과 pyraclostrobin을 제외한 5종의 살균제에 대한 반응이 통계적으로 유의한 차이를 보였다(P<0.01). 제주도를 제외한 지역에서 분리한 M. phaseolina의 prochloraz, tebuconazole, metconazole에 대한 평균 EC50값은 0.590 ± 0.344 μg/mL, 0.837 ± 0.375 μg/mL, 0.866 ± 0.434 μg/mL이었으나, 제주도 지역에서 분리한 M. phaseolina의 평균 EC50값은 0.212 ± 0.163 μg/mL, 0.330 ± 0.160 μg/mL, 0.389 ± 0.522 μg/mL로, EC50값이 2.2배 이상 차이가 났다. 각 지역의 콩 재배 포장에서 prochloraz, tebuconazole, metconazole의 정확한 사용량을 알 수 없었기 때문에, 살균제의 사용량이 병원균의 감수성 변화에 영향을 미쳤다고 이야기할 수는 없지만, 제주도 지역에서 분리한 M. phaseolina가 살균제와 접촉할 기회가 적었기 때문에, 살균제에 대한 감수성이 높았을 것으로 추정하였다. 붉은곰팡이병을 일으키는 Fusarium graminearum도 tebuconazole을 연속적으로 처리한 후 살균제에 대한 감수성이 감소하였다는 보고가 있다(Becher et al., 2010). Benomyl의 경우, 제주 지역 집단은 제주 지역 이외 집단과 감수성에 차이가 없었다. 또한 제주 이외 지역의 집단에서 높은 EC50값을 보이는 균주를 선발하여 β-tubulin 유전자 염기서열을 분석한 결과, 점 돌연변이가 발생하지 않았던 점을 보면, 제주 이외 지역과 동일하게 제주 지역에서 채집한 M. phaseolina 균주는 점 돌연변이에 의한 살균제 저항성의 발생은 없었던 것으로 생각하였다. Pyraclostrobin도 Fig. 1E에서 보는 것과 같이 시기 별 두 집단 간의 감수성에 차이가 없음을 보여 줄 뿐만 아니라, 2021년에 채집한 제주 이외 지역과 제주 지역 균주 집단 간에도 감수성이 변화하지 않았다. 하지만, 정확한 저항성 모니터링을 위해서 작용점인 cyt b 유전자에 대한 분석이 필요한 상태이다. 이상의 결과에서 보면, 제주도에서 분리한 M. phaseolina 균주는 제주도 이외에서 채집한 균주에 비하여 일부 살균제에 대한 감수성이 큰 것으로 나타났다. 최근 콩 균핵마름병의 방제를 위해서 fludioxonil과 pyraclostrobin이 등록되었다. 두 살균제 중에서 fludioxonil은 Fig. 1G와 같이 제주도 이외 지역 균주 집단에서 감수성이 낮았으나, pyraclostrobin의 감수성 간에는 통계적인 유의차가 없었다. 하지만 pyraclostrobin은 특이적인 작용점을 가지며, 저항성 발현 기작도 작용점 유전자의 점 돌연변이에 의해서 나타나기 때문에, 포장에서 사용하는데 주의 깊은 관리가 필요하다. 특히 제주도처럼 살균제에 대한 노출이 적었을 것으로 예상되는 지역에서는 살균제 사용에 대한 적극적인 관리가 필요할 뿐만 아니라, 저항성 관리를 위해서 사용하는 살균제에 대한 지속적이며 정확한 모니터링이 필요하다.

Distribution of EC50 values of Macrophomina phaseolina against each fungicide. X marks mean EC50 values of all isolates of M. phaseolina tested for each fungicide. The EC50 value was obtained with the inhibitory effect on the mycelial growth of M. phaseolina investigated by the agar dilution method in the PDA medium to which the fungicide was added at a predetermined concentration.
살균제에 대한 Macrophomina phaseolina의 교차 저항성
균핵마름병의 각 살균제에 대한 감수성의 변화가 서로 관계가 있는 지를 조사하였다(Table 4).

Regression analysis between fungicides that inhibit ergosterol biosynthesis of M. phaseolina. Regression analysis between each fungicide was performed with EC50 values of 94 isolates of M. phaseolina. R2 is the coefficient of determination. Red symbols indicate four isolates as M. phaseolina 21-025, 21-027, 21-030, and 21-032, in ascending order of EC50 values for tebuconazole.
Prochloraz, tebuconazole, metconazole은 각각 0.650 이상의 아주 높은 상관관계(p<0.01)를 보이며 교차 저항성 관계에 있음을 보여 주었다. Tebuconazole에 대한 감수성이 떨어진 M. phaseolina ASH21-025, ASH21-027, ASH21-030, ASH21-032 등 네 균주는 prochloraz와 metconazole에 대해서도 감수성이 감소하였다.
또한 benomyl에 대한 병원균의 감수성과 prochloraz, tebuconazole, metaconazole에 대한 감수성 간에도 0.5 이상의 뚜렷한 상관관계를 가지며 통계적으로 유의하였다(p<0.01). Benomyl은 작용기작이 다른 살균제에 대해서도 높은 상관 관계를 보이며 교차 저항성 관계에 있음을 보여주었다. Puccinia graminis f. sp. tritici의 경우에도 작용기작이 다른 triadimefon과 carbendazim 간에 높은 상관계수를 보이며, 교차 저항성이 인정되었다(Wu et al., 2020). 작용기작이 다른 살균제 그룹 간에 교차 저항성이 인정되는 것은 저항성의 기작이 살균제 작용점 유전자에서 발생하는 점 돌연변이가 아닌 다른 기작일 가능성이 높기 때문에 포장에서 더 많은 균주를 대상으로 모니터링과 기작 연구를 진행할 필요가 있다. Benomyl은 fluazinam과 fludioxonil에 대한 감수성과도 0.235와 0.290의 약한 상관관계가 통계적으로 인정되었으나, pyraclostrobin과는 상관관계가 통계적으로 인정되지 않았다.
본 연구에서는 M. phaseolina의 방제를 위해서 우수한 균사생장 억제효과를 보이는 살균제를 선발하고자 하였다. 그런데 포장에서 채집한 고사한 콩에서는 다양한 병원균이 분리되었고, 높은 빈도로 분리된 병원균이 균핵마름병균인 M. phaseolina, 미라병균인 D. longicolla, 검은뿌리썩음병균인 C. ilicicola, 시들음병균인 F. oxysporum 등 4종이었다. 따라서 M. phaseolina를 방제하기 위해서 선발한 살균제가 다른 병원균에도 효과가 있다면, 콩이 시들어 죽는 증상을 효과적으로 방제할 수 있을 것으로 생각하였다. 다만 살균제를 병원균에 대한 균사생장 억제효과를 가지고 선발하였기 때문에, 선발한 살균제는 포장 검정을 통하여 방제 효과를 정확하게 조사하여야 한다.
본 실험의 결과를 보면 2021년에 균핵마름병 방제를 위해서 새롭게 등록한 fludioxonil에 대한 감수성이 저하되었던 반면에, pyraclostrobin에 대한 감수성에는 변화가 없었다. 국내에서 콩에는 237개 품목의 살균제가 등록되어 있다. 그중에서 fludioxonil은 콩 균핵마름병의 방제를 위해서만 20개의 품목이 한꺼번에 등록되어 사용되고 있는 상황이기 때문에, 포장에서 사용을 관리할 수 있어야 한다. Pyraclostrobin이 속한 다3 군의 살균제는 단제 122품목와 합제 17품목이 등록되어 전체 등록된 살균제의 58.6%를 차지할 정도로 많지만, 본 실험에서는 시기 별로 채집한 집단 간에 감수성 저하 양상은 나타나지 않았다. 그런데 다3군의 살균제는 균핵마름병 이외에도 노균병, 자주무늬병 점무늬병, 탄저병 등을 방제하기 위해서 등록되어 사용되고 있으며, 무인항공기 방제용으로도 사용되고 있을 정도로 사용처가 많다. 따라서 병원균의 감수성 저하 양상이 나타나지 않았다고 할지라도, pyraclostrobin이 특이적인 작용점을 지니며 저항성 발현 위험도가 높은 살균제이니 만큼, 지속적인 저항성 모니터링이 필요하다. 에르고스테롤 생합성을 저해하는 사1군 살균제는 단제 11품목, 합제는 16품목이 등록되어 탄저병과 자주무늬병의 방제에 사용되는데, 균핵마름병에는 등록되어 있지는 않다. 하지만, 사1군에 속하는 metconazole과 tebuconazole에 대한 M. phaseolina의 감수성이 떨어지고 있기 때문에 균핵마름병균 뿐만 아니라, 자주무늬병균과 탄저병균에 대한 저항성 발생 여부도 지속적으로 모니터링하여야 한다.
대부분의 살균제 저항성 검정 연구에서는 당해 연도에 채집한 병원균의 균주를 사용하거나, 연도별로 균주를 채집한다고 해도 채집하는 기간이 제한적인 경우가 대부분이다. 하지만 본 연구에서는 2016년부터 2021년까지 6년간의 기간 동안 병원균을 채집하였으며, 균핵마름병 방제용 살균제를 등록하여 사용하기 전과 후로 나누어 살균제에 대한 반응을 비교하였기 때문에, 병원균의 살균제에 대한 감수성 정도의 경시적인 변화를 관찰할 수 있었다. 이런 경시적 변화에 대한 정보는 병 방제를 위해서 살균제를 선발할 때나, 살균제 저항성 문제를 관리할 때에는 매우 유용한 역할을 할 것으로 생각한다.
Acknowledgments
본 연구는 농촌진흥청 공동연구사업(과제번호: PJ014956022020)의 지원에 의하여 수행되었습니다.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
-
Baird RE, Brock JH, 1999. First report of Macrophomina phaseolina on cotton (Gossypium hirsutum) in Georgia. Plant Dis. 83(5):487.
[https://doi.org/10.1094/PDIS.1999.83.5.487B]

-
Becher R, Hettwer U, Karlovsky P, Deising HB, Wirsel SG, 2010. Adaptation of Fusarium graminearum to tebuconazole yielded descendants diverging for levels of fitness, fungicide resistance, virulence, and mycotoxin production. Phytopathology. 100(5):444-453.
[https://doi.org/10.1094/PHYTO-100-5-0444]

- Brent KJ, Hollomon DW, 2007. Fungicide resistance in crop pathogens: How can it be managed? FRAC a Technical Sub-group of Croplife International, Brussels, Belgium. Pp.9-13.
-
Campbell CL, Van der Gaag DJ, 1993. Temporal and spatial dynamics of microsclerotia of Macrophomina phaseolina in three fields in North Carolina over four to five years. Phytopathology. 83(12):1434-1440.
[https://doi.org/10.1094/Phyto-83-1434]

-
Chamorro M, Domínguez P, Medina JJ, Miranda L, Soria C, et al., 2015. Assessment of chemical and biosolarization treatments for the control of Macrophomina phaseolina in strawberries. Sci. Hortic. 192:361-368.
[https://doi.org/10.1016/j.scienta.2015.03.029]

-
Cohen R, Elkabetz M, Paris HS, Gur A, Dai N, et al., 2022. Occurrence of Macrophomina phaseolina in Israel: challeges for disease management and crop germplasm enhancement. Plant Dis. 106(1):15-25.
[https://doi.org/10.1094/PDIS-07-21-1390-FE]

-
Cohen R, Omari N, Porat A, Edelstein M, 2012. Management of Macrophomina wilt in melons using grafting or fungicide soil application: pathological, horticultural and economical aspects. Crop Prot. 35:58-63.
[https://doi.org/10.1016/j.cropro.2011.12.015]

-
Cross C, Wrather A, Fothergill K, Shannon G, Li S, et al., 2012. Effect of lactofen, azoxystrobin, and genotypes on charcoal rot, Phomopsis seed decay, and pod and stem blight in soybean. Plant Dis. 96(8):1154-1158.
[https://doi.org/10.1094/PDIS-09-11-0810-RE]

-
da Silva MP, Klepadlo M, Gbur EE, Pereira A, Mason RE, et al., 2019. QTL mapping of charcoal rot resistance in PI 567562A soybean accession. Crop Sci. 59(2):474-479.
[https://doi.org/10.2135/cropsci2018.02.0145]

-
Francl, LJ, Wyllie, TD, Rosenbrock, SM, 1988. Influence of crop rotation on population density of Macrophomina phaseolina in soil infested with Heterodera glycines. Plant Dis. 72(9):760-764.
[https://doi.org/10.1094/PD-72-0760]

- Ibrahim ME, Abdel-Azeem AM, 2015. Management of sesame (Sesamum Indicum L.) charcoal rot caused by Macrophomina phaseolina (Tassi) Goid. through the application of different control measure. J. Pure. Appl. Microbio. 9(1):1-9.
-
Ijaz S, Sadaqat HA, Khan MN, 2013. A review of the impact of charcoal rot (Macrophomina phaseolina) on sunflower. J. Agricul. Sci. 151(2):222-227.
[https://doi.org/10.1017/S0021859612000512]

-
Ito A, Saishoji T, Kumazawa S, Chuman H, 1999. Structure-activity relationships of the azole fungicide metconazole and its related azolyl methyl cycloalkanols. J. Pestic. Sci. 24(3):262-269.
[https://doi.org/10.1584/jpestics.24.262]

-
Jordaan E, van der Waals JE, McLaren NW, 2019. Effect of irrigation on charcoal rot severity, yield loss and colonization of soybean and sunflower. Crop Prot. 122:63-69.
[https://doi.org/10.1016/j.cropro.2019.04.026]

-
Kaur S, Dhillon GS, Brar SK, Vallad GE, Chand R, et al., 2012. Emerging phytopathogen Macrophomina phaseolina: biology, economic importance and current diagnostic trends. Crit. Rev. Microbiol. 38(2):136-151.
[https://doi.org/10.3109/1040841X.2011.640977]

-
Kendig SR, Rupe JC, Scott HD, 2000. Effect of irrigation and soil water stress on densities of Macrophomina phaseolina in soil and roots of two soybean cultivars. Plant Dis. 84(8):895-900.
[https://doi.org/10.1094/PDIS.2000.84.8.895]

-
Ko YM, Cho J, Choi GJ, Kim HT, 2020. Evaluation of fungicides for the control of Macrophomina phaseolina causing the charcoal rot of soybean. Korean J. Pestic. Sci. 24(1):82-90. (in Korean)
[https://doi.org/10.7585/kjps.2020.24.1.82]

-
Ko YM, Choi J, Lee YH, Kim HT, 2020. First report of charcoal rot caused by Macrophomina phaseolina on Glycine max in Korea. Res. Plant Dis. 26(1):29-37. (in Korean)
[https://doi.org/10.5423/RPD.2020.26.1.29]

- Kretschmer M, Leroch M, Mosbach A, Walker AS, Fillinger S, et al., 2009. Fungicide-driven evolution and molecular basis of multidrug resistance in field populations of the grey mould fungus Botrytis cinerea. PLoS Pathogens. 5(12):e1000696. DOI 10.1371/journal.ppat.1000696.
-
Leroch M, Plesken C, Weber RWS, Kauff F, Scalliet G, et al., 2013. Gray mold populations in German strawberry fields show multiple fungicide resistance and are dominated by a novel clade close to Botrytis cinerea. Appl. Environ. Microbiol. 79(1):159-167.
[https://doi.org/10.1128/AEM.02655-12]

-
Lokesh R, Rakholiya KB, Thesiya MR, 2020. Evaluation of different fungicides against Macrophomina phaseolina (Tassi) Goid. causing dry root rot of chickpea (Cicer arietinum L.) in vitro. Int. J. Curr. Microbiol. App. Sci. 9(7):901-911.
[https://doi.org/10.20546/ijcmas.2020.907.105]

-
Magan N, Hope R, Colleate A, Baxter ES, 2002. Relationship between growth and mycotoxin production by Fusarium species, biocides and environment. Mycotoxins in Plant Disease. 685-690.
[https://doi.org/10.1007/978-94-010-0001-7_11]

-
Mahmoud A, Budak H, 2011. First report of charcoal rot caused by Macrophomina phaseolina in sunflower in Turkey. Plant Dis. 95(2):223.
[https://doi.org/10.1094/PDIS-09-10-0631]

-
Marquez N, Giachero ML, Declerck S, Ducasse DA, 2021. Macrophomina phaseolina: General characteristics of pathogenicity and methods of control. Front. Plant Sci. 12:634397.
[https://doi.org/10.3389/fpls.2021.634397]

-
Mengistu A, Arelli PA, Bond JP, Shannon GJ, Wrather AJ, et al., 2011. Evaluation of soybean genotypes for resistance to charcoal rot. Plant Health Progress. 12:1. DOI 10.1094/PHP-2010-0926-01-RS.
[https://doi.org/10.1094/PHP-2010-0926-01-RS]

-
Odvody GN, Dunkle LD, 1979. Charcoal stalk rot of sorghum: Effect of environment on host-parasite relations. Phytopathology 69:250-254.
[https://doi.org/10.1094/Phyto-69-250]

- Parmar HV, Kapadiya HJ, Bhaliya CM, 2017. Efficacy of different fungicides against Macrophomina phaseolina (Tassi) Goid causing castor root rot. Int. J. Chem. Stud. 5(5):1807-1809.
-
Paul PA, Lipps PE, Hershman DE, McMullen MP, Draper MA, et al., 2008. Efficacy of triazole-based fungicides for Fusarium head blight and deoxynivalenol control in wheat: A multivariate meta-analysis. Phytopathology 98(9):999-1011.
[https://doi.org/10.1094/PHYTO-98-9-0999]

-
Rai A, Irulappan V, Senthil-Kumar M, 2022. Dry root rot of chickpea: A disease favored by drought. Plant Dis. 106(2):346-356.
[https://doi.org/10.1094/PDIS-07-21-1410-FE]

-
Reznikov S, Vellicce GR, Gonza´lez V, de Lisi V, Castagnaro AP, Ploper LD, 2016. Evaluation of chemical and biological seed treatments to control charcoal rot of soybean. J. Gen. Plant Pathol. 82:273-280.
[https://doi.org/10.1007/s10327-016-0669-4]

-
Saleh AA, Ahmed HU, Todd TC, Travers SE, Zeller KA, et al., 2010. Relatedness of Macrophomina phaseolina isolates from tallgrass prairie, maize, soybean and sorghum. Mol. Ecol. 19(1):79-91.
[https://doi.org/10.1111/j.1365-294X.2009.04433.x]

-
Short GE, Wyllie TD, Bristow PR. 1980. Survival of Macrophomina phaseolina in soil and residue of soybean. Phytopathology 70(1):13-17.
[https://doi.org/10.1094/Phyto-70-13]

-
Spolti P, Jorge BCD, Ponte EMD, 2012. Sensitivity of Fusarium graminearum causing head blight of wheat in Brazil to tebuconazole and metconazole fungicides. Trop. Plant Pathol. 37(6):419-423.
[https://doi.org/10.1590/S1982-56762012000600007]

-
Tateishi H, Miyake T, Mori M, Kimura R, Sakuma Y, et al., 2010. Sensitivity of Japanese Fusarium graminearum species complex isolates to metconazole. J. Pestic. Sci. 35(4):419-430.
[https://doi.org/10.1584/jpestics.G09-67]

-
Tonin RFB, Avozani A, Luiz A, Danelli D, Reis EM, et al., 2013. In vitro mycelial sensitivity of Macrophomina phaseolina to fungicides. Pesq. Agropec. Trop. 43(4):460-466.
[https://doi.org/10.1590/S1983-40632013000400014]

-
Vigntelli A, Hilber-Bodmer M, Hilber UW, 2002. Genetic analysis of resistance to the phenylpyrrole fludioxonil and the dicarboximide vinclozolin in Botryotinia fuckeliana (Botrytis cinerea). Mycol. Res. 106(3):329-335.
[https://doi.org/10.1017/S0953756202005683]

-
White TJ, Bruns T, Lee S, Taylor J, 1990. Amplifcation and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In M. A. Innis, D. H. Gelfand, J. J. Sninsky, & T. J. White (Eds.), PCR protocols: A guide to methods and applications (pp. 315-322). San Diego: Academic Press
[https://doi.org/10.1016/B978-0-12-372180-8.50042-1]

-
Wu X, Bian Q, Lin Q, Sun Q, Ni X, et al., 2020. Sensitivity of Puccinia graminis f. sp. tritici isolates from China to triadimefon and cross-resistance against diverse fungicides. Plant Dis. 104(8):2082-2085.
[https://doi.org/10.1094/PDIS-01-20-0009-RE]

-
Zhou F, Li DX, Hu HY, Song YL, Fan YC, et al., 2020. Biological characteristics and molecular mechanisms of fludioxonil resistance in Fusarium graminearum in China. Plant Dis. 104(9):2426-2433.
[https://doi.org/10.1094/PDIS-01-20-0079-RE]

Heung Tae Kim, Department of Plant Medicine, College of Agriculture, Life and Environment Science, Chungbuk National University, Professor, https://orcid.org/0000-0001-7132-0587
So Hyeon Ahn, Department of Plant Medicine, College of Agriculture, Life and Environment Science, Chungbuk National University, MS student
Ji Young Choi, Department of Plant Medicine, College of Agriculture, Life and Environment Science, Chungbuk National University, MS’s graduate
Establishment of experimental plan and methodology proposal, Heung Tae Kim
Experimental participation, So Hyeon Ahn and Ji Young Choi
Writing, Heung Tae Kim, So Hyeon Ahn
