벼 재배 토양 중 butachlor 및 oxadiazon의 수계 노출 행적 구명
초록
본 연구에서는 벼 재배 토양 중 butahlcor 및 oxadiazon의 행적을 구명하기 위해 실시하였다. 논 토양에 butachlor 및 oxadiazon을 농약안전사용기준에 맞춰 살포한 후 0, 1, 4, 7, 11, 18, 23, 30, 45일에 토양, 논물 및 배수된 물 시료를 채취하여 잔류량을 분석하였다. 벼를 실제 재배하는 토양 반감기를 SFO (Single First Ratio Model)를 활용해 산출하였고, 농약의 수계 노출 행적을 구명하기 위해 논물과 배수된 물의 경시적 잔류량을 비교 분석하였다. 벼 재배 토양 중 butachlor 및 oxadiazon의 DT50 및 DT90은 9.2, 21.7일과 30.7, 72.0일이었다. 또한 농약의 수계 이동 양상은 butachlor는 살포 직후 논물 잔류량은 0.777 μg/L이었고 살포 4일 후 불검출 되었으며, oxadiazon의 초기 잔류량은 1.578 μg/L에서 농약 살포 45일 후 0.057 μg/L로 실험기간 동안 농약이 검출되었다. 배수된 물에서 butachlor는 모든 시기에 불검출 되었고, oxadiazon은 배수 시점(살포 7일 후)부터 20일간 0.039-0.111 μg/L 수준으로 검출되었다. 토양 흡착성이 높은 butachlor는 논에서 배수 과정 중 수계노출 가능성은 낮을 것으로 판단되면, 상대적으로 흡착능력이 낮은 oxadiazon은 기준량을 초과하여 사용할 경우 수계 노출 우려가 있을 것으로 판단된다.
Abstract
In this study, the degradation rate and water exposure of butachlor and oxadiazon in paddy soil were investigated. Butachlor and oxadiazon were sprayed on the paddy fields according to pesticide safety standards, and the pesticide residues in the paddy soil, water and drainage water were analyzed at 0, 1, 4, 7, 11, 18, 23, 30 and 45 days. The DT50 and DT90 in paddy soils were calculated by single first-order rate (SFO) and water exposure were identified by analyzing paddy water and drainage water. As a result, The DT50 and DT90 of butachlor and oxadiazon in paddy soil were 9.2, 21.7 days and 30.7, 72.0 days. The initial concentration of butachlor in paddy water was 0.777 μg/L, which detectecd at 0.085-0.411 μg/L until 4day after treatment. At drainge water, butachlor were detected less than LOQ. Oxadiazon was 1.578 μg/L in paddy water at the initial time and were continuously detected until 45 days (0.057-1.342 μg/L). During draining paddy water (7days after treatment), oxadiazon were detected at 0.039-0.111 μg/L for 20 days in paddy water. In conclusion, butachlor which has the property of highly adsorbable to soil is difficult to be exposed to surface water. When overused at paddy fields, oxadiazon which has migrated from soils can be detected at surface water.
Keywords:
butachlor, oxadiazon, fate, paddy soil, water exposure키워드:
뷰타클로르, 옥사디아존, 논 토양, 수계 노출, 행적서 론
농약의 사용은 병·해충, 잡초를 방제하는데 큰 기여를 하여 농업의 생산성 증대, 노동력 절감 및 농산물의 질을 향상시켰다(Masia et al., 2015; Yun et al., 2009). 살포된 농약은 1차적으로 토양에 유입되어 광분해, 가수분해, 미생물 분해, 휘산, 식물체로 흡수 및 용탈 등의 과정을 거치게 되고(Chen et al., 1978; Nicholls et al., 1988; Park et al., 2006; Park et la., 2011), 일부 농약은 하천수 등 수계로 이동하여 2차 오염을 유발할 수 있다(Ccanccapa et al., 2016; Konstantinou et al., 2006.). 국내 하천수에서도 농업활동 중 사용한 농약들이 검출되었고, 주로 수도용 농약의 검출율이 높았다. Kim et al. (2017)의 2002년 금강, 만경-동진강에서는 butachlor, diazinon, iprobenfos 및 isoprothiolane 등 수도용 농약이 5~50%로 높은 수준으로 검출되었고, Kim et al. (2019)의 2012, 2014년 시기별 한강 수계 조사에서는 butachlor, carbofuran, iprobenfos, isoprothiolane, hexaconazole 및 oxadiazon 등 주로 검출되었다. 2018년 전국 하천수의 4, 7월 조사결과에서는 butachlor, chlorantraniliprole, isoprothiolane, oxadiazon, tricyclazole이 시기별 10% 이상으로 검출되었다(Hwang et al., 2019). 국내 논 토양 중 99, 03, 07년도 모니터링 결과에서도 b utahlcor 및 oxadiazon은 제초제 중에서 1, 2 번째로 검출빈도가 높은 것으로 나타났다(Park et al., 2011; Park et al., 2013). 논 토양 및 하천수에서 두 농약은 지속적으로 높은 빈도로 검출되는 것을 확인할 수 있었다.
Butachlor 및 oxadiazon은 수도용 제초제로 일년생 잡초 방제 목적으로 이앙 전에 토양에 직접적으로 처리한다. 그렇기 때문에 살포기를 사용한 것에 비하여 높은 농도로 토양에 잔류하는 경향이 있으며, 농약 사용시기에 주변 하천수로 이동하여 다빈도로 검출될 우려가 있다(Hwang et al., 2019). Kim et al. (2012)의 연구에서는 농민들이 선호하는 제초제로 butachlor와 oxadiazon이 상위 2종으로 조사되었고, 농약연보(2020)에서 출하량이 559,250 kg 및 46,200 kg으로 다른 농약에 비하여 사용량이 높았다.
Butachlor는 잠재적인 발암물질 및 수생태계 독성이 높은 것으로 알려져 있으며(Ou et al., 2001), Huang et al. (2020)의 연구에서는 제브라피쉬에서 butachlor와 oxadiazon이 심장 결함과 농도가 증가할수록 심박수 및 혈류 감소 등 영향을 주는 것으로 보고하였다. 두 농약은 매년 영농활동에서 사용되고 4-5월 사용시기에 높은 빈도로 노출되어 수서 생태계에 부정적 영향을 줄 수 있기 때문에 안전관리 방안 모색이 필요하다.
안전관리 방안 마련을 위해서는 모니터링, 노출량 및 노출경로 파악과 위해성 평가가 필요하다. 두 농약에 대한 연구는 모니터링(Kim et al., 2017; Kim et al., 2019; Hwang et al., 2019), 생태 독성(Ou et al., 2001; saravanan et al., 2017; Huang et al., 2020) 및 환경 위해성 평가(Park et al., 2009; Lee et al., 2011; Hwang et al., 2019)가 진행되었다. 그러나 논 토양에 살포한 농약이 어떻게 수계로 노출되는지에 대한 행적 구명 연구는 국내에 부족한 실정이다.
이번 연구에서 벼 재배과정 중 살포된 butachlor 및 oxadiazon의 벼 재배 토양 중 경감양상 구명과 논물 및 배출수로의 이동과정을 경시적으로 관찰하여 노출양상을 파악하였다.
재료 및 방법
시험농약 선정 및 시약
시험 농약은 논토양(Park et al., 2013; Lee and Park, 2011) 및 하천수에서 주로 검출되는 butachlor 및 oxadiazon을 선정하였다. 분석에 사용한 표준품은 1,000 mg/L stock solution을 Kemidas (Korea, Suwon)에서 구매하여 사용하였고, 각 농약은 acetonitrile (ACN)로 희석하여 10 mg/L의 working solution을 제조하였다. 분석에 사용한 용매 acetonitrile, acetic acid (100%) 및 formic acid (>98% purity)을 Merck사(Darmstadt, Germany)의 HPLC Grade를 구매하여 사용했다. 분석기기의 이동상 용매에 사용한 ammonium acetate (99% purity)는 Sigma Aldrich (St, Louis, MS, USA)에서 구입하여 사용하였다. 3차 증류수는 Millipore사의 Milli-Q-system (Bedford, USA)을 사용하였다. QuEChERS 전처리 시약 및 제품은 Agilent (St. Louis, USA)에서 구매하였다.
포장실험
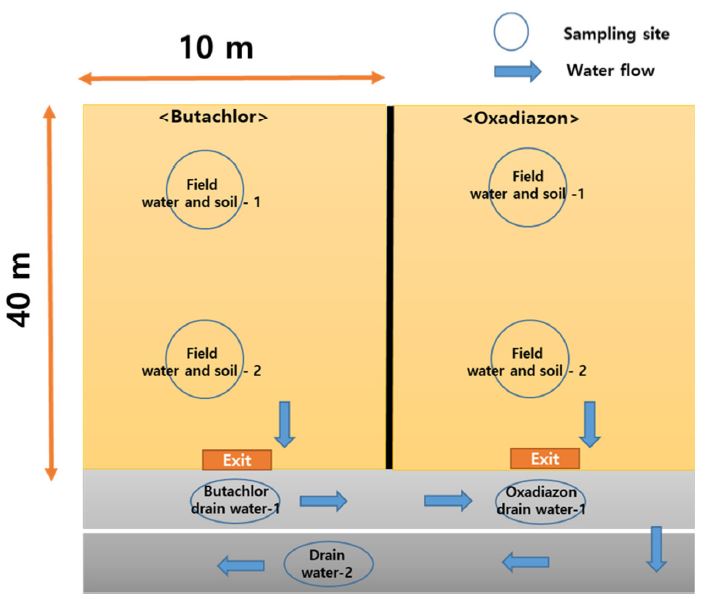
노출경로 구명 연구는 전라북도 완주군 국립농업과학원 논 포장에서 실시하였다. 실험은 2020년 6월 4일부터 7월 16일까지 실시하였고, butachlor (58.8%, EC), oxadiazon (12%, EC)을 사용하였다. 시험 농약은 농약안전사용기준(butachlor: 300 mL/10a, oxadiazon: 400 mL/10a)에 맞춰서 벼 이앙 3일 전 6월 4일에 살포하였고, 살포 방식은 농약 유제를 담수 된 상태의 논 토양에 골고루 살포하였다. 토양과물 시료는 지정된 장소에 농약 살포 후 0(6시간 후), 1, 4, 7(1차 배수), 14, 18, 23, 30, 45일에 채취하였으며, 시험기간 동안 벼는 이앙 후 42일 재배하였고, 실험은 출수기 전까지 실시하였다.
토양 시료 채취는 논 토양 시료 채취기를 이용하여 표토 10 cm을 지정된 장소 5구역에서 1 kg 채취하여 플라스틱 용기에 옮겨 담았다. 채취한 시료는 음건조건에서 토양수분 6% (v/v)이하 수준으로 건조한 후 분석 전까지 냉동(-20°C) 조건에서 보관하였다.
물 시료는 지정된 장소에서 1/3지점의 물을 1 L 채수용기에 담은 후 실험실로 운반하여 바로 전처리 하였다. 시료 채취 구역은 Fig. 1과 같이 구분하여 논 토양에서 물이 배수되는 지점과 20 m 떨어진 지점에서 물시료를 채취하였다. 채취한 물 시료는 실험실로 운반하여 24시간 이내에 분석하였다.
잔류농약 분석
토양 중 butachlor 및 oxadiazon은 QuEChERS를 변형한 분석법을 이용하였다. 음건한 토양 시료를 충분히 섞어준 후 10 g을 50 mL 플라스틱 튜브에 칭량 후 10 mL 1차 증류수를 첨가한 후 30분간 정치하였다. 농약 추출을 위해서 1% acetic acid가 포함된 acetonitrile을 10 mL 첨가한 후 수직진탕기를 이용하여 1,300 rpm에서 2분간 추출하였다. 추출된 시료에 4 g MgSO4 및 1 g MgCl2를 첨가한 후 30초간 격렬히 흔들어준 후 3,500 rpm에서 5분간 원심분리 하였다. 원심분리된 시료의 상등액 6 mL를 900mg MgSO4 및 150 mg PSA가 포함된 15 mL 플라스틱 옮겨 담은 후 1분간 격렬하게 흔들어 주었다. 시료를 3,500 rpm에서 5분간 원심분리 한 후 상등액을 Celite 545가 첨가된 syringe에 통과시켰다. 여과시킨 500 μL 시료와 500 μL ACN를 1:1의 비율로 2 mL vial에 옮긴 후 LC-MS/MS를 이용하여 분석하였다.
채취한 시료는 Whatman No. 6 여지를 이용하여 감압 여과한 후 200 mL를 취하여 분액여두로 옮긴 후 primicarb D6 내부표준물질과 포화 식염수 50 mL를 넣어주었다. 시료 내 불순물 정제를 위해서 dichloromethane (DCM; Merck, Darmstadt, Germany) 100 + 50 mL (2회 첨가)를 가하여 2분간 격렬하게 흔들어 준 후 DCM층을 anhydrous sodium sulfate에 통과시켜 감압농축(40°C 이하) 하였다. 감압농축 후 acetonitrile 2 mL로 재용해했고, 재용해 한 시료를 0.2 μm PTFE filter (Silicycle, Canada)를 통과시킨 후 LC-MS/MS (Agilent 6470, USA)로 기기분석 하였다.
기기분석 조건
시험농약 분석으로 사용된 기기는 Agilent 1260 HPLC에 Agilent 6470 triple-quadrupole mass spectrometer가 장착된 LC-MS/MS를 이용하였다. 이동상은 5 mM ammonium formate와 0.1% formic acid가 첨가된 water와 methanol 용액을 사용하였다. 분석에 사용된 column은 Agilent Eclipse PlusC18 RRHD 1.8 μm (50 × 2.1 mm, USA)을 이용하였다. LC-MS/MS의 multiple reaction monitoring (MRM) 조건으로 ESI positive mode를 이용하여 분석하였으며, 기기분석 조건은 Table 1과 같다.
결과 및 고찰
토양 및 농업용수 중 회수율 결과
토양 및 농업용수 중 시험농약의 회수율 시험은 토양은 0.01, 0.1 mg/kg으로 논물은 0.1, 1.0 μg/L를 첨가하여 3반복으로 진행했다. 회수율 시험을 위해 토성이 다른 2가지 토양(Table 2)과 수돗물을 이용하였다. 시료 내 농약의 정량분석을 위해서 토양은 Matrix Matched Calibration (MMC)을 사용했고, 농업용수는 내부표준법을 사용했다. 검량선 작성을 위해서 사용한 농도는 토양 및 농업용수 0.001, 0.005, 0.01, 0.025, 0.05, 0.1, 0.25 mg/L이었다. 검량선의 직선성은 R2값이 0.99이상으로 양호하였고, 토양 및 농업용수의 분석 장비의 정량한계(LOQ, Limit Of Quantitation)는 S/N 비율이 10이 되는 농도인 0.005 mg/kg이었고, 분석법 정량한계(MDL, Method Detection Limit)은 토양 0.01 mg/kg, 농업 용수는 0.05 μg/L이었다. 토양 및 농업용수의 회수율은 적정 범위 내로 Table 3과 같다.
벼 재배 토양 중 butachlor 및 oxadiazon의 경시적 잔류 양상
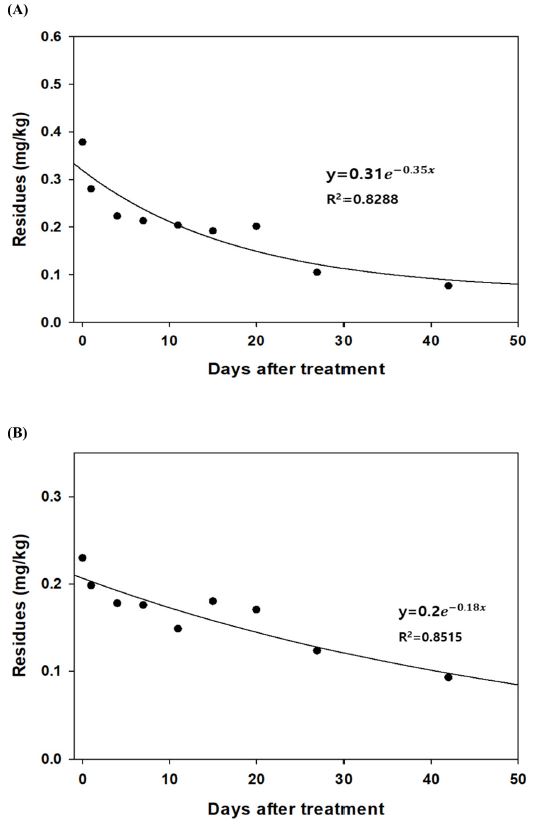
벼 재배 토양 중 butachlor 및 oxadiazon의 반감기를 SFO (Single First-Order Rate Model) 를 활용하여 산출하였다. 두 농약의 초기 잔류량은 0.378 mg/kg, 0.230 mg/kg이었고, DT50는 9.2, 21.7일 DT90은 30.7, 72.0일 산출되었다(Table 4, Fig. 2). 농약특성데이터(PPDB, (Pesticide Properties Data Base))에서는 현장에서 호기성 조건 토양에서 butachlor, oxadiazon의 DT50은 11.5, 90-330일이었고, DT90은 oxadiazon에서 298-1085일로 확인되었다. 이번 연구에서 경감속도가 빠르게 나타났다. Cho et al. (2020) 연구에서 실험실 조건의 논토양에서 butachlor의 DT50, DT90은 25.3, 84.0일로 PPDB의 호기조건의 토양보다는 경감율이 빠르고 이번 연구와 비교하면 낮은 것을 확인할 수 있었다. Ying et al. (2000)은 포도밭에서 oxadiazon 등 제초제의 감소양상 구명 연구에서 14일로 PPDB의 반감기와 9-23배 정도 감소율이 빨랐으며, 이번 연구와 비교하였을 때 2배 정도 빠른 것으로 나타났다. 토양 중 농약 분해율은 유기물 함량, pH, 미생물 등 조건에 따라 달라진다(Chen and Chen, 1979; Samanta et al., 1999; Sarmah and Sabadie, 2002; Vulliet et al., 2004; Zheng et al., 2008). 그러나 기존 토양 반감기 산출은 호기성 조건에 대한 진행한 데이터는 많지만 국내 조건에 맞는 담수 조건에서 연구는 부족하다. 이에 따라, 토양 중 노출 등 행적을 통한 안전관리를 위해서는 기초 데이터를 지속적으로 확보하는 것일 필요할 것으로 판단된다.
벼 재배 토양 중 butachlor 및 oxadiazon의 이동양상 구명
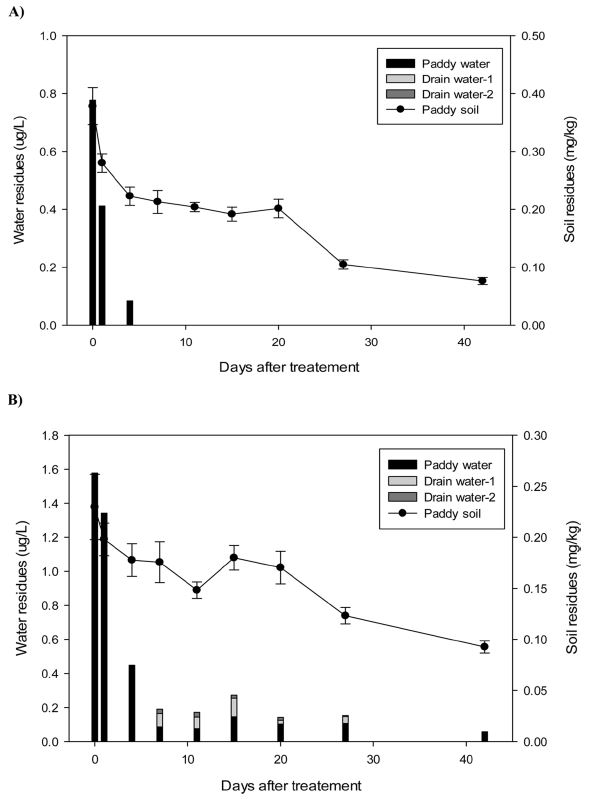
하천수 중 다빈도 검출 농약 butachlor, oxadiazon의 검출 원인이 논물 유출에 의한 것인지 확인하기 위해 이동 양상을 확인하였다. 시험농약 butachlor 및 oxadiazon의 토양 초기 잔류량은 0.378, 0.230 mg/kg이었고, 논물의 초기 잔류량은 0.777, 1.578 μg/L였다.
논물 중 butachlor 잔류양상은 살포 직후 0.777 μg/L이었고, 4일 후 0.08 μg/L 검출 이후 LOQ 이하로 검출되었다. 배출수 중 butachlor의 잔류량은 모든 시기에 LOQ 이하로 검출되었다. Moon and Kim (2000)의 연구에서 butachlor의 수중 반감기는 1.6일로 매우 빨랐고, 흡착비율도 45-70% 수준으로 다른 시험농약 oxadiazon, pretilachlor, thiobencarb보다 높았다. 또한 butachlor는 자연광 조건에서 수계 분해가 촉진되어서(Ok et al., 2014), 논물에서 살포 4일 후 LOQ 이하로 검출되었고, 배출수로 이동하지 않은 것으로판단된다. Butachlor의 Koc는 700으로(PPDB) oxadiazon에 비하여 낮지만 분자의 N-O 화학적 구조가 양쪽성 이온 특성을 가져 토양 흡착 능력이 높은 것으로 판단된다. Butachlor의 수용해도는 20 mg/L로 다른 농약에 비하여 낮은 수으로 토양에 흡착된 후 논물로 용해가 어렵기 때문에 농약 살포 4일 후 LOQ 이하로 검출된 것으로 판단된다. 이에 따라 배수로로 배출되는 물과 20 m 떨어진 시료채취 지점에 모두 LOQ 이하로 검출되었다. 하천수 중 butachlor 검출은 토양 중 잔류한 성분이 논의 물빼기 과정에서 유출되기보다는 비산 등 다른 요인에 의한 영향으로 판단된다.
Oxadiazon의 토양 잔류량은 0.093-0.230 mg/kg이었고, 논물의 잔류량은 0.057-1.578 μg/L로 조사되었다. 배출수의 잔류량은 배수시점(농약 살포 7일 후)부터 약 20일 동안 0.039-0.111 μg/L로 검출되었고, 약 20 m 떨어진 시료채취 지점에서 배수시점부터 14일 후까지 0.017-0.030 μg/L로 검출되었다. Oxadiazon의 호기성 조건에서 토양 반감기는 90-330일이고 수중 반감기는 17일로 butachlor보다 안정적인 특징을 가지고 있다. Moon and Kim (2020)의 연구에서도 수중 반감기 2.0일로 butachlor (1.7일)보다 길었으며, 토양 흡착능력도 butachlor보다 낮게 나타났다. 수계에서 butachlor보다 안정한 특성과 토양 중 잔류성분이 논물로 쉽게 유출되어 butachlor보다 토양 초기 잔류량이 낮음에도 불구 하고 높은 잔류량을 나타낸 것으로 판단된다. 배수 후에는 butachlor는 LOQ 이하로 검출된 것과 달리 0.022-0.111 μg/L와 배수로에서 20 m 떨어진 지점에서 배수 후 14일 동안 0.017-0.030 μg/L로 배수로 지점의 16-78% 수준의 농도로 검출되어 희석효과가 나타나는 것으로 확인되었다. 실험결과를 통해 oxadiazon은 안전사용기준을 초과하여 사용할 경우 토양 및 논물에 잔류한 농약이 배수되면서 주변 수계에 노출될 우려가 있다. 그러나 안전사용기준에 준수하여 농약을 사용한다면 배수할 때 수계로 노출될 가능성은 낮을 것으로 판단된다. 또한 농약이 20 m를 이동할 때도 잔류량의 16-78% 수준의 농도로 낮아지는 것으로 보아 논 주변 하천수에서만 벼의 물빼기 과정 중 노출될 우려가 있다. 그러나 실제 재배현장과 다양한 농약을 이용한 수계 노출 연구는 지속적으로 수행할 필요가 있을 것으로 사료된다.
Acknowledgments
본 연구는 농촌진흥청 국립농업과학원 농업과학기술 연구개발사업(과제번호: PJ014488)의 지원에 의해 수행되었으며, 이에 감사합니다.
References
-
Ccanccapa A., Masiá A, Navarro-Ortega A, Picó Y, Barceló D, et al., 2016. Pesticides in the ebro river basin: occurrence and risk assessment. J. Environ. Pollut. 211:414-424.
[https://doi.org/10.1016/j.envpol.2015.12.059]

-
Chen YL, Wu TC, 1978. Degradation of herbicide butachlor by soil microes. Korean J. Pesticide Sci. 3(4):411-417.
[https://doi.org/10.1584/jpestics.3.411]

-
Chen YL, Chent JS, 1979. Degradation and dissipation of herbicide butachior in paddy fields. Korean J. Pesticide Sci. 4(4), 431-438.
[https://doi.org/10.1584/jpestics.4.431]

- Cho YJ, An JY, Jung JH, Jung SH, Lim JS, et al., 2020. Metabolic study of [14C]butachlor in paddy soil. Korean J. Pestic. Sci. 24(1):71-81.
- Environmental Protection Agency (EPA), 2022. Guidance to calculate representative half-life values and characterizing pesticide degradation. https://www.epa.gov/pesticide-science-and-assessing-pesticide-risks/guidance-calculate-representative-half-life-values, .
-
Hwang IS, Oh YJ, Kwon HY, Ro JH, Kim DB, et al., 2019. Monitoring of pesticide residues concerned in stream water. Korean J. Environ. Agri. 38(3):173-184.
[https://doi.org/10.5338/KJEA.2019.38.3.21]

-
Huang Y, Ma J, Meng Y, Wei Y, Xie S, et al., 2020. Exposure to oxadiazon-butachlor causes cardiac toxicity in zebrafish embryos. Environ. Pollut. 265:114775.
[https://doi.org/10.1016/j.envpol.2020.114775]

-
Kim CS, Lee J, Won TJ, Seo YH, Kim EJ, et al., 2012. Fact-finding survey on occurrence of paddy field weeds and the use of paddy field herbicides at farmer's level in Korea. Weed & Turfgrass Sci. 1(4):6-12.
[https://doi.org/10.5660/WTS.2012.1.4.006]

-
Kim CS, Lee HD, Ihm YB, Son KA, 2017. Temporal patterns of pesticide residues in the Keum, Mangyung and Dongjin rivers in 2002. Korean J. Envir. Agri., 36(4):230-240.
[https://doi.org/10.5338/KJEA.2017.36.4.38]

-
Kim CS, Lee HD, Son KA, Lee EY, Oh JA, 2019. Occurrence of pesticide residues in han river basin in 2012 and 2014. Korean J. Envir. Agri., 38(4):338-351.
[https://doi.org/10.5338/KJEA.2019.38.4.45]

-
Konstantinou IK, Hela DG, Albanis TA, 2006. The status of pesticide pollution in surface waters (streams and lakes) of greece. Part I. review on occurrence and levels. Environ. Pollut. 141(3):555-570.
[https://doi.org/10.1016/j.envpol.2005.07.024]

-
Masiá A, Campo J, Vázquez-Roig P, Blasco C, Picó Y, 2013. Screening of currently used pesticides in water, sediments and biota of the Guadalquivir stream Basin (Spain). J. Hazar. Materials. 263(Part-1):95-104.
[https://doi.org/10.1016/j.jhazmat.2013.09.035]

- Moon YH, Kim YS, 2000. Dissipation in surface water and adsorption in soil of butachlor, oxadiazon, pretilachlor and thiobencarb. Korean J. Pestic. Sci. 20(1):32-38.
-
Nicholls PH, 1988. Factors influencing entry of pesticides into soil water. Korean J. Pestic. Sci. 22(2):123-137.
[https://doi.org/10.1002/ps.2780220204]

-
Ok JH, Watanabe H, Cho J, An N, Lee B, 2014. Photodegradation of butachlor and pyrazosulfuron-ethyl in rice paddy water under natural sunlight. Korean J. Envir. Agri. 33(2):134-137.
[https://doi.org/10.5338/KJEA.2014.33.2.134]

-
Ou YH, Chung PC, Chang YC, Ngo FQ, Hsu KY, et al., 2000. Butachlor, a suspected carcinogen, alters growth and transformation characteristics of mouse liver cells. Chem. Res. Toxicol. 13(12):1321-1325.
[https://doi.org/10.1021/tx990076c]

-
Saravanan M, Kim JY, Hur KJ., Ramesh M, Hur JH, 2017. Responses of the freshwater fish Cyprinus carpio exposed to different concentrations of butachlor and oxadiazon. Biocatalysis and Agri. Biotech. 11:275-281.
[https://doi.org/10.1016/j.bcab.2017.06.011]

-
Samanta S, Kole, RK, Chowdhury, A, 1999. Photodegradation of metsulfuron methyl in aqueous solution. Chemosphere. 39(6):873-879.
[https://doi.org/10.1016/S0045-6535(99)00029-6]

-
Sarmah AK, Sabadie J, 2002. Hydrolysis of sulfonylurea herbicides in soils and aqueous solutions: a review. J. Agri. and Food Chem. 50(22):6253-6265.
[https://doi.org/10.1021/jf025575p]

- Park BJ, Kim CS, Park KH, Park HJ, Im GJ, et al., 2006. Distribution and mobility of herbicide 14C-molinate in a rice-paddy-soil lysimeter. Korean J. Pestic. Sci. 10(3):172-182.
- Park BJ, Lee JH, 2011. Pesticide residue monitoring and environmental exposure in paddy field soils and greenhouse soils, Korean J. Pesti. Sci. 15(2):134-139.
-
Park BJ, Lee BM., Kim CS, Park KH, Park SW, et al., 2013. Long-term monitoring of pesticide residues in arable soils in Korea. Korean J. Pestic. Sci., 17(4):283-292.
[https://doi.org/10.7585/kjps.2013.17.4.283]

-
Vulliet E, Emmelin C, Chovelon JM, 2004. Influence of pH and irradiation wavelength on the photochemical degradation of sulfonylureas. J. Photochem. and Photobio A: Chem. 163(1-2):69-75.
[https://doi.org/10.1016/S1010-6030(03)00434-9]

-
Ying GG, Williams B, 2000. Dissipation of herbicides in soil and grapes in a south australian vineyard. Agri., Ecosys, & Envir, 78(3):283-289.
[https://doi.org/10.1016/S0167-8809(99)00127-9]

- Yun HC., Park JH, Cha KS, Youn JB, Jeong JH, et al., 2009. Monitoring the residual pesticide levels of soil and water from the main agricultural area in Busan (II). The Annual Report of Busan Metropolitan City Institute of Heath & Environment 19(1):72-80.
-
Zheng W, Yates SR, Papiernik SK, (2008). Transformation kinetics and mechanism of the sulfonylurea herbicides pyrazosulfuron ethyl and halosulfuron methyl in aqueous solutions. J. Agric. Food Chem. 56(16):7367-7372.
[https://doi.org/10.1021/jf800899e]

Hyo-Sub Lee, Residual Agrochemical Assessment Division, National Institute of Agricultural Sciences, Rural Development Administration, Researcher, https://orcid.org/0000-0002-7021-2514
Gun-Hee Jeung, Residual Agrochemical Assessment Division, National Institute of Agriculural Sciences, Rural Development Administration, Reseracher
Hyang-Hee Kim, Residual Agrochemical Assessment Division, National Institute of Agricultural Sciences, Rural Development Administration, Reseracher
Ji-Min Choi, Residual Agrochemical Assessment Division, National Institute of Agricultural Sciences, Rural Development Administration, Reseracher
Won-Tae Jeong, Residual Agrochemical Assessment Division, National Institute of Agricultural Sciences, Rural Development Administration, Researcher
Su-Myeong Hong, Residual Agrochemical Assessment Division, National Institute of Agricultural Sciences, Rural Development Administration, Researcher