Mesua ferrea L. 열매 유래 탄저병원균 Colletotrichum fructicola에 대한 항진균 활성물질 탐색
초록
탄저병 원인균인 Colletotrichum fructicola에 대한 친환경 농자재 개발을 목적으로 Mesua ferrea 열매의 추출물로부터 항진균 활성물질을 탐색하였다. Mesua ferrea 열매의 MeOH 추출물을 hexane, chloroform, ethyl acetate, butanol, aquous로 순차적으로 용매분획 하였고, 생물검정 결과 가장 강한 활성을 보인 hexane fraction을 silica gel column chromatography하여 활성물질을 분리·정제 하였다. 최종 항진균 활성분획으로 분리·정제한 HSSC-6, HSSC-8 subfraction을 GC-MS로 분석한 결과 α-copaene과 kaur-16-ene으로 각각 구조동정 되었다. α-copaene의 EC50은 73.4 ppm, kaur-16-ene의 EC50은 57.3 ppm으로 나타났으며, kaur-16-ene의 활성이 α-copaene 보다 다소 강한 활성을 가진 것으로 확인이 되었다. 따라서, C. fructicola ICKb132에 대한 Mesua ferrea 열매의 추출물이 항진균 활성의 효과를 나타내었으므로, 친환경 유기농자재로 개발이 가능할 것으로 판단되었다.
Abstract
For the purpose of developing eco-friendly agricultural materials for Colletotrichum fructicola, the causative agent of anthracnose, antifungal active substances were explored from extracts of Mesua ferrea fruits. The methanol extract of the fruit of Mesua ferrea was sequentially subjected to solvent fractionation with hexane, chloroform, ethylacetate, butanol, and aqueous. As a result of the biological test, the active substance was separated and purified with silica gel column chromatography for hexane fraction, which showed the strongest activity. As a result of GC-MS analysis of HSSC-6 and HSSC-8 subfractions isolated and purified as final enhancement active fractions, the structures were identified as α-copaene and kaur-16-ene, respectively. The EC50 of α-copaene and kaur-16-ene were 73.4 ppm and 57.3 ppm, respectively. it was confirmed that the activity of kaur-16-ene was somewhat stronger than that of α-copaene. Therefore, since the extract of Mesua ferrea fruit exhibited antifungal activity against C. fructicola ICKb132, the causative agent of anthracnose, it was judged to have the possibility of development as an eco-friendly agricultural material.
Keywords:
Antifungal active substance, Colletotrichum fructicola, Mesua ferrea, α-Copaene, Kaur-16-ene키워드:
항진균활성물질, 탄저병서 론
Colletotrichum속 병원균은 고추, 오이, 수박, 딸기 등의 과채류와 같은 경제적으로 중요한 작물에 탄저병을 일으키는 대표적인 다범성 병원균으로(Park et al., 2004; Bailey et al., 1992; Elmer et al., 2001) 식물의 잎, 줄기, 열매 등에 궤양이나 괴사를 발생시킨다. 감자의 흑점뿌리썩음병 유발인자이며, 박과(Cucurbitaceae), 콩과(Leguminosae), 가지과(Solanaceae) 등의 식물 생장에 영향을 미쳐 과일과 채소류의 작물 생산에 경제적으로 피해를 주고 있는 것으로 보고되고 있다(Dillard, 1988; Han, 2017; Park and Kim, 1992; Ben-Daniel et al., 2009; Lees and Hilton, 2003).
자낭균(Ascomycota)의 일종인 Colletotrichum spp.는 Fungi 계 Ascomycota문 Sordariomycetes강 Glomerellales목 Glomerellaceae과 Colletotrichum속에 속한다. Colletotrichum fructicola는 C. gloeosporioides species complex에 포함되며(Weir et al., 2012), 최근 국내에서는 C. fructicola ICKb132에 의한 탄저병이 복숭아에서 보고되었다(Lee et al., 2020).
해외의 경우 Prihastuti et al. (2009)과 Ro jas et al. (2010)은 C. fructicola가 태국, 일본, 이스라엘, 미국, 호주, 독일, 브라질, 나이지리아, 파나마 등지에서 발견되었고 생물학적, 지리학적 다양성을 가지고 있는 것으로 보고하였으며, Fuentes-Aragóna et al. (2018)은 아보카도(Persea americana)와 체리모야(Annona cherimola), 커피(Coffea arabica), 사과(Malus domestica), 복숭아(Prunus persica), 망고(Mangifera indica), 동백나무(Camellia oleifera) 등 다양한 작물을 감염시키는 것으로 보고하였다.
국내에서는 탄저병균에 의한 병해 방제를 위해 물리적 방제, 경종적 방제, 화학적 방제 등 여러 방제 방법이 이용되고 있으나, 대부분 화학농약을 사용하는 화학적 방제 방법에 의존하는 경향이 있다(Lee et al., 2008). Maneb, Thiabenda-zole, Imazalil, Captafol, Prochloraz, Thiram, Silver Nanoparticle을 기반으로 한 화학 농약에 관한 연구(Han, 2017; Uribe and Loria, 1994; Marais, 1990; Lee et al., 2013), 여러 종의 식물의 잎과 뿌리 추출물을 이용한 친환경적 방제를 위한 생물학적 연구(Manasi et al., 2014), Streptomyces phaeopurpureus를 이용한 연구(Palaniyandi et al., 2013) 등이 진행되었다.
화학적 방제 기법을 적용하기 위해 널리 사용되고 있는 유기합성 농약은 사용의 편리성으로 인한 오·남용과 사용자에게 누적되는 인축독성, 저항성 출현의 문제뿐만 아니라 토양과 수질을 오염 시킬 가능성이 있으며, 나아가 생태계를 교란하고 농산물의 안전성을 위협하는 등 다양한 부작용이 발생(Ames, 1979; Delp, 1988; Staub and Sozzi, 1984) 되는 현상으로 인해 국내·외에서 유기합성농약 사용을 줄이고 친환경적 농업을 장려하고 있는 추세이다(Lee et al., 2008; Glick et al., 2007).
본 실험에서 선정한 Mesua ferrea는 아시아의 아열대 지역에 분포하는 중대형 상록 관상수이다. 어린잎은 외관이 적황색, 성숙한 잎은 외관이 청회색에서 짙은 녹색이고 길이는 약 7~15 cm이다. 꽃은 크며 중앙에 수많은 노란색 수술이 있고 4개의 흰색 꽃잎과 향기가 있다. 열매는 난형이고 1~4개의 씨가 들어 있으며 나무의 형태는 외관상 우거진 모양으로 수피는 적갈색이다(Asif et al., 2017). 이 식물의 꽃, 열매, 씨, 잎은 식용이 가능하며 질병 치료를 위해 민간요법으로 해열제, 항균제, 항암제, 이뇨제, 거담제 등에 사용되고 있다(Chahar et al., 2011). Mesua ferrea로부터 분리된 활성물질은 Friedelin, Lupeol, Amyrin, Sitosterol, Gentamicin, Amoxicillin 성분들이 보고되고 있다(Keawsa-ard et al., 2015).
따라서 본 논문에서는 C. fructicola ICKb132에 대한 화학적 방제 방법을 대처할 방안으로 친환경 유기농자재를 이용한 방제 방법을 마련하기 위하여 Mesua ferrea 열매에서 추출한 항진균 활성물질을 구명하고, 그 활성물질의 항진균 활성을 검증하였다.
재료 및 방법
실험재료
본 연구에서 활성물질 탐색을 위한 균주로 복숭아에서 분리한 Colletotrichum fructicola ICKb132 (Lee et al., 2020)를 경북대학교 식물자원환경전공 식물병리학연구실에서 분양받아 사용하였다.
식물재료인 Mesua ferrea 열매는 네팔 약재시장에서 건조된 시료를 구매하여 사용하였고, 표본시료는 경북대학교 대학원 생태환경시스템학과 천연물화학연구실에 보관 중이다.
시약 및 기기
용매분획과 silica gel column chromatography에서 사용된 시약 methanol (MeOH, 99.5%), n-hexane (95.0%), chloroform (CHCl3, 99.5%)은 ㈜삼전순약공업, ethyl acetate (EtOAc), n-butanol (BuOH)은 ㈜덕산약품공업의 extra pure grade를 사용하였고, H2O는 초순수 정수기로 조제하여 사용하였다. Bioassay에 사용된 potato dextrose agar (PDA) 배지는 Becton, Dickinson and Company의 제품을 사용하였으며, 여과지(300 mmΦ, No.2)는 Advantec사(Toyo Roshi Kaisha) 제품을 사용하였고, petri dish는 SPL사 제품을 사용하였다.
Silica gel (7734)는 Merck사 제품을, cartridge column은 Watchers사의 flash cartridge를, gas chromatography-mass spectrometry (GC-MS)는 Agilent사의 7890A 기종을, column은 HP-5MS capillary를, detector는 Agilent사 5975C를 사용하였으며, library는 Wiley (W9N08.L)를 사용하였다.
MeOH 용매추출
건조시킨 Mesua ferrea 열매 980 g을 잘게 분쇄하여 99.5% MeOH 3L로 실온에서 24시간 침지 후 추출하였으며, 침지와 추출과정을 3회 반복하였다. 상등액을 여과지를 사용하여 고형물을 걸러내고 40oC에서 rotary evaporator로 감압·농축하여 MeOH 추출물 149.97 g을 얻었다.
용매분획
MeOH 추출물 149.97 g을 증류수 500 ml에 현탁시킨 후 hexane, CHCl3, EtOAc, BuOH로 순차적으로 용매분획하여 hexane fraction 55.15 g, CHCl3 fraction 2.95 g, EtOAc fraction 9.43 g, BuOH fraction 28.97 g, aqueous layer 53.47 g을 얻었다.
항진균 활성물질 분리 및 정제
생물검정에서 가장 활성이 강했던 hexane fraction으로부터 항진균 활성물질을 분리·정제하기 위하여 open column chromatography (50 mm × 860 mm)에 Merck사의 silica gel (7734) 600 g을 충진 후 hexane fraction 55.15 g을 loading 하고, EtOAc에 hexane 농도를 90%에서 60%까지 step-wise 방식으로 순차 용출하여, 100 ml씩 80개의 용매분획(HS-1~HS-80)을 얻었다. 이들 용매분획을 bioassay한 결과, 활성을 나타낸 HS-9~HS-12 용매분획을 농축하여 활성분획 7.62 g을 얻었다.
1차 open column chromatography에서 얻은 활성분획 HS-9~HS-12 7.62 g을 open column chromatography (30 mm × 860 mm)에 Merck사의 silica gel (7734) 300 g을 충진한 후 loading하여 hexane vs. EtOAc의 부피를 90% vs. 10%의 isocratic 용매시스템으로 용출하여 60 ml씩 30개의 용매분획(HSS-1~HSS-30)을 얻었다. 각각의 용매분획을 bio assay한 결과 HSS-7~HSS-11 용매분획에서 활성이 나타났으며 HSS-7~HSS-11 용매분획을 농축하여 2.1 g을 얻었다.
2차 column chromatography에서 얻은 활성물질 분획 HSS-7~HSS-11 2.1 g을 silica gel 30 g이 충진된 54 ml cartridge column에 loading하고 100% hexane 용매로 용출하여 10 ml씩 40개의 용매분획을 얻었다. 40개의 용매분획을 bioassay한 결과 HSSC-6번과 HSSC-8번 subfraction에서 활성이 나타났으며, 최종적으로 HSSC-6 subfraction 0.03 g, HSSC-8 subfraction 0.04 g의 활성물질을 얻었다.
항진균 활성물질 구조구명
최종적 활성물질로 분리한 HSSC-6과 HSSC-8 subfraction을 GC-MS로 분석하여 mass spectrum과 Wiley library의 mass spectrum을 각각 비교 분석하여 활성물질의 화학적 구조를 구명하였다.
균사생장 억제 실험
용매분획 및 column chromatography의 분획을 Colletotrichum fructicola ICKb132에 대하여 in vitro test에서 균사생육억제를 평가하여 항진균 활성물질을 분리·정제하는데 지표로 삼았다. 고압멸균한 PDA (potato dextrose agar)배지에 분획의 농도가 0 ppm, 10 ppm, 50 ppm, 100 ppm, 250 ppm이 되도록 화합물을 첨가하여 petri dish (60 mm × 15 mm)에 분주 후 평판배지를 만들었다. 완전히 굳혀진 평판배지에 cork borer (5 mm)로 채취한 실험 균주를 배지 중앙에 치상하고 25oC incubator에서 균주의 생장속도를 관찰하여 균사생장 억제능을 검정하였다.
최종 활성분획의 생장억제능을 평가하기 위하여 균사 생장을 억제하는 최소 농도 EC50 (effective concentration inhibiting by 50% of mycelial growth) 값을 구하였다.
결과 및 고찰
Mesua ferrea 열매 MeOH 추출물 1,000 ppm 농도에서 병원 균주 접종 후 4일차에서 6일차까지 항진균 활성도를 검토한 결과, 강한 항진균 활성을 나타내었다(Table 1).

Antifungal activity of MeOH extract of Mesua ferrea L. fruit against Colletotrichum fructicola ICKb132 by incubation period.
MeOH 추출물 149.98 g을 증류수 500 ml에 현탁 시킨 후 순차적으로 용매분획하여 hexane fraction 55.15 g, CHCl3 fraction 2.95 g, EtOAc fraction 9.43 g, BuOH fraction 28.97 g, aqueous fraction 53.47 g을 얻었다. 각각의 fraction들을 bioassay 한 결과, hexane, CHCl3 fraction에서 활성이 강하게 나타났으며, EtOAc, BuOH fraction에서는 약하게, aqueous layer에서는 활성이 나타나지 않았다(Fig. 1).
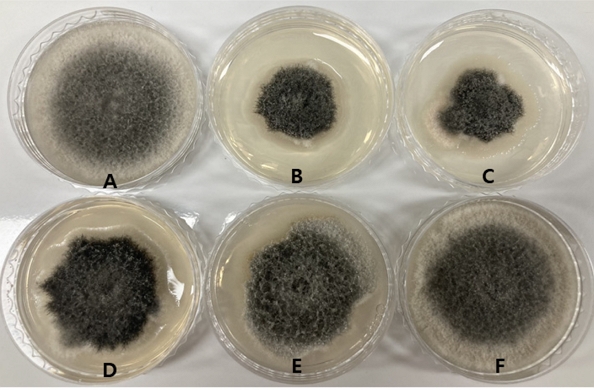
Antifungal activity of solvent fractions at 500 ppm concentration against Colletotrichum fructicola ICKb132.(A: control, B: hexane fraction, C: CHCl3 fraction, D: EtOAc fraction, E: BuOH fraction, F: aqueous fraction).
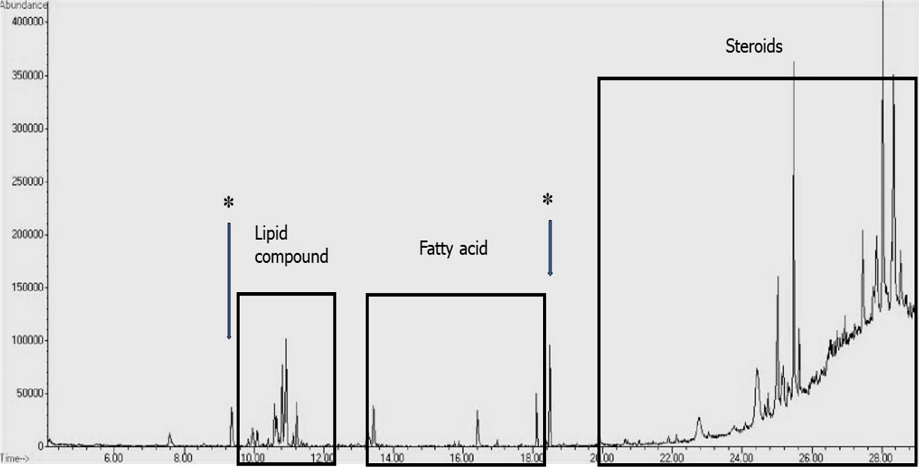
강한 활성이 나타난 hexane fraction과 CHCl3 fraction을 GC-MS로 비교분석한 결과, 동일한 peak 패턴을 나타내어 보다 용량이 많은 hexane fraction으로부터 활성물질을 분리하였다. Hexane fraction을 GC-MS로 분석하여 각각의 peak들을 profiling한 결과, 10 min~12 min 사이의 peak들은 lipid compound들로 추정되었고, 13 min~18 min 사이의 peak들은 fatty acid로, 20 min 이후의 peak들은 steroid로 추정되었다.
따라서 활성물질은 9.5 min과 18.5 min에서 나타난 peak 화합물로 추정되었다(Fig. 2).
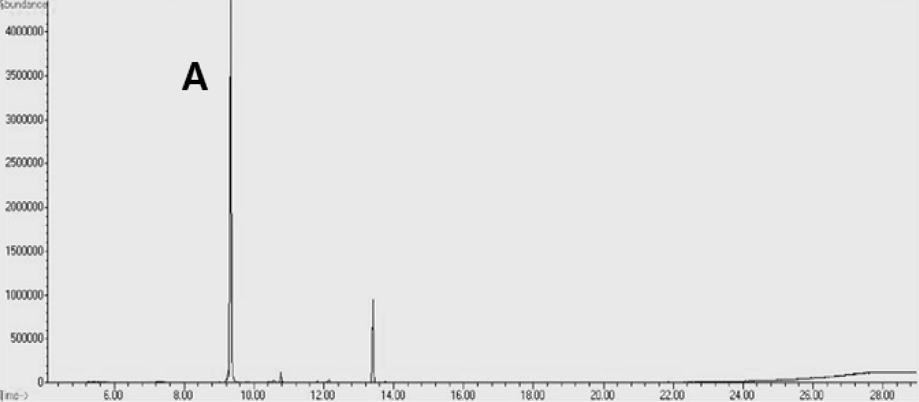
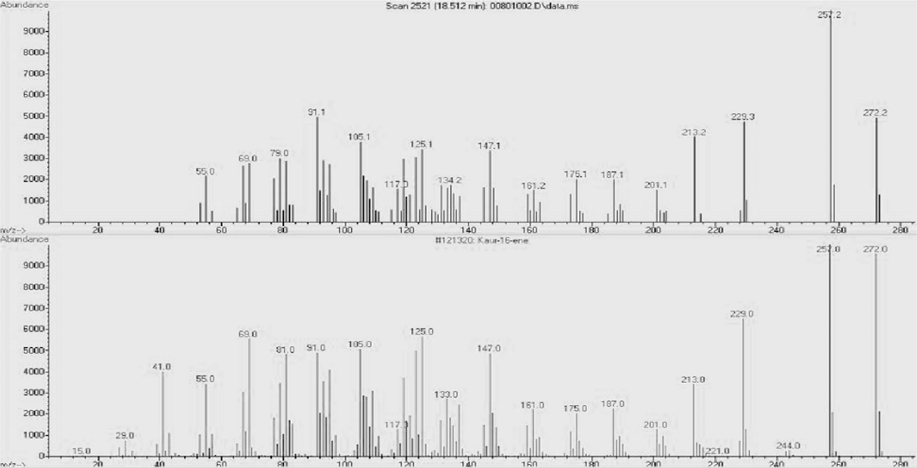
Hexane fraction을 silica gel chromatography로 2회 분리·정제하여 얻어진 활성분획을 silica gel cartridge column으로 분리·정제하여 최종적으로 활성분획 HSSC-6와 HSSC-8을 얻었다. 활성분획 HSSC-6을 GC-MS로 분석한 결과 GC chromatogram에서 9.5 min에 나타난 A peak가 main peak로 확인되었고, 13.5 min에 나타난 peak는 mass spectrum을 Wiley library의 mass spectrum과 비교 분석한 결과 heptanoic acid로 noise peak로 판단하였다(Fig. 3).
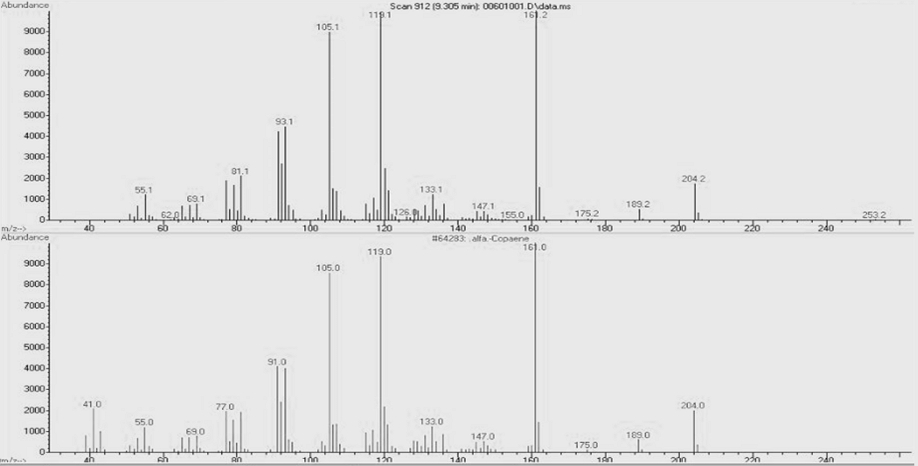
HSSC-6 subfration의 GC chromatogram에서 9.5 min에 나타난 A peak의 mass spectrum과 Wiley library의 mass spectrum을 비교 분석한 결과, A peak는 99% quality로(1R)-1,3-dimethyl-8-propan-2-yltricyclo[4.4.0.02,7]dec-3-ene (α-copaene) 화합물로 구조해석 되었다(Fig. 4).
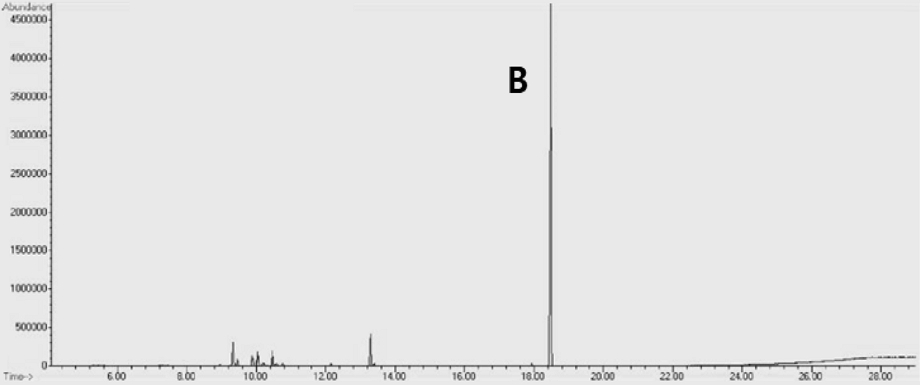
또한 최종 활성분획 HSSC-8을 GC-MS로 분석한 결과, GC chromatogram에서 18.5 min에 나타난 B peak가 main peak로 검출되었다(Fig. 5). HSSC-8 subfraction의 main peak인 B peak의 mass spectrum과 Wiley library의 mass spectrum을 비교 분석한 결과 B peak는 98%quality로5,5,9-trimethyl-14-methylidenetetracyclo[11.2.1.01,10.04,9] shexadecane (kaur-16-ene)으로 구조해석 되었다(Fig. 6).
최종적으로 Mesua ferrea 열매로부터 C. fructicola ICKb132 병원균에 대한 항진균 활성물질로 α-copaene과 kaur-16-ene으로 구조 동정하였다(Fig. 7).
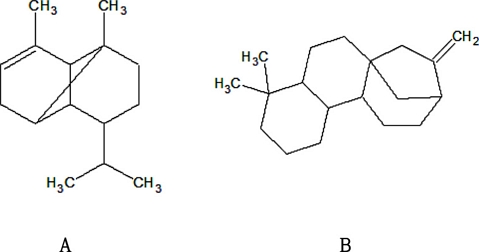
Chemical structures isolated from Mesua ferrea fruit as antifungal active compound. A : a-copaene, B : kaur-16-ene.
구조 동정한 α-copaene은 열대 고등식물에서 검출되는 oily liquid hydrocarbon으로 농업 해충인 지중해 초파리(Ceratitis capitata) 수컷의 강력한 유인 물질로 살충제와 함께 사용되는 천연 유인성분으로 보고되고 있다(Nishida et al., 2000). 미국의 경우 심각한 침입 해충인 딱정벌레의 피해에 대처하기 위해 α-copaene 성분을 강화하여 대량의 딱정벌레를 포획한 연구결과가 보고된 바 있다(Kendra et al., 2016).
Kaur-16-ene은 일부 양치류, Pteris semipinnata 등에서 발견되는 다기능 생화학 물질로 항암, 항염, 폐렴과 같은 염증성 질환, 피부 미백, 색소 침착 장애에 대한 치료물질로 사용된다는 연구 결과가 보고되고 있다(Hamamoto et al., 2020).
Mesua ferrea 열매로부터 분리한 항진균 활성물질 α-copaene과 kaur-16-ene 화합물의 C. fructicola ICKb132에 대한 항진균 활성을 검토하였다(Fig. 8).

Antifungal activities of a-copaene and kaur-16-ene against Colletotrichum fructicola ICKb132. A : a-copaene, B : kaur-16-ene.
Bioassy 결과 α-copaene 화합물의 EC50은 73.4 ppm, kaur-16-ene 화합물의 EC50은 57.3 ppm으로 kaur-16-ene이 α-copaene 보다 다소 강한 활성을 나타내었다(Table 2).

EC50 (effective concentration inhibiting by 50% of mycelial growth) value of α-copaene and kaur-16-ene against Colletotrichum fructicola ICKb132
결론적으로 연구 결과 Mesua ferrea 열매로부터 분리한 α-copaene과 kaur-16-ene은 탄저병의 원인균인 C. fructicola ICKb132에 대한 항진균 활성물질로 구명되었으며, 이 활성물질은 탄저병 방제를 위한 친환경 농자재 개발에 기여할 수 있을 것으로 판단되었다.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
-
Ames BN, 1979. Identifying environmental chemicals causing mutations and cancer. Science. 204(4393):587-593.
[https://doi.org/10.1126/science.373122]

-
Asif M, Jafari SF, Iqbal Z, Revadigar V, Oon CE, et al., 2017. Ethnobotanical and phytopharmacological attributes of Mesua ferrea: A mini review. J. Appl. Pharm. Sci. 7(4):242-251.
[https://doi.org/10.7324/JAPS.2017.70435]

-
Bailey JA, O’Connell RJ, Pring RJ, Nash C, 1992. Infection strategies of Colletotrichum species. pp. 88-120. In: Bailey, J. A. and Jeger, M. J. Eds. Colletotrichum: Biology, Pathology and Control. CABI, Wallingford, UK.
[https://doi.org/10.1079/9780851987569.0000]

-
Ben-Daniel B, Bar-Zvi D, Tsror(Lahkim), L. 2009. An improved large-scale screening method for assessment of Colletotrichum coccodes aggressiveness using mature green tomatoes. Plant Phathol. 58(3):497-503.
[https://doi.org/10.1111/j.1365-3059.2008.01989.x]

-
Chahar MK, Kumar SDS, Geetha L, Lokesh T, Manohara KP, 2013. Mesua ferrea L.: A review of the medical evidence for its phytochemistry and pharmacological actions. African J. Pharm. Pharmacol. 7(6):211-219.
[https://doi.org/10.5897/AJPP12.895]

- Delp CJ, 1988. In fungicide resistance in North America. American Phytopathol. Soc. 133.
-
Dillard HR, 1988. Influence of temperature, pH, osmotic potential, and fungicide sensitivity on germination of conidia and growth from sclerotia of Colletotrichum coccodes in vitro. Phytopathology. 78(10):1357-1361.
[https://doi.org/10.1094/Phyto-78-1357]

-
Elmer WH, Yang HA, SwectingHam MW, 2001. Characterization of Colletotrichum gloeosporioides isolates from ornamental lupines in Connectocut. Plant Dis. 85(2):216-219.
[https://doi.org/10.1094/PDIS.2001.85.2.216]

-
Freeman S, Katan T, Shabi E, 1998. Characterization of Colletotrichum species responsible for anthracnose diseases of various fruits. Plant Dis. 82(6):596-605.
[https://doi.org/10.1094/PDIS.1998.82.6.596]

-
Fuentes-Aragóna D, Juárez-Vázquezb SB, Vargas-Hernándezb M, Silva-Rojasc HV, 2018. Colletotrichum fructicola, a member of Colletotrichum gloeosporioides sensu lato, is the causal agent of anthracnose and soft rot in avocado fruits cv. “Hass”. Mycobiology 46(2):92-100.
[https://doi.org/10.1080/12298093.2018.1454010]

-
Glick BR, Chen Z, Czarny J, Duan J, 2007. Promotion of plant growth by ACC deaminase-producing soil bacteria. Eur. J. Plant Pathol. 119:329-339.
[https://doi.org/10.1007/s10658-007-9162-4]

-
Hamamoto A, Isogai R, Maeda M, Hayazaki M, Horiyama E, et al., 2020. The high content of Ent-11α-hydroxy-15-oxo-kaur-16-en-19-oic Acid in Adenostemma lavenia (L.) O. Kuntze leaf extract: with preliminary in vivo assays. Foods 9(1):73.
[https://doi.org/10.3390/foods9010073]

- Han YH, 2017. Isolation of Bacillus spp. SW29-2 and its antifungal activity against Colletotrichum coccodes. J. Life Sci. 27(6):688-693.
- Keawsa-ard S, Liawruangrath B, Kongtaweelert S, 2015. Bioactive compounds from Mesua ferrea stems. Chiang Mai J. Sci. 42(1):185-195.
-
Kendra PE, Montgomery WS, Deyrup MA, Wakarchuk D, 2016. Improved lure for redbay ambrosia beetle developed by enrichment of α-copaene content. J. Pest Sci. 89:427-438.
[https://doi.org/10.1007/s10340-015-0708-5]

-
Lee DM, Hassan O, Chang T, 2020. Identification, characterization, and pathogenicity of Colletotrichum species causing anthracnose of peach in Korea. Mycobiology 48:210-218.
[https://doi.org/10.1080/12298093.2020.1763116]

-
Lee KJ, Park SH, Govrthanan M, Hwang PH, Seo YS, et al., 2013. Synthesis of silver nanoparticles using cow milk and their antifungal activity against phytopathogens. Materials Lett. 105:128-131.
[https://doi.org/10.1016/j.matlet.2013.04.076]

- Lee WH, Kim JH, Choi IY, 2008. Advantages and disadvantage in using biological control of plant diseases and integrated control. J. Agr. Life Sci. 39:66-76.
-
Lees AK, Hilton AJ, 2003. Black dot (Colletotrichum coccodes): an increasingly important disease of potato. Plant Pathol. 52(1):3-12.
[https://doi.org/10.1046/j.1365-3059.2003.00793.x]

-
Manasi K, Bhagwat MK, Datar AG, 2014. Antifungal activity of herbal extracts against plant pathogenic fungi. Arch. Phytopathol. Plant Prot. 47(8):959-965.
[https://doi.org/10.1080/03235408.2013.826857]

-
Nishida R, Shelly TE, Whittier TS, Kaneshiro KY, 2000. α-copaene, a potential rendezvous cue for the mediterranean fruit fly, Ceratitis capitata. J. Chem. Ecol. 26:87-100.
[https://doi.org/10.1023/A:1005489411397]

-
Palaniyandi SA, Yang SH, Suh JW, 2013. Extracellular proteases from Streptomyces phaeopurpureus ExoPro138 inhibit spore adhesion, germination and appressorium formation in Colletotrichum coccodes. J. Appl. Microbiol. 115(1):207-217.
[https://doi.org/10.1111/jam.12212]

-
Park JH, Choi GJ, Lee SW, Jang KS, Choi YH, et al., 2004. In vivo antifungal activity of pyrrolnitrin isolated from Burkholderia capacia EB215 with antagonistic activity towards Colletotrichum species. Kor. J. Mycol. 32(1):31-38.
[https://doi.org/10.4489/KJM.2004.32.1.031]

- Park KS, Kim CH, 1992. Identification, distribution and etiological characteristics of anthracnose fungi of red pepper in Korea. Kor. J. Plant Pathol. 8(1):61-69.
- Prihastuti H, Cai L, Chen H, McKenzie EHC, Hyde KD, 2009. Characterisation of Colletotrichum species associated with coffee berries in northern Thailand. Fungal Divers. 39:89-109.
-
Rojas EI, Renher SA, Samuels GJ, Van Bael SA, Herre EA, et al., 2010. Colletotrichum loeosporioides s.l. associated with Theobroma cacao and other plants in Panama: multilocus phylogenies distinguish host-associated pathogens from asymptomatic endophytes. Mycologia 102(6):1318-1338.
[https://doi.org/10.3852/09-244]

- Staub T, Sozzi D, 1984. Fungicide resistance: a continuing challenge. Plant Dis. 68:1026-1031.
-
Uribe E, Loria R, 1994. Response of Colletotrichum coccodes to fungicides in vitro. Amer. Potato J. 71:455-465.
[https://doi.org/10.1007/BF02849099]

-
Weir BS, Johnston PR, Damm U, 2012. The Colletotrichum gloeosporioides species complex. Stud. Mycol. 73(1):115-180.
[https://doi.org/10.3114/sim0011]

Kyong-Mi Jeon, Department of Ecology and Environmental System, Kyungpook National University, Master, https://orcid.org/0009-0005-1345-2158
Yong-Hwa Choi, Department of Ecology and Environmental System, Kyungpook National University, Professor, https://orcid.org/0000-0002-5675-9417