국내 목화진딧물 지역집단의 11개 살충제 감수성 평가
 ; Yuno Lee ; Se Eun Kim ; Ha Hyeon Moon ; Se Yoon Kim ; Jin-Woo Jung ; Hyun-Na Koo ; Hyun Kyung Kim ; Gil-Hah Kim*
; Yuno Lee ; Se Eun Kim ; Ha Hyeon Moon ; Se Yoon Kim ; Jin-Woo Jung ; Hyun-Na Koo ; Hyun Kyung Kim ; Gil-Hah Kim*
초록
고추재배지에서 채집한 9지역집단의 목화진딧물과 오이재배지 13지역집단에 대하여 등록약제 11개(고추7종, 오이7종)의 약제감수성을 평가하였다. 그 결과, 추천농도를 이용한 약제의 살충활성은 지역집단에 따라 감수성에 차이를 보였다. 오이재배지에서 채집된 목화진딧물에 대한 sulfoxaflor 처리 3일 후 공주(63.8%)와 함양(80.9%) 지역 집단을 제외한 나머지 지역집단은 90% 이상의 사충률을 보였고, 고추재배지에서 채집된 목화진딧물은 λ-cyhalothrin 처리 시 인천(87.8), 청주(53.6%), 천안(72.4%) 지역집단을 제외하고 90% 이상의 사충률을 보였다. 각 지역집단별 목화진딧물에 대한 약제의 치사농도(LC50, LC90)값을 조사하여 저항성비(Resistance ratio, RR)와 방제효과지수(Control efficacy index, CEI)를 구한 결과, 오이재배지에서 채집된 횡성 지역집단은 dinotefuran을 제외한 모든 약제에서 RR 값이 ≥ 1.0으로 나타났으나, 경주 지역집단에서는 sulfoxaflor에서 RR 값과 CEI 값이 각각 < 1.0과 < 0.0004로 낮게 나타났다. 고추재배지에서 채집된 천안 지역집단은 pyrifluquinazon과 afidopyropen, flonicamid에서 실험실 감수성계통보다 더 낮은 RR 값과 CEI값을 보였다. 고추재배지 지역집단의 사충률을 비교하기 위한 상자수염그림(box-and-whisker plot)에서는 imidacloprid가 가장 적은 편차를 보였다. 결과적으로 본 연구는 목화진딧물의 지속적인 모니터링을 통해 효과적인 방제를 위한 기초자료로써 도움이 될 것이다.
Abstract
The susceptibility of 11 commercial insecticides against Aphis gossypii adults collected from 13 cucumber fields and nine pepper fields was evaluated. The mortality of the insecticides at the recommended concentration varied depending on the A. gossypii population in each region. Most of the insecticides except sulfoxaflor (63.8% in Gongju and 80.9% in Hamyang, respectively) showed over 90% mortality at each insecticide treatment in A. gossypii populations from cucumber fields. A. gossypii populations collected from the pepper fields showed over 90% mortality except for 3 regions (87.8% in Incheon, 53.6% in Cheongju, 72.4% in Cheonan) when treated with λ-cyhalothrin. The lethal concentrations (LC50 and LC90) of insecticides in each A. gossypii population were obtained and the resistance ratio (RR) and control efficacy index (CEI) were calculated. Hoengseong population collected from the cucumber field showed RR value of ≥ 1.0 in all insecticides except dinotefuran, and the Gyeongju population showed RR values of < 1.0 and CEI value of < 0.0004 for sulfoxaflor. The Cheonan population collected from the pepper field showed lower RR and CEI values for pyrifluquinazon, afidopyropen, and flonicamid than laboratory susceptible strain. In the box-and-whisker plot to compare the mortality of populations according to the crop fields, sulfoxaflor showed the least variation in cucumber field and imidacloprid showed the least variation in pepper fields. As a result, this study will be helpful as basic data for effective control of A. gossypii through continuous monitoring.
Keywords:
Cotton aphid, Aphis gossypii, Insecticide, Pest control, Susceptibility키워드:
목화진딧물, 살충제, 해충방제, 감수성평가서 론
목화진딧물(Aphis gossyii Glover)은 전 세계적으로 분포하며, 다양한 작물을 가해하는 주요 농업해충 중 하나이다. 작물을 흡즙하여 직접적인 피해 외에도 국내에서는 약 75종의 식물바이러스병을 매개하여 작물에 2차적 피해를 준다(Ebert and Cartwright, 1997; Blackman and Eastop, 2000). 진딧물을 방제하기 위해서 화학적 방제법이 널리 사용되고 있으나 진딧물의 짧은 세대주기와 빠른 증식속도 등으로 인한 약제저항성 발현, 인축독성 등의 문제가 야기되고 있다(Saito et al., 1995; Choi et al., 2001; Gore et al., 2013). 일반적으로 목화진딧물은 천적으로 인하여 적정 수준의 개체군을 유지하게 되지만 살충제의 사용으로 인하여 천적이 제거되면서 경제적피해수준 이상의 밀도 증가로 인한 작물의 피해를 초래하게 된다(Weathersbee and Hardee, 1994; Slosser et al., 2001).
다양한 화학 살충제를 이용한 목화진딧물의 약제 감수성 평가가 수행되었는데, 시설 재배지의 목화진딧물에 대한 모니터링 결과에서는 추천 농도에서 높은 살충활성을 보였으나, 호박, 오이, 고추와 같은 야외재배지에서의 채집 지역집단에 대한 화학 살충제의 약제저항성 모니터링 결과에서는 네오니코티노이드계와 피레스로이드계, 디아마이드계 등의 약제에 대하여 매우 높은 저항성이 나타남을 확인하였다(Choi et al., 2005; Koo et al., 2014). 또한 목화진딧물에 대한 감수성 평가는 국내 뿐만 아니라 일본과 중국, 호주 등 많은 나라에서 유기인계와 피레스로이드계, 카바메이트계, 네오니코티노이드계 등 다양한 약제에 대하여 연구가 되어 목화진딧물의 약제 저항성 발현이 확인되었다(Hama, 1987; Wang et al., 2007; Herron and Wilson, 2011). 따라서, 목화진딧물 방제를 위한 화학합성 방제제의 사용은 저항성의 발현과 개체군의 밀도 증가 등을 초래할 수 있기 때문에 지속적이고 지역적인 모니터링이 필요하다(Georghiou, 1994).
따라서, 본 연구는 11개의 등록 약제를 이용하여 13곳의 오이 재배지와 9곳의 고추 재배지에서 채집된 목화진딧물 지역집단의 감수성을 평가하여 목화진딧물의 방제에 도움이 될 수 있는 기초자료를 제공하고자 한다.
재료 및 방법
시험 곤충
목화진딧물은 2022 - 2023년 오이 재배지 13곳과 고추 재배지 9곳에서 채집하였다(Table 1). 채집된 목화진딧물은 아크릴 상자(30 × 30 × 30 cm)에서 오이 및 고추 유묘를 기주로 누대 사육하였다. 실험실감수성계통(S)은 2022년 국립농업과학원 곤충사육실에서 누대 사육해온 실험실 계통을 분양 받아 어떤 살충제에도 노출되지 않은 조건에서 누대 사육하였다. 모든 개체는 23 ± 1oC, 상대습도 60-70%, 16: 8(L: D)의 조건에서 사육되었다.
시험 약제
오이에 등록된 약제 7종(dinotefuran, sulfoxaflor, pymetrozine, chlorfenapyr, afidopyropen, cyantraniliprole, flonicamid)과 고추에 등록된 약제 7종(λ-cyhalothrin, imidacloprid, flupyradifurone, pyrifluqinazon, afidopyropen, cyantraniliprole, flonicamid)을 이용하였으며, 각 약제들에 대한 정보는 Table 2와 같다.
생물검정
목화진딧물에 대한 약제 감수성 평가는 엽침지법(leaf dipping method)으로 수행되었다. 오이 잎(ø 5.0 cm)을 각 약제의 추천 농도(RC, Recommended concentration) 조건에서 30초간 침지 후 음건하고, 페트리디쉬(ø 5.0 cm)에 넣은 다음 목화진딧물 성충 20마리를 접종하였고, 약제 처리 1, 2, 3일 후에 사충수를 조사하여 사충률(mortality)을 구하였다. 약제 처리구의 사충률은 무처리구의 사충률을 이용하여 보정하였다(Abbott, 1925). 50% 치사농도(LC50)와 90% 치사농도(LC90)를 산출하였다.
약제 처리 후 목화진딧물은 23 ± 1oC, 상대습도 60-70%, 16: 8 (L: D)의 조건에서 보관하였고, 모든 실험은 3반복으로 진행하였다.
자료분석
각 지역별 약제에 대한 목화진딧물의 사충률은 Tukey’s studentized range test를 이용하여 통계적 유의성을 검증하였고, LC50과 LC90 값은 probit analysis를 이용하였다(SAS Institute, 2009). 각 약제의 추천농도에서의 지역집단별 사충률을 엑셀에서 상자수염그림(box-and-whisker plot)으로 나타내어 지역집단 간의 분포범위를 비교하였다(MS, 2018). 목화진딧물 지역집단에 대한 약제별 효율을 검정하기 위해 저항성비(resistance ratio, RR)와 방제효과지수(Control efficacy index, CEI)를 각각 구하였다.
- RR = LC50 of field population / LC50 of susceptible strain
- CEI = LC90 of field population / recommended concentration of each insecticide
CEI 값이 1이하면 감수성 1초과 5미만이면 중도 저항성, 5이상이면 고도 저항성이라고 판단하였다.
결과 및 고찰
추천농도에서의 약제 감수성 평가
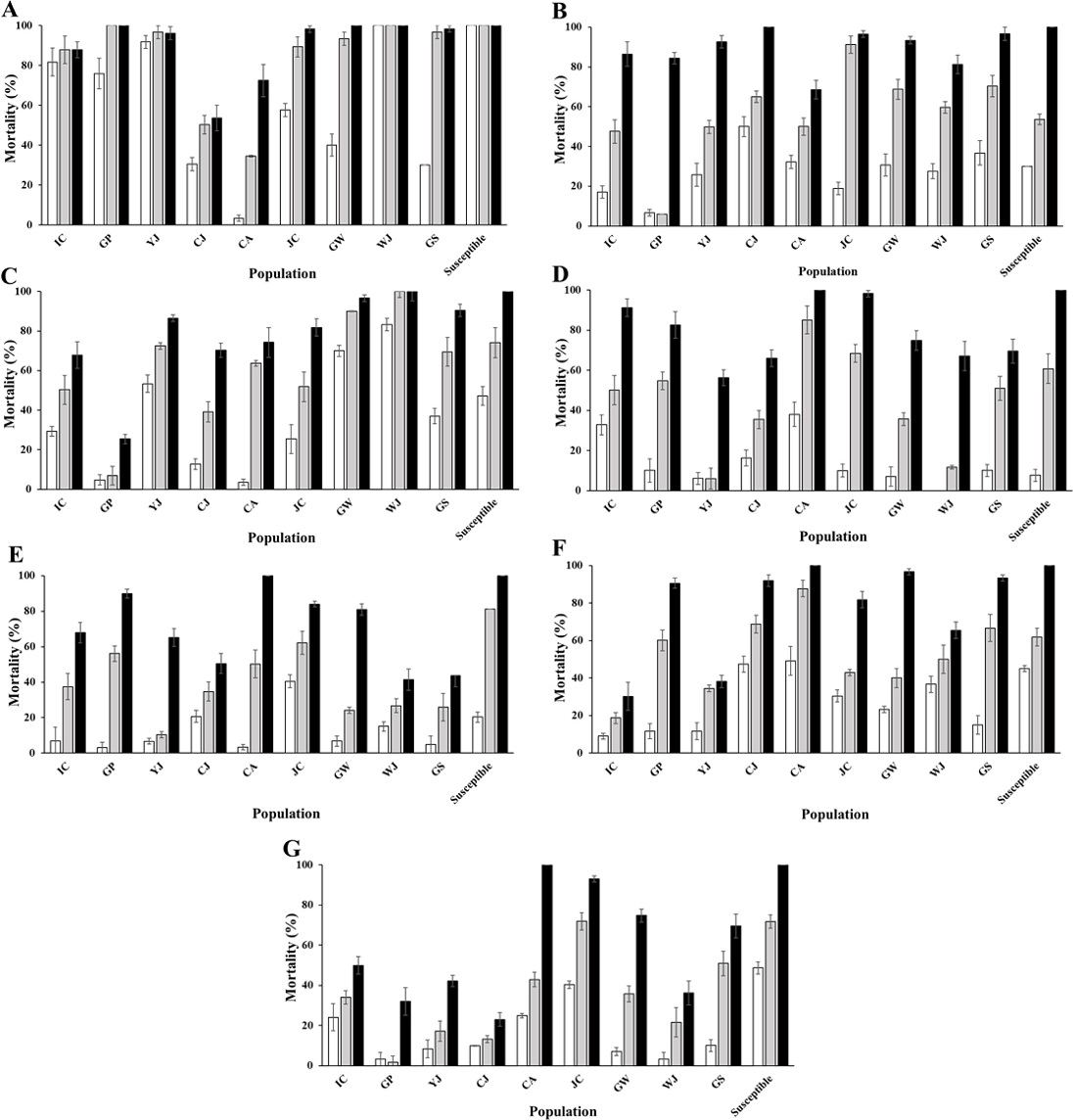
총 7개의 약제를 이용하여 오이재배지 13곳에서 채집된 목화진딧물의 감수성을 비교 평가하였다(Fig. 1). 모든 목화진딧물의 지역집단에서 약제 처리 후 3일차에 가장 높은 살충활성을 보였다. 그러나 각 지역집단마다 약제의 살충활성은 많은 차이를 보였다. Sulfoxaflor는 모든 지역집단의 목화진딧물에 대하여 약제처리 3일 후에는 50% 이상의 살충활성을 보였다. 특히, sulfoxaflor를 처리한 HS 지역집단과 MP 지역집단에서는 약제처리 1일차에서도 100%의 살충활성이 나타났다. 그러나 pymetrozine과 afidopyropen, cyantraniliprole은 각각 1곳(CJ1 45.6%와 CC 21.4%, GJ 44.4%)과 dinotefuran과 flonicamid는 각각 2곳씩(GJ 21.9%와 HY 34.3%, GJ 26.3%와 CC 17.2%) 목화진딧물에 대하여 약제처리 3일 후에도 50% 이하의 낮은 살충활성을 보였다. Sulfoxaflor는 nicotinic acetylcholine receptor (nAChR)에 작용하는 약제로 포유류보다 곤충에 강하게 결합하여 선택독성을 갖고, 흡즙성 해충을 대상으로 개발되어 목화진딧물 방제에 효과적일 것이다(Tomizawa and Casida, 2003; Zhu et al., 2011, Sparks et al., 2013; Casida and Durika, 2013; Gore et al., 2013).
Mortality of Aphis gossypii against seven insecticides (A~G) collected in cucumber cultivation area during 3 days after treatment (DAT). A, dinotefuran; B, sulfoxaflor; C, pymetrozine; D, chlorfenapyr; E, afidopyropen; F, cyantraniliprole; G, flonicamid.
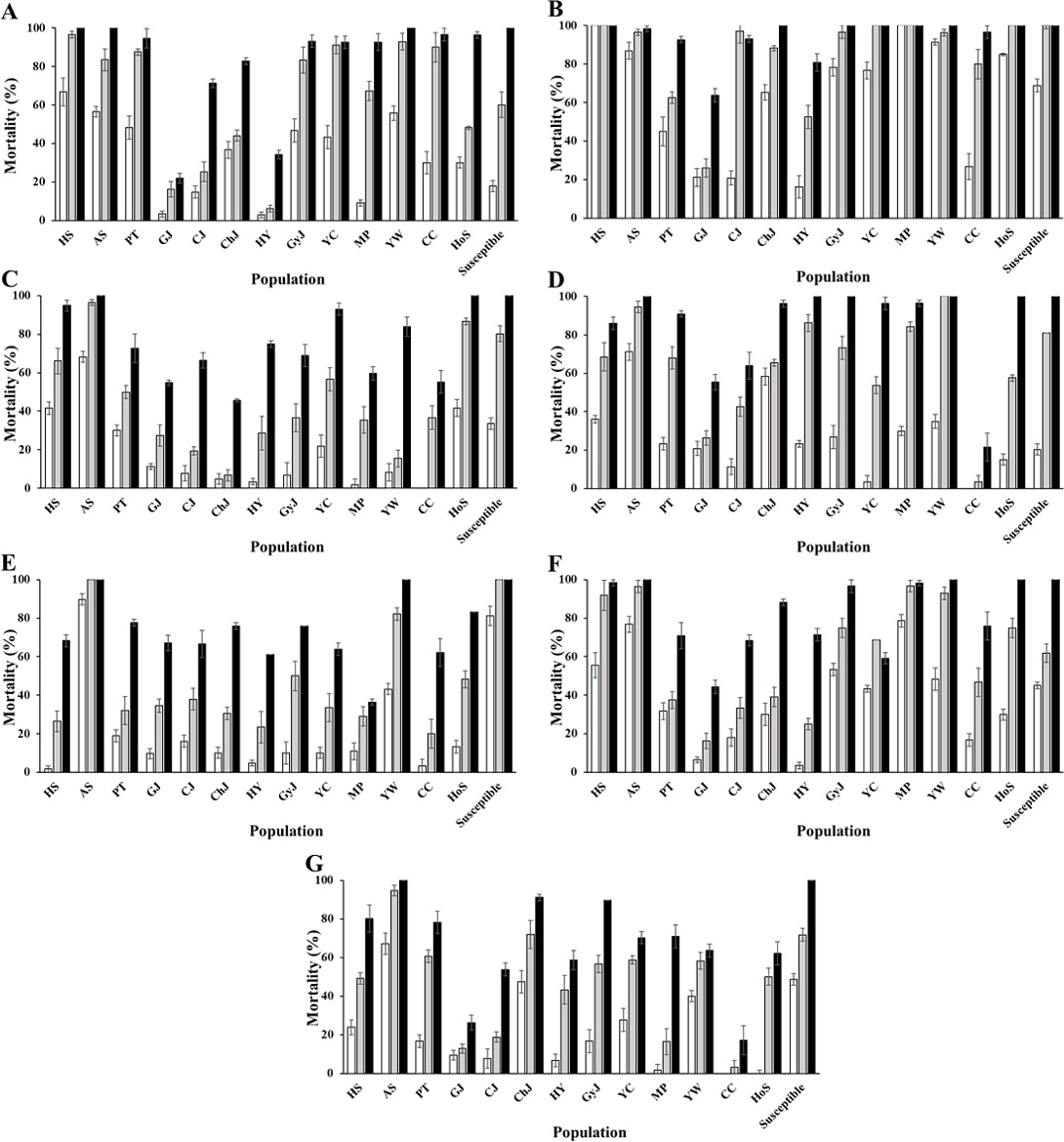
9지역의 고추재배지에서 채집된 목화진딧물에 대하여 7종 약제를 이용한 감수성 평가를 수행하였다(Fig. 2). 모든 목화진딧물의 지역집단은 약제 처리 후 시간이 지날수록 약제의 살충활성이 증가하였다. λ-cyhalothrin과 imidacloprid, pyrifluqinazon을 처리한 모든 지역집단에서는 약제 처리 3일 후에도 50% 이상의 살충활성을 보였으나 flupyradifurone은 GP (25.4%) 1곳, afidopyropen과 cyantraniliprole은 각각 2곳(WJ 41.4%와 GS 42.9%, IC 30.2%와 YJ 38.2%)에서 약제 처리 3일 후에도 50% 이하의 낮은 살충활성을 나타냈다. 그러나 flonicamid의 경우 총 9 지역집단 중 3개 지역집단(CA 100%, JC 93.0%, GW 74.8%)에서만 유의미한 살충활성을 보였다. Flonicamid는 pyridinecarboxamide 구조로 진딧물이나 가루이, 총채벌레와 같은 흡즙성 해충에 선택적 활성을 갖는 약제로 노출된 곤충은 섭식을 중단하여 결국 굶주림으로 죽게 만들어 다른 살충제들에 비하여 살충 효과가 늦게 나타난다(Morita et al., 2007). 그러나 thiamethoxam에 저항성을 보이는 목화진딧물에 flonicamid 처리 시 감수성을 보인다는 연구결과에 따라 목화진딧물 방제시 flonicamid가 IPM 프로그램에 이용 가능한 약제가 될 수 있을 것이다(Gore et al., 2013).
약제 저항성 발달 수준 비교
오이재배지에서 채집된 목화진딧물 지역집단에 대한 약제별 LC50과 LC90 값을 구하였다(Table 3). 채집된 목화진딧물 지역집단들은 실험실 계통(S)보다 대부분 높은 LC50과 LC90 값을 보였다. 그러나 sulfoxaflor를 처리한 GyJ 지역집단은 < 0.014 ppm 처리에서도 100%의 사충률을 보여 오히려 실험실 계통보다 더 높은 감수성을 보였다.
각 약제 별로 지역집단 목화진딧물의 저항성 발달정도를 확인하기 위하여 LC50 값을 실험실 계통과 비교하여 각각의 RR 값과 약제 별 추천농도와 LC90 값을 이용한 CEI 값을 계산하였다(Table 4). 채집된 목화진딧물 지역집단들은 실험실 계통보다 대부분 높은 RR 값을 보였으나 지역 간에 많은 차이를 보였다. GJ 지역집단은 chlorfenapyr를 제외한 모든 약제에 대하여, CJ1 지역집단은 chlorfenapyr와 flonicamid를 제외한 모든 약제에서 RR 값이 100 이상을 보였다. 그러나 PT 지역집단과 YC, YW 지역집단은 cyantraniliprole에서만 RR 값이 100 이상을 보였고 AS 지역집단은 모든 약제에 대하여 실험실 계통과 비교에서도 최대 RR 값이 11.4로 낮게 나타났다. 특히. AS 지역집단은 flonicamid 처리 시 실험실 계통과 동일한 RR 값인 1.0을 보였다. 각 지역집단별 LC90 값을 이용하여 CEI 값을 비교해 보았다. 감수성 계통은 모든 약제에 대해 매우 낮은 CEI 값을 보였다. AS 지역집단도 모든 약제에 대해서 낮은 RR 값과 1.0 이하의 CEI 값을 보여 감수성임을 알 수 있었으나 YW 지역집단의 경우, cyantraniliprole에 대하여 RR 값이 168.0을 보여 저항성비는 높은 것으로 판단되었으나, CEI 값은 0.2를 보여 감수성임을 알 수 있었다. 또한 CJ1 지역집단에서도 RR 값이 높게 나온 sulfoxaflor (300.7)에서 0.6의 낮은 CEI 값을 보였으나 100 이하의 RR 값을 보인 약제 chlorfenapyr와 flonicamid에서는 CEI 값이 각각 3.2와 5.4로 나타나 중도 저항성과 고도 저항성인 것을 확인할 수 있었다.

Resistance ratio (RR) and control efficacy index (CEI) of regional A. gossypii populations for each insecticide
고추재배지에서 채집한 목화진딧물 지역집단에 대한 약제 활성(Table 5)과 RR 값 및 CEI 값을 비교하였다(Table 6).

Resistance ratio (RR) and control efficacy index (CEI) of regional A. gossypii populations for each insecticide
IC 지역집단과 GW 지역집단은 cyantraniliprole을 제외한 모든 약제에 대하여 RR 값이 100이하였다. CA 지역집단은 λ-cyhalothrin에서는 RR 값이 226.9로 높았으나 pyrifluquinazon (0.2)과 afidopyropen (0.7), flonicamid (0.09)에서는 실험실 계통보다 더 낮은 RR 값을 보였다. λ-Cyhalothrin은 피레스로이드계 약제 중 하나로 목화진딧물 방제에 널리 사용되고 있으며 미국, 일본, 중국, 그리스, 호주 등 많은 나라에서 피레스로이드계 약제에 대한 저항성 발현에 관한 보고가 되었다(Kerns and Gaylor, 1992; Rosenheim et al., 1995; Saito et al., 1995; Sun et al., 1994; Ioannidis, 1998; Herron et al., 2001). 그러나 Foster et al. (2011)의 연구에서는 실험실 계통의 목화진딧물과 복숭아혹진딧물이 유기인계와 pirimicarb 또는 피레스로이드계 약제에 저항성을 보이는 지역집단들과의 LC50 값을 비교 시 통계적 유의차가 없는 것으로 관찰되었다.
Imidacloprid는 모든 지역집단들에 대한 RR 값이 다른 약제처리구 보다 낮았는데, GP 지역집단의 RR 값이 104.8로 가장 높게 나타났다. Imidacloprid는 미국 목화재배지에서 처음으로 사용된 네오니코티노이드계 약제로 현재까지 같은 계통의 다양한 약제들(thiamethoxam, acetamiprid 등)과 제형들이 개발되었다(Tomizawa and Casida, 2003; Gore et al., 2013). 미국 미시시피주와 루이지애나주에서 각각 2002년과 2004년에 채집된 야외계통에 대한 acetamiprid와 thiamethoxam의 살충활성을 조사한 결과 각각 94-97%와 91-97%의 살충효과를 보였으나 2010년과 2011년에 채집된 개체군에서는 27-96%와 2-19%의 살충률을 보여 이들 약제에 대한 저항성이 발현되어 약제의 효과가 감소하고 있음을 보여준다(Layton et al., 2003; Bommireddy et al., 2005; Adams et al., 2011; Emfinger et al., 2014). 또한 Feng et al. (2010)은 네오니코티노이드계 약제들의 교차저항성에 대한 연구로 thiamethoxam에 저항성인 B-biotype B. tabaci이 imidacloprid와 acetamiprid, nitenpyram에 매우 높은 교차저항성이 있음을 보여주었다.
Cyantraniliprole은 ryanodine receptor의 작용을 억제하는 약제이다. 뿌리 침투 이행성 및 엽면 침투성을 가져 씹는형의 구기와 흡즙형의 구기의 해충에 효과적이며, 유기인계, 카바메이트계, 피레스로이드계 등 약제에 복합저항성을 보이는 목화진딧물에 대하여 효과를 보이는 것으로 알려졌다(Foster et al., 2011; Cordova et al., 2006; Foster et al., 2007; 2011; Puinean et al., 2010). 본 연구에서도 CJ2와 CA 지역집단은 피레스로이드계 약제인 λ-cyhalothrin에 높은 RR 값인 2,057.7과 226.9를 보였고 CEI 값은 각각 8.2와 13.7을 보여 고도 저항성을 보였다. 그리고 cyantraniliprole에 대해서는 1 미만의 CEI 값인 0.7과 0.4로 감수성을 보여, λ-cyhalothrin에 저항성을 보이는 집단에서도 살충효과가 높게 나타남을 알 수 있었다.
본 연구에서는 RR 값과 CEI 값 간의 차이를 보았는데, 감수성계통은 모든 약제에 대하여 낮은 CEI 값을 보였다. 그러나 RR 값이 비교적 낮은 IC 지역집단은 CEI 값과 양의 상관관계를 보이지 않았다. 가장 높은 RR 값(10,186.7)을 보인 cyantraniliprole에서는 CEI 값이 110.8을 보여 고도 저항성임을 알 수 있으나 비교적 낮은 RR 값인 11.8을 보인 afidopyropen에서도 CEI 값이 8.0을 보여 고도 저항성임을 알 수 있었다. 또한 GW 지역집단에서 유일하게 100 이상의 RR 값을 보인 cyantraniliprole (118.0)에서는 CEI 값이 0.4로 감수성임을 알 수 있었다.
채집 작물에 따른 약제의 살충활성 비교
오이재배지에서 채집된 목화진딧물의 지역집단들에 대한 약제 별 추천 농도에서의 살충활성을 상자수염그림(box-and-whisker plot)으로 비교하였다(Fig. 3). 약제들의 추천 농도에서의 살충활성은 채집 지역에 따른 차이를 보였는데, flonicamid가 지역집단에 따른 살충활성의 편차가 가장 크게 나타났다. Sulfoxaflor는 추천 농도에서 평균 살충활성이 94.3%로 가장 높았고 지역집단에 따른 편차도 적게 나타났다.
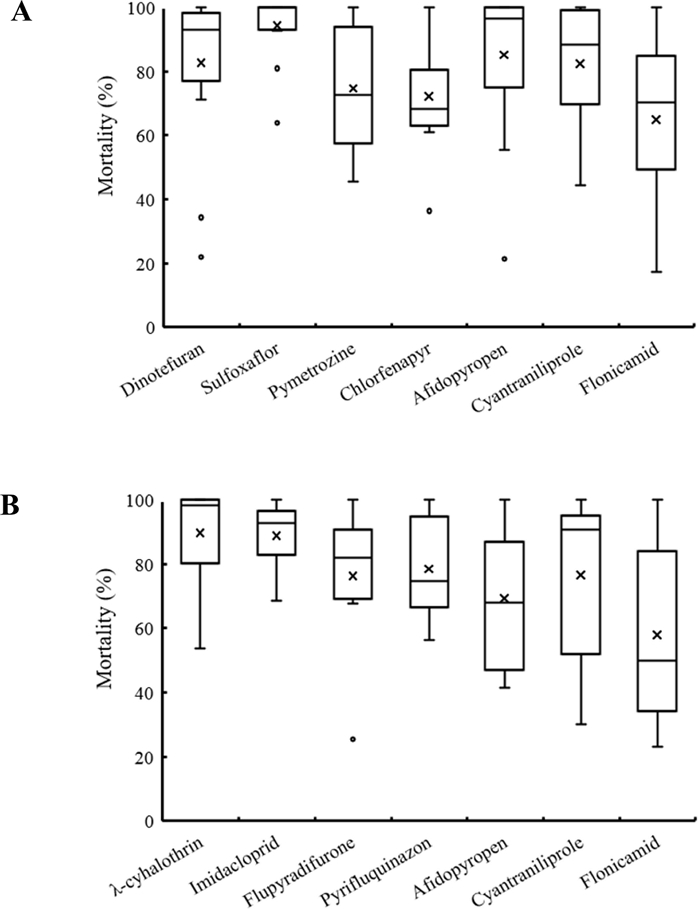
Mean of mortality comparisons from 13 and nine regional populations which was collected from cucumber cultivation (A) and pepper cultivation area (B).ⅹ, mean of mortality for total regional populations.
고추재배지에서 채집된 목화진딧물의 지역집단들에 대한 추천 농도에서의 약제 별 살충활성을 비교하였다(Fig. 3B).
Cyantraniliprole과 flonicamid는 지역집단별 살충활성의 편차가 유사하게 나타났으나 평균 살충률은 각각 76.5%와 57.9%로 차이를 보였다. 이는 cyantraniliprole 처리된 지역 집단들의 살충활성 2분위값이 90.6%으로 매우 높은 반면에 flonicamid의 2분위값은 50.0% 수준으로 지역집단별 살충률의 분포에서 차이를 보이기 때문이다.
위와 같은 연구결과들을 종합해보면 동일한 약제일지라도 살충활성이 지역마다 편차가 크기 때문에 약제의 살충활성이 다름을 의미한다. 따라서 저항성 연구결과가 채집지의 환경, 기존 처리약제의 종류, 처리횟수 등과 같은 다양한 요인에 의해서 영향을 미칠 수 있기에 지속적인 모니터링이 진행되어야 할 것이다. 지속적인 모니터링을 통하여 많은 자료가 축적된다면 목화진딧물의 지역적 및 약제 별 저항성이 얼마나 분포하는지 확인할 수 있어 약제의 남용을 막고 효율적인 방제약제 선정에 도움이 될 수 있을 것이다(Gore et al., 2013).
본 연구를 통하여 목화진딧물을 저항성 발현 억제와 효과적인 방제를 위한 기초자료로 사용될 수 있기를 기대한다.
Acknowledgments
본 논문은 농촌진흥청의 소면적작물 농약직권등록 중 농자재관리 및 평가사업의 지원을 받아 연구되었습니다(RS-2022-RD010420).
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
-
Abbott WS, 1925. A method of computing the effectiveness of an insecticide. J. Econ. Entomol. 18(2):265-267.
[https://doi.org/10.1093/jee/18.2.265a]

-
Adams BP, Catchot AL, Owen LN, McPherson JW, Scott WS, et al., 2011. Efficacy of selected insecticides against cotton aphid on cotton, 2010. Arthropod Management Tests. 36(1):F29.
[https://doi.org/10.4182/amt.2011.F29]

- Blackman RL, Eastop VF, 2000. Aphids on the World’s Crops: An Identification and Information Guide. John Wiley & Sons, Chichester, UK.
-
Bommireddy PL, Gable R, Tindall K, Leonard BR, 2005. Evaluation of neonicotinoids against cotton aphid, 2004. Arthropod Management Tests. 30(1):F37.
[https://doi.org/10.1093/amt/30.1.F37]

-
Casida JE, Durkin KA, 2013. Neuroactive insecticides: targets, selectivity, resistance, and secondary effects. Annu. Rev. Entomol. 58:99-117.
[https://doi.org/10.1146/annurev-ento-120811-153645]

- Choi BR, Lee SW, Yoo JK, 2001. Resistance mechanisms of green peach aphid, Myzus persicae (Homoptera: Aphididae), to imidacloprid. Korean J. Appl. Entomol. 40(3):265-271.
- Choi BR, Park HM, Yoo JK, Kim SG, Baik CH, et al., 2005. Monitoring on insecticide resistance of major insect pests in plastic house. Korean J. Pestic. Sci. 9(4):380-390.
-
Cordova D, Benner EA, Sacher MD, Rauh JJ, Sopa JS, et al., 2007. The novel mode of action of anthranilic diamide insecticides: ryanodine receptor activation, in Synthesis and Chemistry of Agrochemical VII. ACS Symposium Series 948, Ch. 17, pp. 223-234.
[https://doi.org/10.1021/bk-2007-0948.ch017]

- Ebert TA, Cartwright B, 1997. Biology and ecology of Aphis gossypii Glover (Homoptera: Aphididae). Southwest Entomologist. 22:116-153.
-
Emfinger KD, Williams S, Chapman J, Rogers LB, 2014. Evaluation of insecticides against cotton aphids on cotton, 2011. Arthropod Management Tests. 37(1):F37.
[https://doi.org/10.4182/amt.2012.F37]

-
Feng Y, Wu Q, Wang S, Chang X, Xie W, et al., 2010. Cross‐resistance study and biochemical mechanisms of thiamethoxam resistance in B‐biotype Bemisia tabaci (Hemiptera: Aleyrodidae). J. Pest. Sci, 66(3):313-318.
[https://doi.org/10.1002/ps.1877]

- Finney DJ, 1971. Probit Analysis, third ed. Cambridge University Press, Cambridge. p. 333.
-
Foster SP, Denholm I, Poppy GM, Thompson R, Powell W, 2011. Fitness trade-off in peach-potato aphids (Myzus persicae) between insecticide resistance and vulnerability to parasitoid attack at several spatial scales. Bulletin of Entomological Research. 101(6):659-666.
[https://doi.org/10.1017/S0007485310000623]

-
Foster SP, Devine G, Devonshire AL, 2007. 10 Insecticide Resistance. Aphids as crop pests, 261.
[https://doi.org/10.1079/9780851998190.0261]

-
Georghiou GP, 1994. Principles of insecticide resistance management. In Phytoprotection (Vol. 75, No. 4, pp. 51-59). Érudit.
[https://doi.org/10.7202/706071ar]

-
Gore J, Cook D, Catchot A, Leonard BR, Stewart SD, et al., 2013. Cotton aphid (Heteroptera: Aphididae) susceptibility to commercial and experimental insecticides in the southern United States. J. Econ. Entomol. 106(3):1430-1439.
[https://doi.org/10.1603/EC13116]

- Hama H, 1987, Insecticide resistance in aphids. Shokubutsu-Boeki. 41:159-164.
-
Herron GA, Wilson LJ, 2017. Can resistance management strategies recover insecticide susceptibility in pests?: a case study with cotton aphid Aphis gossypii (Aphididae: Hemiptera) in Australian cotton. Austrian J. Entomol. 56(1):1-13.
[https://doi.org/10.1111/aen.12236]

-
Herron GA, Powis K, Rophail J, 2001. Insecticide resistance in Aphis gossypii Glover (Hemiptera: Aphididae), a serious threat to Australian cotton. Australian J. Entomol. 40(1):85-91.
[https://doi.org/10.1046/j.1440-6055.2001.00200.x]

-
Herron GA, Wilson LJ, 2011. Neonicotinoid resistance in Aphis gossypii glover (Aphididae: Hemiptera) from Australian cotton. Australian J. Entomol. 50(1):93-98.
[https://doi.org/10.1111/j.1440-6055.2010.00788.x]

- Ioannidis PM, 1998. Resistance of Aphis gossypii (Homoptera: Aphididae) to insecticides. In: Proceedings of the second World Cotton Research Conference, Athens, Greece. 6-12 sep. p. 759.
- IRAC. 2023. Insecticide resistance action committee. http://www.irac-online.org, (Accessed Aug. 18. 2023)
-
Kerns DL, Gaylor MJ, 1992. Insecticide resistance in field populations of the cotton aphid (Homoptera: Aphididae). J. Econ. Entomol. 85(1):1-8.
[https://doi.org/10.1093/jee/85.1.1]

- Kongming W, Qinxuan L, 1992. Study on the resurgence caused by insecticides for cotton aphid, Aphis gossypii. Acta Ecologica Sinica. 12(4):341-347.
-
Koo HN, An JJ, Park SE, Kim JI, Kim GH, 2014. Regional susceptibilities to 12 insecticides of melon and cotton aphid, Aphis gossypii (Hemiptera: Aphididae) and a point mutation associated with imidacloprid resistance. J. Crop Sci. 55:91
[https://doi.org/10.1016/j.cropro.2013.09.010]

-
Layton MB, Long JL, Green LM, Winters S, 2003. Cotton aphid insecticide efficacy evaluation, 2002. Arthropod Management Tests. 28(1):F68.
[https://doi.org/10.1093/amt/28.1.F68]

- Microsoft Corporation, 2018. Microsoft Excel, Available at: https://office.microsoft.com/excel
-
Morita M, Ueda T, Yoneda T, Koyanagi T, Haga T, 2007. Flonicamid, a novel insecticide with a rapid inhibitory effect on aphid feeding. J. Pest. Sci. 63(10):969-973.
[https://doi.org/10.1002/ps.1423]

-
Puinean AM, Foster SP, Oliphant L, Denholm I, Field LM, et al., 2010. Amplification of a cytochrome P450 gene is associated with resistance to neonicotinoid insecticides in the aphid Myzus persicae. PLoS Genet. 6(6):e1000999.
[https://doi.org/10.1371/journal.pgen.1000999]

- Rosenheim JA, Fuson KJ, Godfrey LD, 1995. Cotton aphid biology, pesticide resistance and management in the San Joaquin Valley. In: Proceedings of the Beltwide Cotton Conference, Memphis, USA. 6-12 Jan. p. 97.
-
Saito T, Hama H, Suzuki K, 1995. Insecticide resistance in clones of the cotton aphid, Aphis gossypii Glover (Homoptera: Aphididae), and synergistic effect of esterase and mixed-function oxidase inhibitors. Japanese J. Appl. Entomol. Zool. 39(2):151-158.
[https://doi.org/10.1303/jjaez.39.151]

- SAS Institute 2009. SAS users guide; statistics, version 9.1 ed. SAS Institute.
- Slosser JE, Parujulee MN, Idol GB, Rummel DR, 2001. Cotton aphid response to irrigation and crop chemicals. Southwest. Entomol. 26:1-14.
-
Sparks TC, DeBoer GJ, Wang NX, Hasler JM, Loso MR, et al., 2012. Differential metabolism of sulfoximine and neonicotinoid insecticides by Drosophila melanogaster monooxygenase CYP6G1. Pestic. Biochem. Physiol. 103(3):159-165.
[https://doi.org/10.1016/j.pestbp.2012.05.006]

- Sparks TC, Loso MR, Watson GB, Wang NX, Buysse AM, et al., 2019. The sulfoximine insecticides: sulfoxaflor. Modern Crop Protection Compounds. 3, 1336-1361.
-
Sparks TC, Watson GB, Loso MR, Geng C, Babcock JM, et al., 2013. Sulfoxaflor and the sulfoximine insecticides: Chemistry, mode of action and basis for efficacy on resistant insects. Pestic. Biochem. Physiol. 107(1):1-7.
[https://doi.org/10.1016/j.pestbp.2013.05.014]

-
Sun Y, Feng G, Yuan J, Gong K, 1994. Insecticide resistance of cotton aphid in North China. Insect Sci. 1(3):242-250.
[https://doi.org/10.1111/j.1744-7917.1994.tb00250.x]

- Tomizawa M, Casida JE, 2003. Selective toxicity of neonicotinoids attributable to specificity of insect and mammalian nicotinic receptors. Annu. Rev. Entomol. 48(1):339-364.
-
Wang KY, Guo QL, Xia XM, Wang HY, Liu TX, 2007. Resistance of Aphis gossypii (Homoptera: Aphididae) to selected insecticides on cotton from five cotton production regions in Shandong, China J. Pest. Sci. 32(4):372.
[https://doi.org/10.1584/jpestics.G06-51]

-
Watson GB, Loso MR, Babcock JM, Hasler JM, Letherer TJ, et al., 2011. Novel nicotinic action of the sulfoximine insecticide sulfoxaflor. Insect Biochem. Mol. Biol. 41(7):432-439.
[https://doi.org/10.1016/j.ibmb.2011.01.009]

-
Weathersbee IA, Hardee DD, 1994. Abundance of cotton aphids (Homoptera: Aphididae) and associated biological control agents on six cotton cultivars. J. Econ. Entomol. 87(1):258-265.
[https://doi.org/10.1093/jee/87.1.258]

-
Zhu Y, Loso MR, Watson GB, Sparks TC, Rogers RB, et al., 2011. Discovery and characterization of sulfoxaflor, a novel insecticide targeting sap-feeding pests. J. Agric. Food Chem. 59(7):2950-2957.
[https://doi.org/10.1021/jf102765x]

Dong-Hyun Kang, Department of Plant Medicine, Chungbuk National University, Master student https://orcid.org/0009-0003-5568-5879
Yuno Lee, Department of Plant Medicine, Chungbuk National University, Master student
Se Eun Kim, Department of Plant Medicine, Chungbuk National University, Master student
Ha Hyeon Moon, Department of Plant Medicine, Chungbuk National University, Master student
Se Yoon Kim, Department of Plant Medicine, Chungbuk National University, Bachelor student
Jin-Woo Jung, Department of Plant Medicine, Chungbuk National University, Bachelor student
Hyun-Na Koo, Department of Plant Medicine, Chungbuk National University, Doctor of Philosophy
Hyun Kyung Kim, Department of Plant Medicine, Chungbuk National University, Doctor of Philosophy
Gil-Hah Kim, Department of Plant Medicine, Chungbuk National University, Professor, https://orcid.org/0000-0001-6256-8759
Research design; Kim G-H, Investigation; Kang DH, Lee Y, Kim SY[Se Eun], Moon HH, Kim SY[Se Yoon], Jung JW, Data analysis; Kim HK, Kang DH, Writing – original draft preparation; Kim HK, Koo HN, Writing – review & editing; Kim G-H, Kim HK.