
고추 탄저병균 Colletotrichum scovillei에 대한 온도에 따른 살균제의 억제효과 조사
초록
온난화와 그로 인해 발생하는 이상기상 현상은 우리나라 고추탄저병의 발생 빈도와 강도에 영향을 미치고 있다. 본 연구에서는 Colletotrichum scovillei에 의한 고추탄저병을 대상으로 온난화가 살균제의 억제효과에 미치는 영향을 실험을 통해 밝히고자 하였다. 이를 위해 다양한 작용기작을 가진 살균제 4종에 대하여 25oC, 28oC, 30oC의 3개 온도 조건에서 균사생장, 포자발아, 병원성에 대한 억제효과를 검정하였다. C. scovillei의 균사생장 최적 온도인 25oC에서 살균제 4종에 대한 반수영향농도(EC50)를 우선 결정한 후, 3개 온도 조건에서 각 살균제 EC50 농도에서의 C. scovillei 균사생장 억제효과를 조사하였다. Fluazinam, pyraclostrobin, tebuconazole의 균사생장 억제효과는 온도가 상승함에 따라 감소하는 경향을 보였다. Fluazinam의 경우, 온도 상승에 따라 포자발아 억제효과가 증가한 반면, 다른 3종의 살균제에서는 뚜렷한 경향성을 찾을 수 없었다. 식물체 병원성 검정 결과, benomyl과 pyraclostrobin의 병원성 억제효과는 고온에서 증가하였지만, fluazinam과 tebuconazole의 억제효과는 온도의 영향을 받지 않았다. 결과적으로, 본 연구 결과는 기후 변화로 인한 재배 현장의 온난화가 작용기작이 다른 살균제의 고추탄저병 방제에 유의미한 영향을 미칠 수 있음을 보여준다.
Abstract
Anthracnose of pepper (Capsicum annuum L.), caused by Colletotrichum scovillei, is one of the major biotic stresses resulting in extensive loss of pepper yield every year in South Korea. Climate change may influence the effectiveness of fungicides and the efficacy of anthracnose control. However, there are few studies on how temperature increase influences the effectiveness of fungicides. This study investigated the inhibitory effects of four fungicides (benomyl, fluazinam, pyraclostrobin, and tebuconazole) with different modes of action on mycelial growth, conidial germination, and pathogenicity of C. scovillei under different temperature conditions (25oC, 28oC, and 30oC). We investigated half maximal effective concentration (EC50) of each fungicide at 25oC and the variation of the inhibitory effects with elevated temperature. According to Duncan's multiple range test, the inhibitory effect of mycelial growth of C. scovillei treated with fluazinam, pyraclostrobin, and tebuconazole decreased with the rise of temperature. The inhibitory effect of spore germination of C. scovillei treated with fluazinam increased while it was consistent when treated with pyraclostrobin and tebuconazole. The inhibitory effect of pathogenicity of C. scovillei treated with benomyl and pyraclostrobin increased. This study has provided in vitro data for the effects of temperature on fungicide effectiveness, which will help managing anthracnose more effectively in the era of global warming.
Keywords:
Colletotrichum scovillei, Pepper anthracnose, Fungicide, Climate change키워드:
고추 탄저병, 살균제, 기후 변화서 론
고추(Capsicum annuum L.)는 우리나라의 주요 경제작물 중 하나로 벼를 제외한 밭작물 재배면적의 23.7%인 29,770 ha에서 재배되고 있다(Korea Statistical Information Service, 2022). Colletotrichum 속에 의해 발생하는 고추 탄저병은 고추 생산량에 가장 큰 피해를 유발하는 고추의 대표 병 중 하나로 잘 알려져 있다(Giacomin et al., 2020). C. scovillei는 열대 및 온대 지방에서 고추 탄저병을 일으키는 원인균으로 보고된 바 있으며(Caires et al., 2014; Khalimi et al., 2019; Toporek and Keinath, 2020), 우리나라에서도 고추 탄저병을 일으키는 주요 원인균으로 보고된 사례가 있다(Oo et al., 2017). 고추 탄저병은 생육 기간 중 강우가 잦고 고온다습한 8월과 9월에 급격히 발병한다(Lee, 2004; Kwon and Lee, 2002). 비와 바람 등에 의해 전파된 포자는 고추 표면에 부착하며 포자발아 후 부착기를 형성한다(Fu et al., 2021; Peres et al., 2005). 이후 부착기에 형성된 팽압과 분해 효소를 통해 식물체 내로 침입한다(Joshi, 2018). 고추 탄저병에 감염된 고추는 특징적인 반점을 보이며 병이 진행됨에 따라 병반은 점차 확대된다(Kwon and Lee, 2002).
최근 저항성 품종의 재배가 늘어났음에도 우리나라 고추 재배 농가에서는 여전히 화학적 살균제에 의존해 고추 탄저병을 방제하고 있다(Oo et al., 2017). 국내에서는 고추 탄저병 방제를 위해 493 종의 살균제가 등록되어 있으며, 이중 benomyl 계열 살균제가 15 종, pyraclostrobin 계열 살균제가 110 종, fluazinam과 tebuconazole 계열이 각각 38 종, 105 종 등록되어 있다(Rural Development Administration, 2023). 화학적 살균제의 남용은 약제 저항성 균주의 출현을 가속화시켜 농업의 지속가능성을 저해한다. 최근에도 Colletotrichum spp.에서 methyl benzimidazole carbamates, quinone-outside inhibitors, 그리고 demethylation inhibitors 계열 살균제에 대한 약제 저항성 균주의 출현이 보고된 바 있다(Cortaga et al., 2023).
기후 변화는 농업 생태계에 영향을 미치며, 특히 기온은 병원균의 월동과 생존, 개체군 생장에 큰 영향을 준다(Singh et al., 2023). 특히 고온 다습한 환경은 병원균의 개체군 밀도를 높이고 식물병 위험도를 상승시킨다. 예를 들어, 기온과 CO2 농도의 상승은 고추의 역병과 갈색점무늬병의 침입률과 발병도를 증가시키고 고추 탄저병균에 의한 피해 역시 증가시키는 것으로 보고되었다(Kumari, 2019; Shin and Yun, 2010). 살균제의 작용기작에 따라 조금씩 다른 경향성을 보일 것으로 예상되지만, 살균제의 억제효과는 기온, 강수, 습도를 포함한 환경 조건의 영향을 받는 것으로 알려져 있다(Matthiesen and Robertson, 2021; Kumar et al., 2011). 또한 병원균의 생장 최적 온도에서 살균제의 억제효과가 가장 낮은 것으로 알려져 있다(Blumer and Kundert, 1960).
이와 같이 기후 변화에 따른 재배 환경의 변화는 병원균의 생장뿐 아니라 살균제의 억제효과에도 직접적인 영향을 미치는 것으로 예상됨에도 불구하고 이에 대한 연구가 제대로 이루어지고 있지 않다. 앞서 493종의 고추 탄저병 살균제 또한 기후 변화로 인한 기온의 상승, 강수 패턴의 변화 등 재배 환경 변화에 노출될 수밖에 없다. 그럼에도 불구하고 아직 우리나라에서는 다양한 살균제의 고추 탄저병 억제효과와 온도 간의 관계가 체계적으로 연구되지 않았기 때문에, 본 연구에서는 작용기작이 다른 살균제 4종에 대하여 온도에 따른 살균제의 C. scovillei에 대한 억제효과를 조사하였다. 이를 위해 한천희석법과 포자발아 억제 검정법을 이용하였으며 고추 과실에 상처 점적 접종하여 병원성 억제효과를 조사하였다.
재료 및 방법
실험에 사용한 병원균
충북대학교로부터 분양받은 고추탄저병균 C. acutatum s. lat.를 재동정하여 실험에 사용하였다(Damm et al., 2012). 종 동정을 위한 DNA 염기서열 분석을 위해 Internal transcribed spacer (ITS), glyceraldehyde 3-phosphate dehydrogenase (GAPDH), β-tubulin (TUB2) 유전자 부위를 대상으로 각각 ITS1F/ITS4, GDF/GDR1, T1/Bt-2b 프라이머 쌍을 이용해 polymerase chain reaction 증폭을 수행하였다(Table 1). 분석된 염기서열은 MEGA X program에서 maximum likelihood 방법을 사용하여 계통수를 작성하였고, 1,000회 bootstrap을 수행하였다. 본 연구에서 사용한 4종의 살균제 모두에 감수성 반응을 보인 C. scovillei 균주(21SSY1)를 선발하여 다음의 실험을 수행하였다.
실험에 사용한 살균제
다양한 작용기작을 가진 살균제의 온도에 따른 균사생장, 포자발아, 병원성 억제효과 검정을 위해 농촌진흥청 농약안전정보시스템(https://psis.rda.go.kr)에 등록된 고추 탄저병 방제 농약 중 ‘나1’군(B1)인 benomyl (a.i. 95.3%, TECH.), ‘다5’군(C5)인 fluazinam (a.i. 98.3%, TECH.), ‘다3’군(C3)인 pyraclostrobin (a.i. 98.0%, TECH.), ‘사1’군(G1)인 tebuconazole (a.i. 97.0%, TECH.)의 원제를 사용하여 실험을 수행하였다. Tebuconazole과 fluazinam은 acetone에, 그리고 pyraclostrobin과 benomyl은 dimethylsulfoxide (DMSO)에 우선 녹인 후, 다음 각 실험에서 필요한 농도대로 희석하여 사용하였다. DMSO의 효과를 최소화하기 위해 배지 상에서 DMSO의 최종 농도는 1%가 넘지 않도록 조절하였다.
병원균의 배양과 포자 형성
21SSY1 균주를 PDA 배지에 접종하여 25oC의 암조건에서 5일간 배양한 후, 균총의 선단에서 코르크보러로 균사절편(직경 3 mm)을 채취하여 실험에 사용하였다. 포자 형성을 위해서 21SSY1 균주를 V8 juice 배지에 접종하여 25oC의 암조건에서 6일간 배양한 후, 포자 형성을 위해 광조건에서 다시 1일간 배양하였다. 포자가 형성된 배지에 2 mL의 멸균 증류수를 이용하여 포자를 수확하고, 멸균한 2겹의 miracloth에 여과하여 이물질을 제거하였다. 분생포자 현탁액은 12,000 rpm으로 1분씩 2회 원심분리하여 세척한 후, 멸균 증류수를 이용하여 사용하고자 하는 포자 농도로 조정하여 사용하였다.
살균제별 균사생장 EC50값과 포자발아 EC50값 조사
살균제 4종의 농도가 0.001, 0.01, 0.1, 1, 10 μg/mL가 되도록 제조한 PDA 배지에 21SSY1 균사 조각을 치상한 후 25oC, 암조건에서 5일간 배양하였다. 균총의 직경 길이를 조사하여 균사생장 EC50 값을 구하였다. 21SSY1 균주의 분생 포자 현탁액(5 × 104 개/mL)은 다양한 농도로 희석한 4 종의 살균제와 혼합하여 커버 글라스에 20 μL 치상하였다. 커버 글라스를 습실 처리한 후 25oC, 암조건에서 적정 발아 시간인 5.5 시간 동안 배양한 뒤 반복 당 100개 포자의 발아 여부를 조사하여 포자발아 EC50 값을 구하였다(Fu et al., 2021). 각 살균제의 EC50 값은 R software (version 3.4.1)(R Development Core Team, 2009)를 이용하여 ec50estimator package의 ‘estimate_EC50()’ 함수를 통해 계산하였다(Alves, 2020).
온도에 따른 살균제의 균사생장 억제효과
무처리 PDA 배지와 살균제의 최종 농도가 각 살균제의 균사생장 EC50 값이 되도록 희석한 살균제 첨가 배지에 21SSY1 균사 조각을 치상하였다(Table 2). 다양한 온도 조건에서의 예비 실험을 통하여 25oC가 고추탄저병균의 균사생장 최적 온도임을 확인하였고, 30oC를 넘어가면서 생장이 급격히 저해되기 시작하는 것을 확인하였다. 따라서 본 연구에서는 병원균을 암조건, 온도 25oC, 28oC, 30oC에서 5일간 배양한 후 균총의 직경 길이를 측정하였다. 조사는 각 처리당 3개씩 3반복 실시하였으며 아래 식으로 균사생장 억제율을 계산하였다.
균사생장 억제율(%) = {1 - (살균제 첨가 배지의 균총 직경/무처리 PDA 배지에서 균총의 직경)} × 100
온도에 따른 살균제의 포자발아 억제효과
살균제의 최종 농도가 포자발아 EC50 값이 되도록 분생포자 현탁액(5 × 104 개/mL)과 살균제를 혼합한 후 커버 글라스에 20 μL 치상하였다(Table 2). 분생포자 현탁액을 치상한 커버 글라스를 습실 처리한 후 암조건, 온도 25oC, 28oC, 30oC에서 5.5 시간 배양하여 1 반복 당 100개 포자의 발아 여부를 조사하였다. 조사는 각 처리당 3개씩 4반복으로 실시하였고 포자발아 억제율은 아래와 같은 식으로 계산하였다.
포자 발아 억제율(%) = {1 - (살균제 처리구 발아율/대조구 발아율)} × 100
In vivo에서 온도에 따른 살균제의 고추 탄저병 방제 효과 검정
고추 과실에 상처 점적 접종하여 온도에 따른 살균제의 고추 탄저병 병원성 억제 효과를 조사하였다. 분생포자 현탁액의 최종 농도는 106 개/mL이 되도록 희석하였다. 살균제는 상용 농약의 권장 농도에서의 유효성분 약량에 도달하도록 원제를 희석하였다(Table 2). 고추 과실은 물과 1% NaOCl로 세척한 후 70% 에탄올로 소독한 뒤 실험실 내에서 풍건하였다. 건조한 고추 과실 표면에는 소독한 주사바늘(Doowon Meditec)을 이용하여 상처를 내고, 흄후드 내에서 살균제를 분사한 후 풍건하였다. 15 μL의 분생포자 현탁액을 접종한 후 습실 처리하여 암조건, 온도 25oC와 30oC에서 5 일간 배양 후 병반의 장경과 단경을 측정하여 평균직경을 구하였다. 조사는 각 처리당 3개씩 3반복으로 수행하였으며 병원성 억제율은 아래 식에 의하여 계산하였다.
병원성 억제율(%) = {1 - (살균제 처리 고추의 병반 평균 직경/무처리 고추의 병반 평균 직경)} × 100
통계 처리
본 연구결과의 통계분석을 위해 R software (version 3.4.1) (R Development Core Team, 2009)를 사용하였다. 온도에 따른 살균제의 균사생장과 포자발아, 고추 탄저병 방제 효과 검정 실험에서 각 처리 간의 유의성은 Duncan의 다중검정(P < 0.05)을 이용하여 검증하였다.
결과 및 고찰
병원균 동정
병원균의 동정을 위하여 ITS, GAPDH, TUB2 유전자의 염기서열을 분석하였다. 그 결과 균주 21SSY1은 C. scovillei CBS 126529와 99%의 상동성을 보임을 확인할 수 있었다(Fig. 1). 형태적 특성 또한 2017년 Oo 등(2017)에 의해서 보고된 C. scovillei와 동일한 표현형(균총, 포자, 병징)을 보이는 것으로 확인하였다(data not shown).

A phylogenetic tree constructed with the maximum likelihood analysis using combined nucleotide sequence of genes (ITS, GAPDH and TUB2) from the pepper anthracnose pathogen 21SSY1 and its related Colletotrichum species. Numbers on nodes are bootstrap values obtained after a bootstrap test with 1,000 replications. The bar indicates 1% sequence dissimilarity.
C. scovillei에 대한 살균제 4종의 EC50 값 조사
살균제 4종에 대하여 C. scovillei 감수성 균주(21SSY1)의 균사생장 EC50 값과 포자발아 EC50 값을 조사하였다(Table 2). 유사분열 저해 살균제인 ‘나1’군 benomyl은 포자발아 EC50 값이 2.5 μg/mL로 균사생장 EC50 값 1μg/mL에 비해 높게 나타났다. 호흡 저해 살균제인 ‘다5’군 fluazinam, ‘다3’군 pyraclostrobin의 균사생장 EC50 값은 각각 0.5 μg/mL, 0.3 μg/mL로 0.07 μg/mL, 0.002 μg/mL인 포자발아 EC50 값 보다 높게 나타났다. 에르고스테롤 생합성 저해 살균제인 ‘사1’군 tebuconazole의 포자발아 EC50 값은 fluazinam과 pyraclostrobin에 비하여 상대적으로 높게 나타났다. 살균제는 검정법에 따라서 병원균에 대한 억제효과가 다르게 나타날 수 있다. 예를 들어, C. acutatum의 포자 단계에 tebuconazole과 fluazinam을 처리하고 PrestoBlue 시약을 사용하여 병원균의 호흡 억제 효과를 검정했을 때, tebuconazole은 fluazinam에 비해 효과적이지 않은 것으로 나타났다(Park and Kim, 2023). 호흡 저해 살균제인 fluazinam과 pyraclostrobin의 경우 세포 호흡을 직접 억제하기 때문에 포자 발아 EC50 값이 균사생장 EC50 값에 비하여 낮게 나타난 것으로 생각된다.
온도에 따른 살균제별 균사 생장 억제효과
온도에 따른 살균제별 균사생장 억제율 조사를 위해 21SSY1을 각 살균제가 첨가된 PDA 배지에 배양하여 균총의 크기를 측정하였다(Fig. 2). 살균제를 첨가하지 않은 대조구에서는 온도가 높아질수록 균총의 크기가 줄어든 반면, 살균제가 첨가된 처리구에서는 살균제별로 조금씩 다른 경향성을 보였다. Benomyl 처리구는 대조구와 유사한 결과를 보였지만, 다른 3종의 살균제 처리구에서는 온도간 균총 크기의 변화가 크지 않았다. 실제로 살균제별 균사생장 억제율 결과에서 benomyl과 다른 3종 살균제에 의한 억제율이 온도에 따라 다른 경향성을 보이는 것을 확인할 수 있었다(Fig. 3). ‘나1’군 benomyl은 25oC, 28oC, 30oC에서의 균사생장 억제율 평균이 각각 45.85%, 61.27%, 57.51%로 조사되어, 균사생장 억제효과는 C. scovillei의 생장 최적 온도인 25oC에서 가장 낮고 28oC에서 가장 높은 것으로 나타났다. 앞서 대조구와 benomyl 처리구 모두에서 온도가 증가할수록 21SSY1의 균사 생장이 감소하였지만(Fig. 2), 대조구에 비해 처리구에서 균사생장이 더 큰 폭으로 감소하였기 때문에(특히 28oC에서) benomyl의 균사생장 억제효과가 높게 나타났다(Fig. 3). 이는 C. scovillei의 생장 최적 온도(25oC)와 benomyl의 작용 최적 온도(28oC)가 다르기 때문에 나타나는 현상이라는 추론이 가능하다. 한편, 호흡 저해 살균제인 fluazinam, pyraclostrobin과 에르고스테롤 생합성 저해 살균제인 tebuconazole은 온도가 증가함에 따라 균사생장 억제율이 감소하는 경향성을 보였다(Fig. 3B, 3C, and 3D). 다만 tebuconazole의 균사생장 억제율은 25oC, 28oC, 30oC로 온도가 증가함에 43.91%, 34.54%, 16.64%로 모든 온도 조건에서 유의미하게 감소한 반면, fluazinam과 pyraclostrobin은 각각 28oC와 30oC, 25oC와 28oC에서의 균사생장 억제율이 통계적으로 유의미하게 차이가 나타나지는 않았다. 결과적으로 benomyl을 제외한 3종의 살균제 처리구의 경우, 살균제로 인한 균사생장 억제효과가 고온에 대한 반응을 상쇄했거나, 또는 온도 증가로 인해 C. scovillei에 대한 살균제의 억제효과가 줄어들었다고 해석할 수 있다.
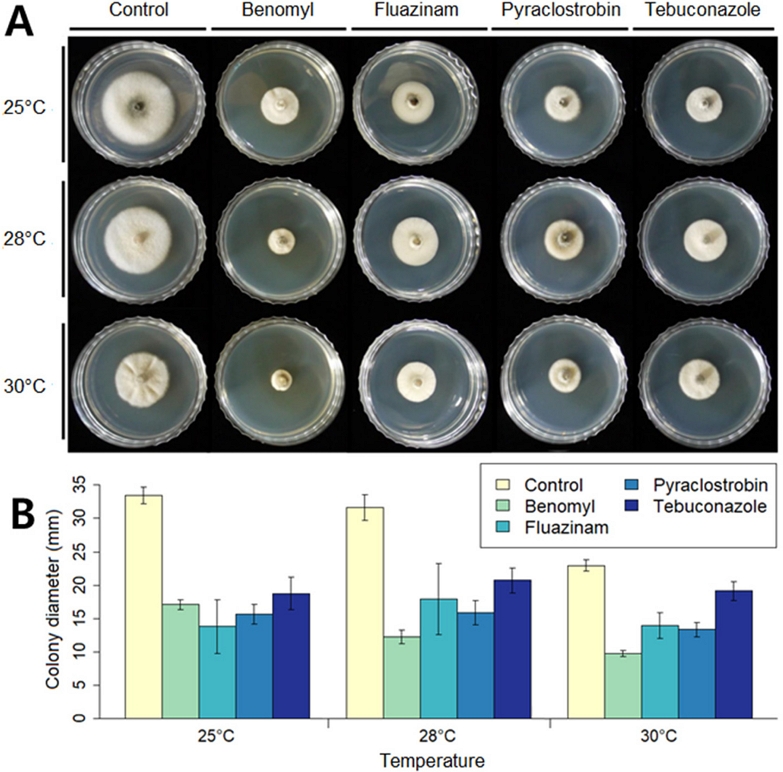
Mycelial growth of Colletotrichum scovillei 21SSY1 on the fungicide-containing growth media under different temperature conditions.
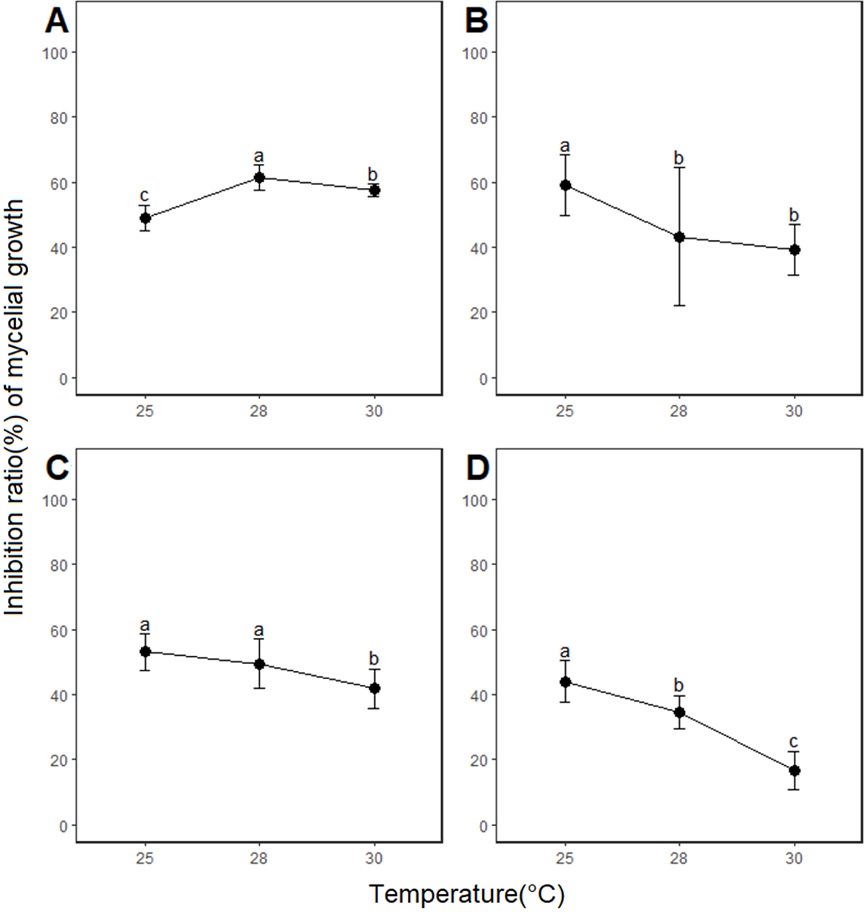
Inhibition ratio of mycelial growth of Colletotrichum scovillei 21SSY1 to four fungicides under different temperature conditions. Values labeled with the same letter are not significantly different in Duncan’s multiple range test at P=0.05. A, benomyl; B, fluazinam; C, pyraclostrobin; D, tebuconazole.
온도에 따른 살균제별 포자발아 억제효과
온도에 따른 살균제별 포자발아 억제효과는 21SSY1 분생포자 현탁액을 살균제와 혼합하여 치상한 후 포자 발아율을 측정하여 조사하였다(Fig. 4). 25oC, 28oC, 30oC로 온도가 증가함에 따라 fluazinam의 포자발아 억제율은 평균 65.93%, 59.18%, 41.78%로 통계적으로 유의하게 감소하는 결과를 보여, 앞서 온도에 따른 균사생장 억제효과(Fig. 3B)와 유사한 경향성을 보였다. 반면, pyraclostrobin과 tebuconazole의 온도에 따른 포자발아 억제율은 통계적으로 유의미한 차이를 보이지 않았다(Fig. 4C and 4D). Benomyl의 포자발아 억제율은 각 온도 조건에서 평균 43.17%, 35.09%, 49.22%로 나타나(Fig. 4A) 앞서 균사생장 억제효과(Fig. 3A)와 28oC에서 서로 다른 결과를 보였지만, 그럼에도 불구하고 온도가 상승함에 따라 살균제의 억제효과가 증가하는 유사한 경향성을 확인할 수 있었다. 또한 benomyl이 속한 ‘나1’군 살균제는 일반적으로 포자발아 억제효과보다는 균사생장 억제효과가 더 우수한 특성을 가지고 있는데(Jaspers, 2001), 본 실험결과에서도 각 온도조건에서 균사생장 억제율이 포자발아 억제율보다 조금식 더 상회하는 결과를 볼 수 있었다.
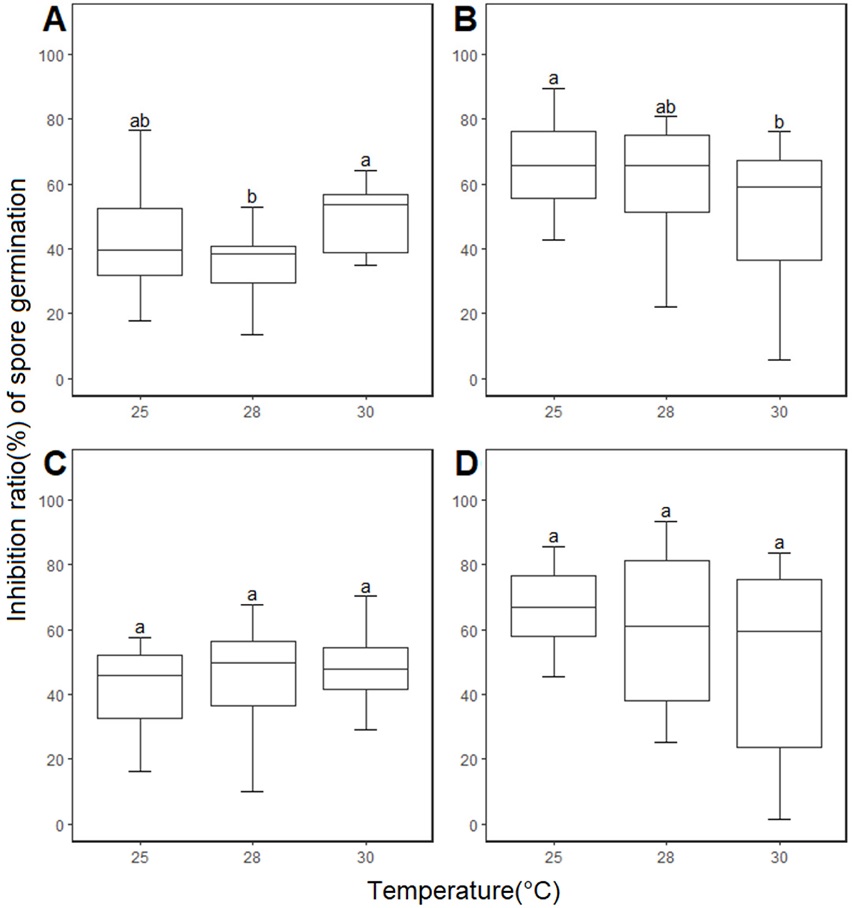
Inhibition ratio of spore germination of Colletotrichum scovillei 21SSY1 to four fungicides under different temperature conditions. Values labeled with the same letter are not significantly different in Duncan’s multiple range test at P=0.05. A, benomyl; B, fluazinam; C, pyraclostrobin; D, tebuconazole.
온도에 따른 살균제별 병원성 억제효과
온도에 따른 살균제별 병원성 억제효과를 조사하기 위해 고추 과실에 21SSY1을 상처 점적 접종한 후 5일 후에 병반의 평균직경을 측정하였다(Fig. 5). 균사생장과 마찬가지로 살균제를 처리하지 않은 대조구에서 탄저병 병반 크기가 25oC에서 30oC로 온도가 증가함에 따라 감소하는 것을 확인하였다. 이를 통해 C. scovillei의 식물체 내 생장과 병징의 출현이 25oC에서 더 활발하게 이루어짐을 알 수 있었다. 대조구와 살균제 처리구 간 병반 크기를 바탕으로 병원성 억제율을 계산하였다(Fig. 6). Benomyl 처리구에서는 25oC에서 30oC로 온도가 증가함에 따라 살균제의 병원성 억제율이 39.07%에서 60.84%로 증가하여 균사생장 억제율과 유사한 경향성을 볼 수 있었다. 하지만, 나머지 3종 살균제의 병원성 억제 실험 결과는 앞선 균사생장 억제 실험과 다르게 나타났다. Pyraclostrobin 처리구의 경우, 25oC에 비해 30oC에서 병원성 억제율이 56.10%에서 63.42%로 증가해 감소하는 경향성을 보인 균사생장 억제율과 다른 결과를 보였다. Fluazinam과 tebuconazole 처리구의 균사생장 억제율은 감소한 반면, 식물체에서의 병원성 억제율은 온도조건 간 통계적으로 유의미한 차이를 볼 수 없을 정도로 온도와 관계없이 유사한 병원성 억제효과를 보였다(Fig. 6).
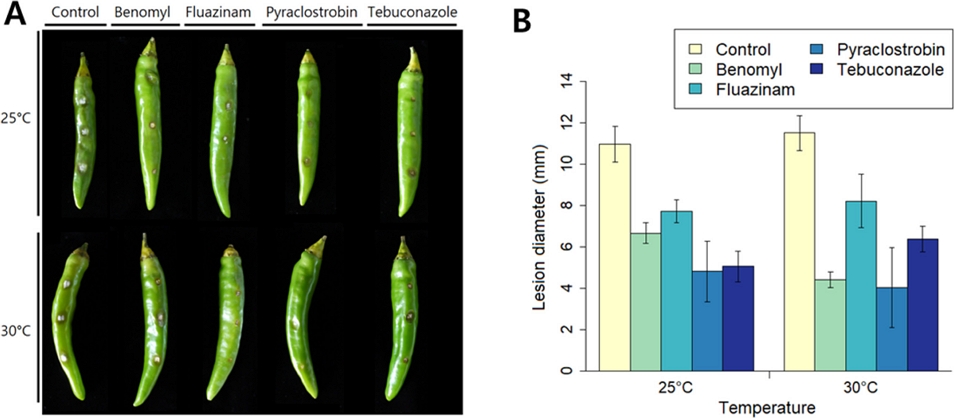
Control effect of four fungicides on pepper anthracnose caused by Colletotrichum scovillei 21SSY1 in a wound inoculation experiment. Lesion diameters were measured to compare the control effects of four fungicides.
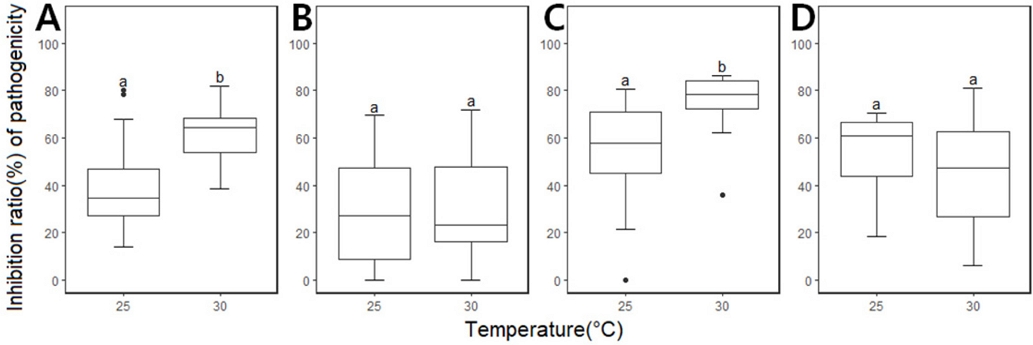
Inhibition ratio of pathogenicity of Colletotrichum scovillei 21SSY1 to four fungicide under different temperature conditions. Values labeled with the same letter are not significantly different in Duncan’s multiple range test at P=0.05. A, benomyl; B, fluazinam; C, pyraclostrobin; D, tebuconazole.
병원성 억제 실험에서는 앞선 균사생장 억제 실험에 비해 결과의 분산(variance)이 상대적으로 크게 나타났다. 실험실 내에서 병원균을 식물체에 상처 점적 접종하는 병원성 검정에서는 시중에서 판매하는 고추 과실을 사용하였기 때문에 확인 불가한 다양한 변인 통제에 미흡함이 있었을 것이다. 수확 직전 침투성 살균제 살포여부, 고추 열매의 생리적 영양 상태나 생육 나이(수확시기) 등이 실험 결과에 영향을 미쳤을 가능성이 존재한다. 실제로 Kwon과 Lee (2002)는 미숙과에서 고추 탄저병 병원균 침입이 용이한 것으로 보고한 바 있다. 또한 고추 품종을 특정할 수 없었기 때문에 실험에 사용한 고추 품종의 탄저병 저항성 정도 또한 실험결과에 영향을 미쳤을 것이다(Oo 등, 2017; Yoon 등, 2004). 이러한 다양한 변인 통제를 위해 품종을 특정하고 생육 환경을 일정하게 유지하여 재배한 고추 과실을 사용하고, 포장에서의 병원성 검정을 추가로 실시하여 다각도로 살균제의 병원성 억제효과를 조사할 필요성이 있다.
본 연구에서 온도에 따른 균사생장, 포자발아, 병원성 억제효과의 증감 경향성이 일부 살균제에서 다르게 나타남을 확인하였다. 이전 연구에서도 살균제의 억제효과가 조사 방법에 따라 다르게 나타난 경우도 있었지만(Park and Kim, 2022), 이에 대한 추가적인 고찰이 필요하다. 온도에 따라 살균제의 억제효과가 증가하거나 감소하는 현상은 고온이나 저온 스트레스에 의해 병원균의 적응력이 감소함으로써 나타나는 간접적인 영향일 수도 있다(Juroszek et al., 2022). 또한 살균제의 억제효과는 병원균의 생장 최적 온도에서 가장 낮은 것으로 나타났다(Blumer and Kundert, 1960). 즉, 살균제의 억제효과는 병원균의 적응력에 가장 큰 영향을 받으며 병원성, 포자 생성 등으로 나타나는 병원균의 적응력이 강할수록 살균제의 억제효과는 약하게 나타난다는 것이다. 그러나 C. scovillei에 대한 온도에 따른 살균제별 억제효과를 측정한 결과, 생장 최적 온도보다 높은 온도 조건임에도 불구하고 일부 살균제의 억제효과는 오히려 감소하였다. 이러한 결과는 병원균의 생장 최적 온도만이 아니라 살균제의 특성 또한 온도에 따른 살균제의 억제효과에 영향을 미칠 수 있는 요인임을 나타낸다. 따라서 보다 명확한 해석을 위해서는 보다 광범위한 요인들(기주식물, 병원균, 살균제의 작용기작 및 화학적 특성 등)의 환경에 대한 반응 연구가 함께 수행될 필요가 있다. 이를 통해 온도의 상승이 살균제의 억제효과에 영향을 미치며, 살균제의 억제효과에는 병원균의 생장 최적 온도뿐만 아니라 살균제의 작용 기작을 비롯한 다양한 요인이 작용하고 있음을 밝힐 수 있다.
Lurwanu 등(2021)은 기온이 상승할수록 감자역병균의 ‘다3’군 살균제 azoxystrobin에 대한 내성이 감소하고, 살균제 내성이 강한 균주일수록 기온에 대하여 더 넓은 생태 지위를 가진다고 하였다. 물론 실제 포장에서의 토양, 기상, 작물의 생육 상태 등 다양한 요인을 고려해야 하지만, 본 연구가 밑거름이 되어 온도에 따른 C. scovillei에 대한 살균제의 억제효과를 명확히 조사함으로써 기후 변화로 인해 온난화된 재배현장에 유리한 살균제를 선발하고, 효과적인 살균제의 사용 시기나 방법, 그리고 다른 비화학적 방제 방법을 포함한 통합 식물병 관리 전략을 수립할 필요가 있다.
Acknowledgments
본 연구는 농촌진흥청의 연구과제(PJ01690606)의 지원으로 수행되었습니다.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
- Alves KS, 2020. ec50estimator: An Automated Way to Estimate EC50 for Stratified Datasets.
- Blumer S, Kundert J, 1960. On the effect of temperature on fungicide action. Landwirtschaftliches Jahrbuch der Schweiz 9(5):465-495.
-
Caires NP, Pinho DB, Souza JSC, Silva MA, Lisboa DO, et al., 2014. First report of anthracnose on pepper fruit caused by Colletotrichum scovillei in Brazil. Plant Dis. 98(10):1437.
[https://doi.org/10.1094/PDIS-04-14-0426-PDN]

-
Cortaga CQ, Cordez BWP, Dacones LS, Balendres MAO, Cueva FMD, 2023. Mutations associated with fungicide resistance in Colletotrichum species: A review. Phytoparasitica. 51:569-592.
[https://doi.org/10.1007/s12600-023-01063-0]

-
Damm U, Cannon PF, Woudenberg JH, Crous PW, 2012. The Colletotrichum acutatum species complex. Stud. Mycol. 73(1):37-113.
[https://doi.org/10.3114/sim0010]

-
Fu T, Han JH, Shin JH, Song H, Ko J, et al., 2021. Homeobox transcription factors are required for fungal development and the suppression of host defense mechanisms in the Colletotrichum scovillei- pepper pathosystem. mBio 12(4):e01620-21.
[https://doi.org/10.1128/mBio.01620-21]

-
Giacomin RM, Ruas CDF, Moreira AFP, Guidone GHM., Baba VY, et al., 2020. Inheritance of anthracnose resistance (Colletotrichum scovillei) in ripe and unripe Capsicum annuum fruits. J. Phytopathol. 168(3):184-192.
[https://doi.org/10.1111/jph.12880]

- Jaspers MV, 2001. Effect of fungicides, in vitro, on germination and growth of Phaeomoniella chlamydospora. Phytopathol. Mediterr. 40:S453-S458.
-
Joshi R, 2018. A review on Colletotrichum spp. virulence mechanism against host plant defensive factors. J. Med. Plants Stud. 6(6):64-67.
[https://doi.org/10.22271/plants.2018.v6.i6b.02]

-
Juroszek P, Laborde M, Kleinhenz B, Mellenthin M, Racca P, et al., 2022. A review on the potential effects of temperature on fungicide effectiveness. Plant Pathology 71(4):775-784.
[https://doi.org/10.1111/ppa.13531]

- Khalimi K, Darmadi A, Suprapta D, 2019. First report on the prevalence of Colletotrichum scovillei associated with anthracnose on chili pepper in Bali, Indonesia. Int. J. Agric. Biol. 22(2):363-368.
- Korea Statistical Information Service. 2023. https://kosis.kr/index/index.do, (Accessed Jun. 22. 2023).
-
Kumar R, Pandey M, Chandra R, 2011. Effect of relative humidity, temperature and fungicide on germination of conidia of Cercospora canescens caused the Cercospora leaf spot disease in mungbean. Arch. Phytopathol. Plant Prot. 44(16):1635-1645.
[https://doi.org/10.1080/03235408.2010.548968]

-
Kumari M, Verma SC, Bhardwaj SK, 2019. Effects of elevated CO2 and temperature on crop growth and yield attributes of bell pepper (Capsicum annuum L.). J. Agrometeorol. 21(1):1-6.
[https://doi.org/10.54386/jam.v21i1.195]

-
Kwok IMY, Loeffler RT, 1993. The biochemical mode of action of some newer azole fungicides. Pestic. Sci. 39(1):1-11.
[https://doi.org/10.1002/ps.2780390102]

-
Kwon CS, Lee SG, 2002. Occurrence and ecological characteristics of red pepper anthracnose. Res. Plant Dis. 8(2):120-123. (In Korean)
[https://doi.org/10.5423/RPD.2002.8.2.120]

- Lee SC, 2004. Control of major disease in greenhouse crops. Kor. Res. Soc. Protected Hort. 17(2):2-9. (In Korean)
-
Lurwanu Y, Wang YP, Wu EJ, He DC, Waheed A, et al., 2021. Increasing temperature elevates the variation and spatial differentiation of pesticide tolerance in a plant pathogen. Evol. Appl. 14(5):1274-1285.
[https://doi.org/10.1111/eva.13197]

-
Matthiesen RL, Robertson AE, 2021. Comparison of aggressiveness and fungicide sensitivity of four Pythium spp. that cause damping-off of soybean in the United States, Can. J. Plant Pathol. 43(5):769-782.
[https://doi.org/10.1080/07060661.2021.1881162]

-
Oakley BR, Morris NR, Nuclear movement is β-tubulin-dependent in Aspergillus nidulans. 1980. Cell. 19(1):255-262.
[https://doi.org/10.1016/0092-8674(80)90407-9]

-
Oo MM, Lim GT, Jang HA, Oh SK, 2017. Characterization and pathogenicity of new record of anthracnose on various chili varieties caused by Colletotrichum scovillei in Korea. Mycobiology. 45(3):184-191.
[https://doi.org/10.5941/MYCO.2017.45.3.184]

-
Park SB, Kim HT, 2022. Cross-resistance of Colletotrichum acutatum s. lat. to strobilurin fungicides and inhibitory effect of fungicides with other mechanisms on C. acutatum s. lat. resistant to pyraclostrobin. Res. Plant Dis. 28(3):122-131. (In Korean)
[https://doi.org/10.5423/RPD.2022.28.3.122]

-
Park SB, Kim HT, 2023. Evaluation of acitivity of QoI fungicide against Colletotrichum acutatum s. lat. causing pepper anthracnose using resazurin-based respiration assay. Res. Plant Dis. 29(1):11-22. (In Korean)
[https://doi.org/10.5423/RPD.2023.29.1.11]

-
Peres NA, Timmer LW, Adaskaveg JE, Correll JC, 2005. Lifestyles of Colletotrichum acutatum. Plant Dis. 89(8):784-796.
[https://doi.org/10.1094/PD-89-0784]

- Rural Development Administration, 2023. Pesticide Safety Information System. https://psis.rda.go.kr/psis/index.ps, (Accessed Jul. 13. 2023).
-
Shin JW, Yun SC, 2010. Elevated CO2 and temperature effects on the incidence of four major chili pepper diseases. Plant Pathol. J. 26(2):178-184.
[https://doi.org/10.5423/PPJ.2010.26.2.178]

-
Singh BK, Delgado-Baquerizo M, Egidi E, Guirado E, Leach JE, et al., Climate change impacts on plant pathogens, food security and paths forward. Nat. Rev. Microbiol. 21:640-656.
[https://doi.org/10.1038/s41579-023-00900-7]

-
Toporek SM, Keinath AP, 2021. First report of Colletotrichum scovillei causing anthracnose fruit rot on pepper in South Carolina, United States. Plant Dis. 105(4):1222.
[https://doi.org/10.1094/PDIS-08-20-1656-PDN]

- Yoon JB, Yang DC, Lee WP, Ahn SY, Park HG, 2004. Genetic resources resistant to anthracnose in the genus Capsicum. J. Kor. Soc. Hort. Sci. 45(6):318-323.
Min Son, Research Institute of Agriculture and Life Science, Seoul National University, Bachelor, https://orcid.org/0009-0002-0192-4523
Jeong-Hyeon Byeon, Department of Agricultural Biotechnology, Seoul National University, Bachelor
Noh-Hyun Lee, Department of Agricultural Biotechnology, Seoul National University, Ph.D. student
Kwang-Hyung Kim, Research Institute of Agriculture and Life Sciences, Seoul National University; Department of Agricultural Biotechnology, Seoul National University, Professor, https://orcid.org/0000-0003-3265-5899
Experimental design, Min Son, Jeong-Hyeon Byeon, Noh-Hyun Lee and Kwang-Hyung Kim; Experiments and analysis, Min Son and Jeong-Hyeon Byeon; Manuscript writing, Min Son and Kwang-Hyung Kim; Manuscript review, Jeong-Hyeon Byeon, Noh-Hyun Lee and Kwang-Hyung Kim

