
내분비장애의심농약 판별을 위한 호르몬수용체 전사활성시험법 확립
 ; Ji-Yeon Yang
; Ji-Yeon Yang ; Jeong-Hyun Lim ; Soo-Jin Park
; Jeong-Hyun Lim ; Soo-Jin Park ; Ji-Young Shin
; Ji-Young Shin ; Si Young Yang
; Si Young Yang ; Geun-Hwan Gil
; Geun-Hwan Gil
초록
농약은 내분비계장애물질(Endocrine disruptors) 분류에서 주요 카테고리로 분류되어왔다. 농촌진흥청 「농약 및 원제의 등록기준」은 동물실험을 통해 내분비계장애물질을 검색할 수 있도록 반복투여독성시험 및 번식독성시험 등이 고시 되어있다. 그러나 이러한 시험법은 복합적인 내분비 기전 및 영향에 대해 평가할 수 없고, 오랜 기간이 소요되어 검색할 농약이 내분비장애물질인지 확인하기 위해서는 적합하지 않다. 따라서 본 연구에서는 OECD TG 455와 458로 등재된 내분비계장애물질을 검색하는 시험법 중 기전자료를 제공하는 체외(in vitro) 시험법에 대하여 확립하였다. 본 시험법을 농약 평가에 적용하기에 앞서, 가이드라인에서 제시하고 있는 세포안정성시험과 숙련도물질에 대한 조건을 확립하였다. 그 결과, 인체자궁유래세포(hERα-Hela-9903)를 이용한 에스트로겐 전사활성시험법에서는 작용물질시험(agonist assay)에서 10종 시험물질 중 양성물질 8종과 음성물질 2종을 확인하였으며, 길항물질시험(antagonist assay)에서 10종의 시험물질에 대하여 양성물질 3종과 음성물질 7종을 확인하였다. 인체전립선유래세포(22Rv1/MMTV_GR-KO)를 이용한 안드로겐 전사활성시험법에서는 작용물질시험(agonist assay)에서 8종 시험물질 중 양성물질 5종과 음성물질 3종을 확인하였으며, 길항물질시험(antagonist assay)에서 9종의 시험물질에 대하여 양성물질 5종과 음성물질 4종을 확인하였다. 따라서 본 연구를 통하여 내분비계 독성 기전을 확인할 수 있고 신속하게 스크리닝 할 수 있는 시험법을 확립하고, 향후 다양한 농약에 대한 내분비장애의심농약을 평가하는데 활용하고자 한다.
Abstract
Pesticides have been classified as a major category in the classification of endocrine disruptors. Rural Development Administration “Registration Standards for Pesticides and technical concentrate” announces repeated-dose toxicity tests and reproductive toxicity tests to detect endocrine disruptors through animal testing. However, this test method cannot evaluate complex endocrine mechanisms, and takes a long period of time, so it is not suitable for confirming whether it is an endocrine disruptor. Therefore, in our study, an in vitro test method that provides mechanistic data was established among the test methods to search for endocrine disruptors listed as OECD TG 455 and 458. Before applying this test method to pesticide evaluation, the conditions for the cell stability test and proficiency material suggested in the guideline were established. As a result, the estrogen transcriptional activity test method using human uterine derived cells (hERα-Hela-9903) accurately predicted 8 positive substances and 2 negative substances out of 10 test substances in the agonist assay. In the antagonist assay, 3 positive substances and 7 negative substances were accurately predicted for 10 test substances. The androgen transcription activity test method using human prostate-derived cells (22Rv1/MMTV_GR-KO) accurately predicted 5 positive substances and 3 negative substances out of 8 test substances in the agonist assay and the antagonist assay, 5 positive substances and 4 negative substances were accurately predicted for 9 test substances. Therefore, in this study, we established an alternative animal test method to confirm endocrine mechanism, and we plan to use it to evaluate various pesticides suspected of causing endocrine disruption in the future.
Keywords:
Endocrine disruptor, Pesticide, Steroid hormone receptor transcriptional activation methods키워드:
내분비계장애물질, 농약, 스테로이드호르몬수용체 전사활성시험서 론
내분비계장애물질(Endocrine disruptors)은 갑상선 및 성호르몬과 같은 내분비호르몬의 기능을 방해하거나 혼란을 일으키는 물질로서, 당대와 그 다음세대의 건강에 영향을 미치는 물질로 정의된다(Diamanti-Kandarakis et al., 2009). 내분비호르몬은 성장, 발육, 생식에 대한 조절 및 체내의 항상성 유지 등 체내에서 중요한역할을 하기 때문에 내분비계 장애물질은 이러한 작용을 방해하는 외인성 물질이라 규정할 수 있다(Hiller-Sturmhofel et al., 1998). 특히 극미량으로도 기능장해를 유발할 수 있고, 강한 지용성을 가져 자연적인 먹이사슬을 통해 동물이나 사람의 체내, 지방조직 등에 축적되나, 쉽게 분해되지 않는 특성을 가지기 때문에 안전관리 측면에서 더욱 주의를 요하는 물질이다(Hu et al., 2010; Kabir et al., 2015). 내분비계 장애와 관련된 연구결과 및 사례가 보고된 대표적물질로는 비스페놀류, 프탈레이트, 과불화합물, 그리고 농약류가 포함된다(Rubin, 2011; Monneret, 2017; Coperchini et al., 2017; Hong et al., 2020McKinlay et al., 2008). 특히 농약은 세계야생생물보호기금 분류 및 일본의 후생성 분류 등에서 주요 카테고리로 분류되어 왔다. 농약분야에서는 살충제인 디디티(DDT)의 유해성 연구가 시작되면서 꾸준히 관심 받아왔다.
경제협력개발기구(Organization for Economic Co-operation and Development, OECD)는 1998년부터 화학물질생명공학위원회 국가시험지침프로그램조정자 작업반(Working group of the National coordinators of the Test guidelines programme, WNT) 산하에 내분비시험법 자문그룹을 구성하면서 본격적으로 내분비계장애물질을 검색할 수 있는 시험법을 제정하였다(OECD, 2005; OECD, 2010). 내분비계교란 물질을 평가하는 검색체계를 서술하고 있는 OECD 지침문서 150번에 따르면, 어떤 수준에 대한 자료를 제공할 수 있는 시험법인지에 따라서 5단계로 분류된다(OECD, 2018a). 우리나라에서는 농촌진흥청 고시 「농약 및 원제의 등록기준」에 체내 시험법(in vivo) 중에서 4-5단계에 해당하는 시험법으로 반복투여독성시험, 번식독성시험 및 생식독성시험 등 복합적인 내분비 기전 및 영향에 대해서 평가할 수 있는 시험법이 포함되어 있다(RDA, 2023). 특히, 국제적으로 내분비영향에 대하여 주요 독성 지표로 인식하면서 2018년 개정된 OECD 반복독성시험 가이드라인에서는 내분비호르몬을 분석할 것을 권장하고 있다(OECD, 2018b). 그러나 이러한 시험법들은 내분비계장애물질을 빠르게 검색할 수 없고, 고비용이라는 단점이 있다.
따라서 OECD에서는 이러한 문제점들을 해결하기 위하여 frame work 2단계에 해당하는 기전자료를 제공하는 체외(in vitro) 시험을 통해 내분비계장애물질을 신속하게 검색하고자 하였다. 이에 해당하는 시험법은 호르몬 수용체를 이용한 in vitro (실험실 내) 시험법으로, 에스트로겐 수용체(estrogen receptor, ER), 안드로겐 수용체(androgen receptor, AR), 갑상선호르몬 수용체(thyroid receptor, TR)와의 결합 친화력을 분석하여 각 호르몬 작용 기전을 확인할 수 있다(OECD, 2021; OECD, 2023).
농약 규제적인 측면에서, 유럽연합(EU)의 경우 위험성 통과 기준(cut-off criteria)을 적용하여, 발암성·유전독성·생식독성(Carcinogenicity · Mutagenicity · Reproductive toxicity, CMR)을 가지는 고위험 물질 뿐만 아니라 내분비계교란을 일으키는 농약인 경우 등록되지 않도록 규제하고 있다. 특히 2018년 EU의 내분비계장애농약 분류에 대한 설정계획을 발표하면서 내분비계 교란 가능성이 있는 농약이 다시금 주목받게 되었으며(Minif et al., 2011), 2025년까지 내분비장애물질에 대한 정보 및 분류를 발표하는 등 위험물질로 관리하겠다는 계획이 구체화 되었다(ECHA, 2023).
에스트로겐은 여성의 체내에서 월경주기형성, 자궁내막증식, 난포의 성숙 및 배란촉진 등의 역할을 한다(Deroo et al., 2006). 마찬가지로 안드로겐은 남성의 특징을 유지하고 발달하도록 하는 호르몬으로서 두가지 호르몬 모두 생식기계의 발달에 영향을 준다(Davison et al., 2006). 따라서, 본 연구에서는 frame work 2단계에 해당하는 기전자료를 제공하는 체외(in vitro) 시험법 중 인체에 직접적으로 노출되어 영향을 미칠 수 있는 에스트로겐과 안드로겐 교란물질을 확인할 수 있는 두가지 시험법의 조건을 확립하고자 하였다.
재료 및 방법
세포주 배양
본 연구에서 사용한 hERα-Hela-9903 세포주는 인체자궁유래세포로서 Japanese Collection of Research Bioresources(JCRB) Cell Bank에서 유전자변형세포 수입승인 절차를 통해서 구매하였으며, 22Rv1/MMTV_GR-KO 세포주는 인체전립선유래세포로서 한국생명공학연구원 생물자원센터(Korean Collection for Type Cultures, KCTC)에서 구입하였다. 세포배양배지는 hERα-Hela-9903 세포주의 경우 10% Dextran coated charcoal treated fetal bovine serum (DCC-FBS)과 60 mg/L Kanamycin이 포함된 Eagle’s Minimum Essential Medium(EMEM, phenol red free) 배지를 사용하였다. 22Rv1/MMTV_GR-KO 세포주의 경우 10% FBS가 포함된 RPMI1640 배지를 사용하고, 안드로겐 수용체 활성분석 전에 5% FBS가 포함된 페놀레드가 포함되지 않은 RPMI1640 배지를 사용하였다. 두 배지 모두 2mM Gluta-MAX, 0.25 μg/mL Amphotericin B, 100 units/mL Penicillin, 100 μg/mL Streptomycin를 포함하였다. 각 세포는 30계대를 넘기지 않게 배양하였다.
시험 물질
본 연구는 OECD 시험법 가이드라인 TG 455 및 TG 458에 등재된 에스트로겐 및 안드로겐 수용체 전사활성시험법에 의거하여 수행하였다. 각 가이드라인에 제시된 숙련도 물질은 Table 1과 같다. 에스트로겐 수용체 전사활성시험법의 양성대조물질로는 1 nM 및 25 pM의 17β-estradiol을, 안드로겐 수용체 전사활성시험법의 양성대조물질은 10 nM 및 800 pM의 5α-dihydrotestosterone을 사용하였다. 모든 시약은 Sigma-Aldrich (St. Louis, MO, USA)에서 구입하여 dimethyl sulfoxide (DMSO, Sigma-Aldrich, St. Louis, MO, USA)에 녹여 시험 당일에 사용하였다.
에스트로겐 수용체 전사활성시험법(Stably Transfected Transactivation Assay, STTA)
에스트로겐 수용체 전사활성 작용물질시험(agonist assay)을 수행하기 위하여 10% DCC-FBS-EMEM 배지에 희석한 hERα-Hela-9903 세포 현탁액을 1 × 104 cells/well가 되도록 분주하고 3시간 동안 배양하였다. 시험물질을 각각의 해당하는 well에 농도별로 처리한 후 37oC, 5% CO2 배양기에서 24시간 배양하였다. 루시퍼라제 분석은 Steady-Glo® Luciferase assay system (Promega, USA)을 사용하여, 제조사에서 제공하는 프로토콜에 따라 수행하였다. Luciferase 발광값은 발광도 측정이 가능한 마이크로플레이트리더기(Thermo Fisher Scientific, Varioskan Lux)을 사용하여 측정하였다. Luciferase 측정값은 양성대조물질(1 nM 17β-estradiol)의 발광 측정값의 평균값을 100%로 설정하여 아래의 식으로 각 시험물질의 상대 전사 활성화 배율(Relative transcriptional activity, RTA)를 계산하였다.
다음으로 에스트로겐 수용체 전사활성 길항물질시험(antagonist assay)을 수행하였다. 본 시험에서는 세포독성 측정을 위한 clear 96 well plate와 luciferase 활성 측정을 위한 white 96 well plate를 각각 준비하였다. hERα-Hela-9903 세포를 1 × 104 cells/well로 분주한 후 3시간 동안 배양하였다. 시험물질을 각각의 해당하는 well에 농도별로 처리한 후 37oC, 5% CO2 배양기에서 24시간 배양하였다. 세포독성시험은 Cell Counting Kit-8 (CCK-8) assay kit (Dojindo, Japan)를 이용하여 측정하였다. Microplate spectrometer (Thermo, USA)를 사용하여 450 nm에서 흡광도를 측정하였다. 세포생존율을 계산하는 수식은 아래와 같다.
Luciferase 활성 측정은 에스트로겐 수용체 전사활성 작용시험(agonist assay)과 동일하게 Steady-Glo® Luciferase assay system (Promega, USA)을 사용하였으며 luciferase 활성 값을 계산하는 수식은 아래와 같다.
안드로겐 수용체 전사활성시험법(Androgen Receptor Transactivation Assay, ARTA)
안드로겐 수용체 전사활성 작용물질시험(agonist assay)을 위해 분석 배지로 22Rv1/MMTV_GR-KO 세포현탁액을 각 well당 3×104 cells/100 μL가 되도록 분주하고 37oC, 5% CO2 배양기에서 48시간 동안 배양하였다. 시험물질을 각각의 해당하는 well에 농도별로 처리한 후 37oC, 5% CO2 조건에서 24시간 배양하였다. 루시퍼라제 활성 측정을 위하여 Steady-Glo¢ç Luciferase assay system (Promega, USA)을 사용하였으며, luminometer (Thermo, USA)로 발광값을 측정하였다. 루시퍼라제 활성 측정값은 양성대조물질(10 nM 5α-dihydroxytestosterone, DHT)에 대한 백분율로 환산하여 아래의 식으로 시험물질의 상대 전사 활성화 배율(RTA)를 계산하였다.
다음으로 항안드로겐 수용체 전사활성 길항물질시험(antagonist assay)을 수행하였다. 본 시험에서는 세포독성 측정을 위한 clear 96 well plate와 luciferase 활성 측정을 위한 white 96 well plate를 각각 준비하였다. 22Rv1/MMTV_GR-KO 세포를 3x104 cells/well로 분주한 후 37oC, 5% CO2 조건에서 48시간 동안 배양하였다. 시험물질을 각각의 해당하는 well에 농도별로 처리하고 37oC, 5% CO2 조건에서 24시간 배양한 후, 세포독성 측정을 위하여 CellTiter-FluorTM Cell viability assay (Promega, USA)를 사용하였다. 제조사에서 제공하는 프로토콜에 따라 수행한 후, fluorometer(380-400 nMEX/505 nmEM)을 사용하여 형광도를 측정하였다. 측정된 형광값을 아래 수식에 대입하여 세포생존율을 구하였다.
Luciferase 활성은 Steady-Glo® Luciferase assay system(Promega, USA)을 사용하였으며, 활성 값은 아래와 같이 계산하였다.
판정기준
각 시험법에 따라 아래의 인정 요건을 충족해야 하며, 충족되지 못하면 재시험을 수행해야 한다. 에스트로겐 수용체 전사활성시험의 경우 양성대조군(1 nM 및 25 pM 17β-estradiol)의 luciferase 활성 평균값이 용매대조군의 luciferase 활성 평균값 보다 4배 이상이어야 하며, 안드로겐 수용체 전사활성시험의 경우 양성대조물질(10 nM 및 800 pM DHT)의 luciferase 활성 평균값이 용매대조군의 luciferase 활성 평균값 보다 작용물질시험(agonist assay)에서는 13배 이상, 길항물질시험(antagonist assay)에서는 10배 이상이어야한다. 상기 인정 요건을 충족하면서 2회의 반복실험 중 2회 모두 또는 3회의 반복실험 중 2회의 결과가 아래와 같으면 양성으로 판정한다. 에스트로겐 및 안드로겐 수용체 전사활성시험(agonist assay) 결과가 시험물질의 luciferase 활성이 양성대조군(1 nM 17β-estradiol 및 10 nM DHT) 보다 10% 이상이면 양성으로 판정한다. 항에스트로겐 및 항안드로겐 수용체 전사활성시험(antagonist assay)의 경우 시험물질이 양성대조군(25 pM 17β-estradiol 및 800 pM DHT) 보다 luciferase 활성이 20% (항에스트로겐 시험) ~ 30% (항안드로겐 시험) 낮게 나타나거나, 세포 생존율이 80% 이상인 경우 또는 IC30값을 산출할 수 있을 때 양성으로 판정한다.
결과 및 고찰
세포안정성시험
숙련도시험을 수행하기 전, 실험에 사용한 hERα-Hela-9903 및 22Rv1/MMTV_GR-KO 세포주의 호르몬 작용반응 및 길항반응을 안정적으로 유지하는지 확인하기 위하여 세포의 안전성시험을 2반복으로 수행하였다.
hERα-Hela-9903 세포안정성을 확인하기 위하여 17β-estradiol, 17α-estradiol, corticosterone, 17α-methyltestosterone (agonist assay), tamoxifen, flutamide (antagonist assay)를 처리하여 세포생존율 및 루시퍼라제 활성값을 나타내었다(Fig. 1). 그 결과, 작용물질시험에서 17β-estradiol, 17α-estradiol, 17α-methyltestosterone을 처리하였을 때 17β-estradiol 대비 상대전사활성화배율(RTA) 값이 10% 이상이므로 양성임을 확인하였다. 반면 corticosterone의 경우 RTA 값이 10% 미만으로 음성임을 확인하였다. 길항물질시험에서는 tamoxifen을 처리하였을 때 루시퍼라제 활성을 30% 이상 억제하면서 세포생존율이 80% 이상이었으므로 양성임을 확인하였다. 반면 flutamide를 처리하였을 때는 양성판정기준에 미치지 못하여 음성으로 판정하였다.
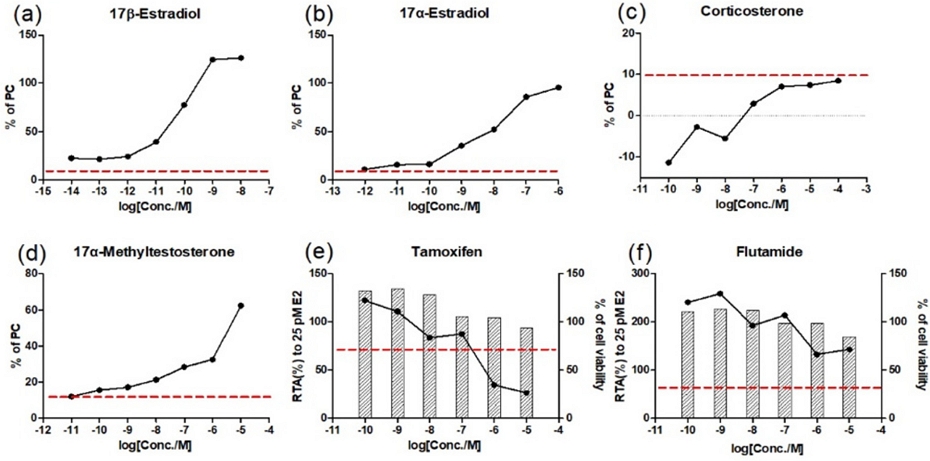
Results of the reference standards using STTA assay to determine acceptable range values: (a), (b), (c) and (d) agonist activity of STTA assay; (e) and (f) antagonist activity of STTA assay.
22Rv1/MMTV_GR-KO 세포안정성을 확인하기 위하여 5α-dihydrotestosterone, mestanolone, diethylhexyl phthalate (agonist assay), bicalutamide, bisphenol A, diethylhexyl phthalate (antagonist assay)을 처리하여 세포생존율 및 루시퍼라제 활성값을 나타내었다(Fig. 2). 그 결과, 작용물질시험에서 5α-dihydrotestosterone 및 mestanolone를 처리하였을 때 10 nM DHT 대비 RTA 값이 10% 이상이므로 양성, diethylhexyl phthalate을 처리하였을 때 RTA 값이 10% 미만이므로 음성으로 판정하였다. 길항물질시험에서는 bicalutamide 및 bisphenol A 을 처리하였을 때 루시퍼라제 활성을 30% 이상 억제하면서 세포생존율이 80% 이상이었으므로 양성임을 확인하였다. 반면 diethylhexyl phthalate를 처리하였을 때는 양성판정기준에 미치지 못하여 음성으로 판정하였다. 결과적으로, 모든 세포안정성시험에서 각 OECD 테스트가이드라인에서 물질별로 제시하는 측정값이 기준 범위 내에 포함되어 있고, 예상되는 결과반응을 정확히 판정하는 것으로 확인하였으므로, hERα-Hela-9903 및 22Rv1/MMTV_GR-KO의 세포안정성이 확보되었음을 확인하였다(Table 2-3).
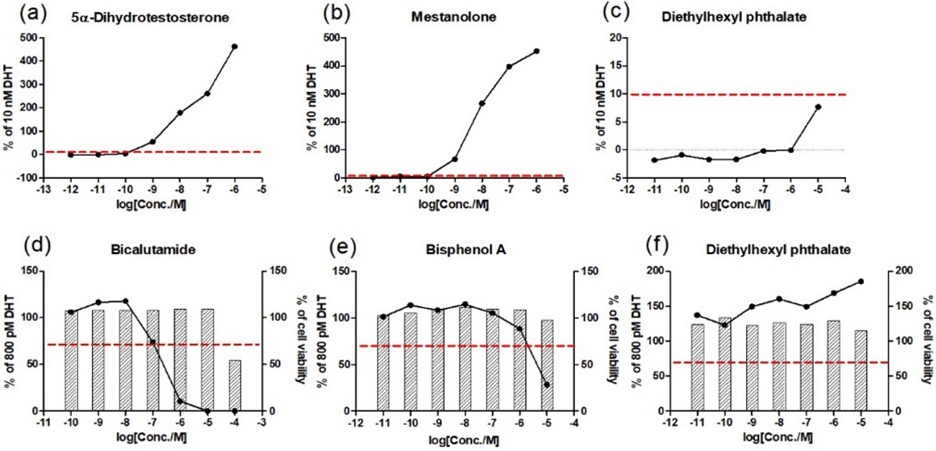
Results of the reference standards using ARTA method to determine acceptable range values: (a), (b), and (c) agonist activity of ARTA method; (d), (e) and (f) antagonist activity of ARTA method.
에스트로겐 매개 반응 확인 시험
에스트로겐 수용체 전사활성 작용물질시험(agonist assay) 및 길항물질시험(antagonist assay)를 수행하기 위하여 시험당 숙련도물질 10종을 시험하였다(Table 1). 각 시험은 양성대조군(1 nM 및 25 pM 17β-estradiol)의 luciferase 활성 평균값이 용매대조군의 luciferase 활성 평균값 보다 4배 이상 발현되어 시험의 유효성 기준을 충족하였다. 작용물질시험에서는 Atrazine 및 Reserpine을 처리한 군에서는 17β-estradiol 대비 루시퍼라제 전사활성값이 10% 미만으로 음성물질로 판단하였으며, 나머지 8종의 물질에서 RTA 값이 10% 이상이므로 양성물질로 판단했다. 길항물질시험에서는 4-Hydroxytamoxifen, Raloxifene HCl 및 Tamoxifen을 처리한 군에서 양성대조군 대비 루시퍼라제 활성을 30% 이상 억제하면서 세포생존율이 80% 이상으로 측정되어 양성물질로 판단하였다. 그러나 나머지 7종의 물질에서는 양성판단기준에 도달하지 못하여 음성물질로 판단했다(Fig. 3).
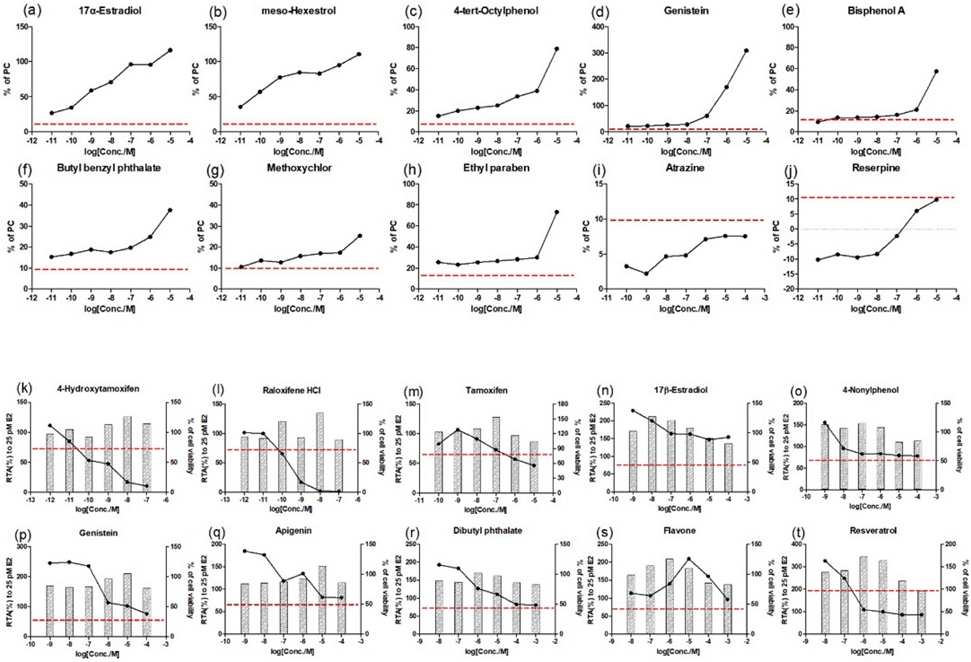
Results of the proficiency using STTA assay to determine acceptable range values: (a) to (j) agonist activity of STTA assay; (k) to (t) antagonist activity of STTA assay.
종합한 결과, 시험 물질 20종에 대하여 에스트로겐 수용체 전사활성시험 결과, OECD 테스트가이드라인(TG455)에서 제시하는 PC10, PC50 및 IC50값이 기준 범위 내로 측정되었고, 결과 판정도 동일하게 분석되었다(Table 4).
안드로겐 매개 반응 확인 시험
안드로겐 수용체 전사활성 작용물질시험(agonist assay) 및 길항물질시험(antagonist assay)를 수행하기 위하여 시험당 숙련도물질 8종 및 9종을 시험하였다(Table 1). 각 시험은 양성대조군(10 nM 및 800 pM DHT)의 luciferase 활성 평균값이 용매대조군의 luciferase 활성 평균값 보다 작용물질시험(agonist assay)에서는 13배 이상 발현되었으며, 길항물질시험(antagonist assay)에서는 10배 이상 발현되어 시험의 유효성 기준을 충족하였다. 작용물질시험에서는 Butyl benzyl phthalate, Di(2-ethylhexyl)phthalate 및 Bisphenol A를 처리한 군에서 DHT 대비 루시퍼라제 전사활성값이 10% 미만으로 음성물질로 판단하였으며, 나머지 5종의 물질에서 RTA 값이 10% 이상이므로 양성으로 판단했다. 길항물질시험에서는 5종의 물질(Hydroxyflutamide, Bisphenol A, Flutamide, Prochloraz 및 Vinclozolin)에서 양성대조군 대비 루시퍼라제 활성을 30% 이상 억제하면서 세포생존율이 80% 이상으로 측정되어 양성물질로 판단하였다. 그러나 나머지 4종의 물질에서는 양성판단기준에 도달하지 못하여 음성물질로 판단했다(Fig. 4).
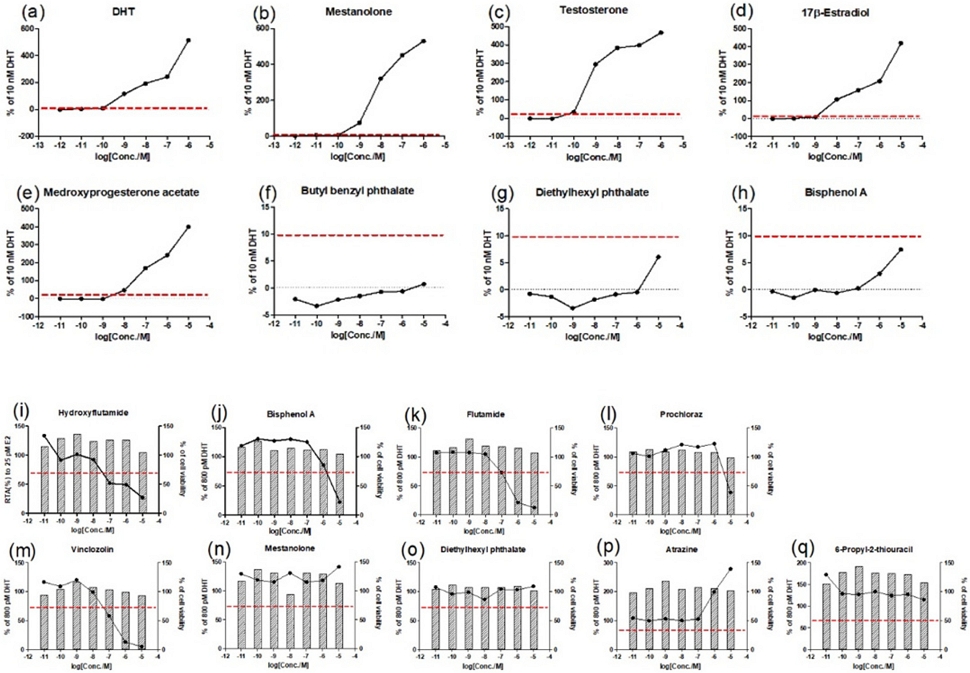
Results of the proficiency using ARTA method to determine acceptable range values: (a) to (h) agonist activity of ARTA method; (i) to (q) antagonist activity of ARTA method.
종합한 결과, 시험물질 17종에 대하여 안드로겐 수용체 전사활성시험 결과, OECD 테스트가이드라인(TG458)에 기술된 logPC10, logPC50 및 logIC50값이 기준 범위 내로 측정되었고, 결과 판정도 동일하게 분석되었다(Table 5).
에스트로겐, 안드로겐과 같은 스테로이드호르몬에 영향을 주는 내분비장애물질은 아만성(subchronic) 이상의 반복독성시험이나 번식독성시험에서 심각한 독성증상을 일으킬 수 있다(Hall et al., 2021). 이러한 증상의 예로, 생식 주기(Estrous cycle)의 변화, 생식기 조직병리학적 변화(위축, 과형성), 새끼의 생식기 이상(Genital abnormalities), 성성숙(질개구시간 및 포피분리) 지연, 정자 파라미터(정자 수, 운동성 등) 및 생식능의 변화 등과 같다(Amir S et al., 2021; Astapova et al., 2019; Sultan et al., 2002; Wang et al., 2009). 이러한 점들을 고려하였을 때, 등록 농약을 평가할 때 내분비계장애물질인지 여부를 판별하는 것은 매우 중요하다.
OECD 내분비시험법 자문그룹인 EDTA (Endocrine disrupters testing assessment)에서는 4가지 분류 1) 에스트로겐 매개반응 2) 안드로겐 매개반응 3) 갑상선호르몬 매개반응 4) 스테로이드합성과정에 영향을 주지 않을 경우 내분비계 장애물질이 아닌 것으로 판단한다. 본 연구에서 다루지 않은 H295R 스테로이드 합성시험법, 랫드의 자궁비대반응시험, 갑상선 수용체 결합시험 등 다양한 내분비영향을 추가적으로 확인한다면 보다 정확한 내분비독성 평가가 가능할 것으로 판단된다.
본 연구에서는 OECD TG 455 및 458에 제시하는 에스트로겐 및 안드로겐 매개반응을 확인하는 시험법을 성공적으로 구축하였다. 향후 본 연구에서 확립한 시험법을 활용하여 에스트로겐 및 안드로겐성을 갖는 농약의 독성 영향을 확인하는데 많은 도움이 될 것으로 판단되며, 보다 안전한 농약을 관리하는데 활용될 수 있을 것으로 사료된다.
Acknowledgments
본 연구는 농촌진흥청 국립농업과학원 농업과학기술 연구개발사업 “내분비계장애(EDs) 의심농약의 신규 독성평가 기법 및 평가기준 확립(과제번호: PJ01683501)” 의 지원에 의하여 이루어 진 것입니다.
저자 이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
-
Amir S, Shah STA, Mamoulakis C, Docea Ao, Kalantzi OI, et al., 2021. Endocrine disruptors acting on estrogen and androgen pathways cause reproductive disorders through multiple mechanism: A review. Int. J. Environ. Res. Public Health. 18(4):1464.
[https://doi.org/10.3390/ijerph18041464]

-
Astapova O, Minor BMN, Hammes SR, 2019. Physiological and pathological androgen actions in the ovary. Endocrinology, 160(5):1166-1174.
[https://doi.org/10.1210/en.2019-00101]

-
Coperchini F, Awwad O, Rotondi M, Santini F, Imbriani M, et al., 2017. Thyroid disruption by perfluorooctane sulfonate (PFOS) and perfluorooctanoate (PFOA). J Endocrinol Invest, 40(2):105-121.
[https://doi.org/10.1007/s40618-016-0572-z]

-
Davison SL, Bell R. 2006 Androgen physiology. Semin Reprod Med. 24(2):71-77.
[https://doi.org/10.1055/s-2006-939565]

-
Deroo BJ, Korach KS. 2006 Estrogen receptors and human disease. J Clin Invest. Mar; 116(3):561-570
[https://doi.org/10.1172/JCI27987]

-
Diamanti-kandarakis E, Bourgugnon JP, Giudice LC, Hauser R, Prins GS, et al., 2009. Endocrine-disrupting chemicals: An endocrine society scientific statement. Endocrine Reviews, 30(4):293-342.
[https://doi.org/10.1210/er.2009-0002]

- European Chemicals Agency (ECHA), 2023, New hazard classes 2023. ECHA CLP Regulation.
-
Hall JM and Korach KS, 2021, Endocrine disrupting chemicals (EDCs) and sex steroid receptors. Adv Pharmacol. 92:191-235.
[https://doi.org/10.1016/bs.apha.2021.04.001]

- Hiller-Sturmhöfel S, Bartke A. 1998. The endocrine system: an overview. Alcohol Health Res World. 22(3):153-164
-
Hong SH, Lee SH, Yang JY, Lee JH, Jung KK, et al., 2020. Orally administrated 6:2 chlorinated polyfluorinated ether sulfonate (F-53B) causes thyroid dysfuction in rat. Toxics, 8(3):54.
[https://doi.org/10.3390/toxics8030054]

-
Hu J, Zhang Z, Shen WJ, Azhar S. 2010. Cellular cholesterol delivery, intracellular processing and utilization for biosynthesis of steroid hormones. Nutr Metab (Lond). 7(47).
[https://doi.org/10.1186/1743-7075-7-47]

-
Kabir ER, Rahman MS, Rahman I. 2015. A review on endocrine disruptors and their possible impacts on human health. Environ Toxicol Pharmacol. 40(1):241-258.
[https://doi.org/10.1016/j.etap.2015.06.009]

-
McKinlay R, Plant JA, Bell JNB, Voulvoulis, 2008. Endocrine disrupting pesticides: Implications for risk assessment. Environment International, 34(2):168-183.
[https://doi.org/10.1016/j.envint.2007.07.013]

-
Minif W, Hassine AIH, Bouaziz A, Bartegi A, Thomas O, et al., 2011. Effect of endocrine disruptor pesticides: A review. Int. J. Environ. Res. Public Health. 8(6):2265-2303.
[https://doi.org/10.3390/ijerph8062265]

-
Monneret C, 2017. What is an endocrine disruptor? C R Biol, 340(9-10):403-405.
[https://doi.org/10.1016/j.crvi.2017.07.004]

- OECD, 2005. Guidance document on the validation and international acceptance of new or updated test methods for hazard assessment. OECD Environ. 14. Health and Safety Publication Series on Testing and Assessment No. 34.
- OECD, 2010. Workshop report on OECD Countries activities regarding testing, assessment and management of endocrine disrupters.
- OECD, 2018a, Guidance document on standardized test guidelines for evaluating chemicals for endocrine disruption. OECD Environ. 22. Health and Safety Publication Series on Testing and Assessment No. 150.
- OECD, 2018b, Repeated dose 90 day oral toxicity study in rodents. OECD Guidelines for the Testing of Chemicals, Section 4. OECD Publishing, Paris.
- OECD, 2021, Test No. 455: Performance-based Test guideline for Stably Transfected Transactivation In Vitro Assays to Detect Estrogen Receptor Agonist and Antagonist. OECD Guidelines for the Testing of Chemicals, Section 4. OECD Publishing, Paris.
- OECD, 2023, Test No. 458: Stably Transfected Human Androgen Receptor Transcriptional Activation Assay for Detection of Androgenic Agonist and Antagonist Activity of Chemicals, OECD Guidelines for the Testing of Chemicals, Section 4. OECD Publishing, Paris.
-
Rubin BS, 2011. Bisphenol A: an endocrine disruptor with widespread exposure and multiple effects. J Steroid Biochem Mol Biol, 127(1-2): 27-34.
[https://doi.org/10.1016/j.jsbmb.2011.05.002]

- Rural Development Administration (RDA), 2023. Criteria for Registration of Pesticides and Active substances, Legislation and Notification Directive for pesticide regulation, Wanju, Korea.
-
Sultan C, Lumbroso S, Paris F, Jeandel C, Terouanne B, et al., 2002. Disorders of androgen action, Semin Reprod Med., 20(3):217-228.
[https://doi.org/10.1055/s-2002-35386]

-
Wang RS, Yeh S, Tzeng CR, Chang C, 2009. Androgen receptor roles in spermatogenesis and fertility: lessons from testicular cell-specific androgen receptor knockout mice. Endocr Rev., 30(2):119-132.
[https://doi.org/10.1210/er.2008-0025]

So-Hye Hong, Toxicity and Risk Assessment Division, National Institute of Agricultural Sciences, Senior Researcher, https://orcid.org/0000-0001-9958-5552, Writing-original draft preparation and Project administration.
Ji-Yeon Yang, Toxicity and Risk Assessment Division, National Institute of Agricultural Sciences, Researcher, https://orcid.org/0000-0002-7415-8746, Conducted the experiments and Data curation.
Jeong-Hyun Lim, Toxicity and Risk Assessment Division, National Institute of Agricultural Sciences, Senior Researcher, https://orcid.org/0000-0002-1166-4377, Experimental planning and Data curation.
Soo-Jin Park, Toxicity and Risk Assessment Division, National Institute of Agricultural Sciences, Senior Researcher, https://orcid.org/0000-0002-2522-3185, Data analysis and Review.
Ji-Young Shin, Toxicity and Risk Assessment Division, National Institute of Agricultural Sciences, Senior Researcher, https://orcid.org/0000-0003-3177-161X, Data analysis and Review.
Si Young Yang, Toxicity and Risk Assessment Division, National Institute of Agricultural Sciences, Senior Researcher, https://orcid.org/0009-0000-7308-969X, Visualization.
Geun-Hwan Gil, Toxicity and Risk Assessment Division, National Institute of Agricultural Sciences, Senior Manager, https://orcid.org/0000-0001-7978-8985, Conceptualization.
