
종자코팅을 이용한 Chlorella fusca CHK0059의 콩 생육촉진 및 시들음병 발병 억제
초록
종자의 품질을 향상시키기 위해 종자코팅 기술이 개발되어 오고 있지만, 현재까지 Chlorella를 이용하여 종자코팅을 진행한 사례가 없어, 본 연구에선 최초로 Chlorella fusca CHK0059를 종자코팅 방법을 이용하여 Chlorella의 농업적 가치 평가를 진행하였다. Chlorella가 코팅된 콩 종자는 무처리 대조군 종자에 비해 높은 발아율을 보였다. 무처리구와 대조군(1% CMC) 그리고 CHK0059가 코팅된 종자들을 3주간 유리온실에서 생육한 결과, CHK0059를 코팅한 처리구들이 무처리구에 비해 줄기 길이가 길어진 것을 확인하였다. 본 연구에서는 이전에 검증되지 않았던 CHK0059 종자코팅 기술을 콩에 적용하여 결과를 조사하였다. 또한, CHK0059가 코팅된 처리구와 무처리구에 콩 시들음병원균을 처리하였을 때, 무처리구에 비해 낮은 병 발병도를 나타내었다. Sterilized Chlorella (사멸된 CHK0059107 cell/mL + Fusarium) 에서는 대체로 살아있는 Chlorella를 코팅한 처리구(Chlorella 106+ F, Chlorella 107 +F, Chlorella 108+F)와 비슷한 경향들을 보였다. 결과적으로, Chlorella의 종자코팅 처리에 의해 시들음병에 대한 병 발병을 억제하는 것으로 조사되었다. Chlorella의 종자코팅 실용화를 위하여서는 보다 체계적이고 작물 전주기를 대상으로 하는 추가적인 실험이 필요하다. 그러나, Chlorella 종자코팅 기술을 적용하면 종자에 긍정적인 영향을 미친다는 결과를 통해 Chlorella의 활용 범위 확대 방안으로 종자코팅 방법이 효과가 있다는 것을 본 연구를 통해 검증하였다.
Abstract
Seed coating technologies have been developed for improvement of seed quality. However, no cases of seed coating using Chlorella have been reported. In this study, we conducted the first-ever evaluation of the Chlorella-based seed coating method for enhancement of the agricultural value of Chlorella. Chlorellacoated soybean seeds showed a higher rate of germination compared with untreated control seeds. After three weeks of growth, seedlings coated with CHK0059 showed longer stem lengths compared with the control group. In addition, soybean seeds coated with CHK0059 that were treated with Fusarium wilt pathogens showed a lower incidence of disease compared with the untreated control group. In general, Sterilized Chlorella (CHK0059 107 cell/mL + Fusarium) showed trends that were similar to those of treatment groups coated with viable Chlorella (Chlorella 106 + F, Chlorella 107 + F, Chlorella 108 + F). Thus, treatment of seed coating with Chlorella resulted in suppression of disease incidence caused by Fusarium wilt pathogens. For practical application of Chlorella seed coating, conduct of more systematic and comprehensive studies examining the entire crop lifecycle will be required. However, due to its positive impact on seeds and plant growth, the findings of this study confirm the effectiveness of using seed coating with Chlorella as a potential method for expanding the utilization of Chlorella.
Keywords:
Chlorella, Plant growth promoting activity, Seed coating, Soybean, Fusarium wilt키워드:
클로렐라, 식물생장촉진, 종자코팅, 시들음병서 론
미세조류는 미세한 크기의 타원형 모양의 단세포를 가지는 녹조류로 다양한 연구들을 통해 친환경 식물 성장 촉진제로 주목받고 있다(Mulbry et al., 2007; Dineshkumar et al., 2017; Dineshkumar et al., 2020). 특히, 미세조류에 속하는 Chlorella는 녹조식물문의 미세조류로 단백질이 풍부하고 광합성 효율이 우수하여 미래 식량 자원으로 각광을 받고 있다(Ren et al., 2020). 또한, 폐수를 정화할 수 있는 정수 능력과 식물 성장 촉진 효과, 식물 병을 억제할 수 있는 효과를 보이는 것으로 알려져 친환경 비료나 식물 성장촉진제 등으로 사용하기 위한 다양한 연구가 진행되고 있다(Bhuyar et al., 2019; Kim et al., 2018; Yao et al., 2020).
Chlorella가 가지는 다양한 효과들이 입증되면서 최근 국내의 많은 농가에서 농촌진흥청으로부터 Chlorella를 제공 받아 농작물에 친환경 제제로 사용하고 있다. 국내에선 Chlorella를 시비하는 방법은 작물에 액상의 Chlorella를 주기적으로 엽면 또는 관주 처리하는 방법으로 사용된다(Kim et al., 2022). 다양한 Chlorella의 종류에서 농가 활용 기술개발을 위해 사용한 미세조류는 Chlorella fusca CHK0059이다. C. fusca CHK0059는 국내의 유기농 논에서 분리된 Chlorella 종 중 하나로 최근 연구를 통해 부추와 시금치의 성장과 품질에 긍정적인 영향을 미치는 것으로 확인되었으며, 다양한 작물에서 발생하는 탄저병(Colletotrichum spp.)에 대해 식물의 유도 저항성을 촉진하는 것으로 알려지면서 관심을 받고 있다(Kim et al., 2018). 또한 C. fusca CHK0059(107 cfu/mL)를 0.4% 농도로 딸기에 처리하였을 때 Fusarium oxysporum f.sp. fragariae에 의해 발생하는 딸기 시들음병의 발병도를 억제하는 것으로 알려져 있다(Kim et al., 2020).
그러나, Chlorella는 생산 단가가 높은 편으로, 식량 자원으로 이용하기 위한 가능성은 많은 연구들을 통해 입증되어지고 있지만(León-Vaz et al., 2019; Rani et al., 2018), 친환경 농업을 위한 상업적 보급이 어려운 상황이다. 이러한 상황에도 불구하고, Chlorella를 이용하여 얻을 수 있는 다양한 효과들과 친환경농업 농산물의 요구도가 증가하고 있는 실정으로, Chlorella를 이용한 농작물 재배 기술 개발 연구가 증가하고 있다. 현재까지 개발된 Chlorella 처리 방법은 식물체가 일정수준 생장한 후에 액상형태로 Chlorella를 처리하는 방법으로 Chlorella 시비 효과를 제한적으로 기대할 수 있다. 농작물의 초기 생장 단계에서 최적의 효과를 얻을 수 없을 가능성이 높기에 Chlorella의 효과 활용 범위를 넓히기 위한 다양한 처리 방법이 필요한 상황이다.
종자코팅(Seed coating) 기술은 식물의 종자에 식물병을 억제할 수 있는 화학농약제 또는 식물의 성장을 촉진할 수 있는 Plant growth-promoting bacteria(PGPB)와 같은 유용미생물들을 종자 표면에 코팅하여 생물막을 형성시켜 각 자원들이 가지는 효과를 종자에 적용하는 방법이다(Accinelli et al., 2018a; Accineli et al., 2018b; Javed and Afzal, 2020; Jetiyanon et al., 2008; Oliveira et al., 2016; Rouphael et al., 2017; Rocha et al., 2019a). 종자코팅으로 미생물을 접종하는 방법은 미생물 제제를 어린 식물에 전달하기 위해 가장 정확하고 효율적인 방법으로 고려되어 왔다(Ehsanfar and Modarres-Sanavy, 2005). 종자 파종 후에 종자는 다양한 환경 조건(생물적 및 비생물적 스트레스)에 노출되게 되는데, 코팅 방법을 통해 이러한 스트레스의 유해한 영향을 개선할 수 있다고 알려져 있다(Chandrika et al., 2017). 작물 중 종자코팅의 성공적인 예시로 해바라기 종자의 발아에 부정적인 영향을 미치는 토양잔류 제초제의 작용을 억제한 결과가 있다(Szemruch and Ferrari, 2013). 또한 토마토 종자의 발아와 생육 강화, 저장성을 개선하는데 성공하였으며 미량 영양소와 식물 추출물을 조합한 seed pelleting으로 작물의 성장 및 수확량이 개선된 사전 연구가 있다(Masuthi et al., 2009). 이러한 종자코팅 기술들을 이용하여 식물의 성장에 중요한 역할을 하는 종자의 품질을 향상할 수 있어 연구가 다양하게 진행되고 있다.
콩은 (Glycine max) 단백질과 지질이 풍부하여 건강식품으로 주목받고 있다(Kim, 2021). 콩은 영양적으로 우수할 뿐 아니라, 이소플라본을 포함한 다양한 기능성 성분과 같은 인간에게 이로운 성분을 포함하는 것으로 알려지면서 기능성 식품으로 더 많은 관심을 받고 있다(Kim, 2021). 콩을 식품으로도 사용이 가능하지만 사료, 생물연료 등과 같은 다양한 용도로도 사용이 가능하기 때문에 콩은 우수한 경제작물로 알려져 있다. 현재 전세계적으로 재배가 되고 있는 콩을 생물적·비생물적 스트레스로부터 보호하기 위해 많은 양의 화학물질을 사용하고 있다. 그러나 전 세계 인구의 급증으로 인한 식량 수요 증가를 충족시키기 위해 중요한 것은 환경 품질을 유지하면서 농작물을 병해충으로부터 보호하는 것으로 화학물질을 사용하는 경우 환경오염 문제와 인축 독성 등과 같은 문제가 발생하게 되어 현재 생물학적으로 콩을 보호하고 생산량을 늘리기 위한 연구들이 진행되고 있다(Kim, 2021).
이에 본 연구에선 식물 생장 촉진 효과와 식물병 억제와 같은 식물에 긍정적으로 영향을 미치는 것으로 알려진 C. fusca CHK0059를 종자코팅 적용 가능성을 검증하고자 수행되었다. Chlorella의 종자코팅을 통해 콩 생산에 가장 중요한 환경요인인 건조와 생물적요인인 콩 시들음병 억제 능력을 검증하였다. 본 연구를 통해 Chlorella를 이용하여 종자에 적용 범위를 넓히고 지속적으로 수요가 증가하고 있는 경제 작물인 콩 생산을 위한 효과적인 Chlorella처리 방법을 연구하고자 한다.
재료 및 방법
Chlorella fusca CHK0059의 농도 검정 및 종자코팅 용액 제조
종자코팅 기술을 통한 Chlorella의 효과를 확인하기 위해 실험에 사용한 C. fusca CHK0059는 F&B Nature 회사로부터(F&B Nature Co. Ltd., Korea) C. fusca CHK0059 배양액을 제공받아 실험에 이용하였다. C. fusca CHK0059 처리를 위해서 hemocytometer (Neubauer’s improved hemocytometer)를 이용하여 200x 배율 현미경(Olympus BX53F2, Tokyo, Japan)에서 세포수를 측정하여 농도별로 조정하였다.
콩 종자에 CHK0059를 코팅하기 위해 배양액을 8,500 rpm에서 20분간 원심 분리하여 상등액을 제거하고 멸균수(ddH2O)로 두 번 세척한 후 세포를 회수하였다. 콩 종자 표면에 CHK0059를 부착하기 위해 접착제 역할로 1% CMC(carboxymethyl cellulose)를 이용하여 종자코팅 용액을 제작하였다. 종자코팅 용액은 CHK0059 농도별로 107 cfu/mL을 기준(Kim et al., 2018)으로 106 cell/mL, 107 cell/mL, 108 cell/mL 농도로 나누어 배양된 클로렐라를 희석하여 종자코팅 용액을 제작하였다. 또한, 사멸된 Chlorella의 식물 생장효과를 비교하기 위하여 CHK0059 107 cfu/mL을 120°C에서 20분간 멸균기를 통해 사멸시킨 후, 종자코팅 용액을 제작하였다.
콩 종자에 CHK0059 코팅 및 생육 조사
콩(Glycine max cv. Daewon) 종자에 Chlorella를 코팅하기전, 종자 표면에 미생물을 제거하고자 종자 표면소독을 진행하였다. 콩을 1% NaOCl에 10분간 침지 후 2분마다 NaOCl이 콩에 고루 퍼질 수 있도록 흔들어 주었다. 10분 후 콩 표면에 묻은 NaOCl을 제거하기 위해 멸균수(ddH2O)를 이용하여 5회 세척을 진행하였다. 표면 살균된 콩 종자 표면의 물기를 제거하고자 무균대에서 2시간 동안 상온 건조하였다.
표면 살균된 콩 종자를 50mL 살균 튜브에 넣고, 콩 종자 1 g 당 CHK0059 코팅 용액 10 μL를 처리하였다(w/v). 종자표면의 점성이 완전히 사라질 때까지 회전기에서 교반 후, 무균대에서 2시간 상온 건조를 진행하였다. CHK0059는 각 농도 별로 106 cell/mL, 107 cell/mL, 108 cell/mL로 처리하였고 대조군으로서 무처리구 (Untreated), 1% CMC 그리고 사멸된 CHK0059 (Sterilized Chlorella)로 총 6가지 조건으로 실험을 진행하였다. 콩을 발아시키기 위해 멸균한 솜을 9cm petri dish에 넣고 멸균수(ddH2O) 15 mL씩 분주하여 수분을 제공해 주었고 암 조건으로 온도 27oC, 습도 60%의 식물 생육장에서 3일간 발아를 진행시켰다 (n = 10). 콩 종자의 배축이 1~2 cm 이상 자라나오면 발아가 된 것으로 판단하여 발아율을 측정하였다(Baributsa and Baoua, 2022). 발아된 콩을 상토(부농 2호, 부농상토)를 이용하여 9cm pot에 심고 30oC 온실에서 3주차까지 생육을 진행하였다(Light: 16 h, Dark: 8 h; Humidity: 60%). 총 6개의 다른 처리구 간의 생육 차이를 비교하기 위하여 처리구별 3 반복으로 잎의 개수, 줄기의 길이, 줄기의 무게, 뿌리의 무게, 그리고 총 엽록소 함량을 측정하여 CHK0059 종자코팅에 따른 생육 차이를 측정하였다(n = 10).
콩 시들음병(Soybean Fusarium wilt) 병원균 배양
딸기에서 Chlorella fusca CHK0059가 Fusarium oxysporum에 의해 발생하는 시들음병을 억제하는 것으로 보고되어 있다(Kim et al., 2020). 이에 CHK0059를 콩 종자에 처리하였을 때 시들음병의 발병을 억제하는지 확인하고자 본 연구에서는 사전에 직접 생육한 콩의 시들음병 병징 부분에서 분리된 Fusarium sp. 병원균을 실험에 사용하였다(Data not shown). Fusarium sp. 균을 1/5 PDA(Potato dextrose, 4.8 g; Agar, 20 g per L) 배지에 28oC에서 7일간 배양하였다. 배양된 Fusarium sp. 2 plate씩 1/5 PDB broth 500 mL 배지에 화염 멸균시킨 메스를 이용하여 잘라 넣어 28oC, 150 rpm 조건의 진탕배양기에 3일간 배양하였다. 액체 배지에서 포자를 형성시킨 Fusarium sp. 균을 원심분리 (5,000 × g, 10 min)를 통해 상등액을 제거하고 멸균수를 이용하여 최종 농도 1.4 × 105 conidia/mL로 제작하였다.
CHK0059의 종자 처리에 따른 콩 건조 스트레스 저감 및 시들음병에 대한 평가
콩의 건조 스트레스 저감 여부를 확인하고자 무처리구(Untreated), 1% CMC 처리구, 사멸된 CHK0059 그리고 CHK0059 농도별 처리구(106, 107, 108 cell/mL)나누어 실험을 진행하였으며 각 처리구 당 식물체는 10개체로 진행하였다. 건조 스트레스 처리는 수분공급을 4일간 중단하는 방식으로 처리하였다. 4일 경과 후 식물체에서 건조 스트레스 반응을 확인하고 각 처리구에서 무작위로 3개체씩을 1반복으로 하여 총 3반복으로 지상부의 건물중을 측정하였다.
시들음병원균(Fusarium sp.)을 콩 식물체에 접종하기 위해 생육한 콩의 뿌리 부분을 멸균시킨 5mL tip으로 상처를 낸 후 포자 용액(1.4 × 105 conidia/mL)을 10mL씩 분주하였다. 무처리구(Untreated), 병원균 처리구(F), 1% CMC + 병원균 처리구(1% CMC + F), 사멸된 CHK0059+ 병원균 처리구 (Sterilized Chlorella + F), CHK0059 106 cell/mL + 병원균 처리구(106+ F), CHK0059 107 cell/mL + 병원균 처리구(107+ F), CHK0059 108 cell/mL +병원균 처리구(108+ F)를 3주간 생육하였다(n = 10). 병원균을 접종하고 30oC 온실 (Light: 16 h, Dark: 8 h; Humidity: 60%)에서 일주일 간격으로 각 처리구의 발병도를 조사하였다. 각 처리구의 발병도는 실험 식물을 3개의 그룹으로 나누어 disease index(DI)를 측정하였다. 콩 시들음병에 대해서는 뿌리의 잔뿌리 유무와 뿌리 괴사 정도에 따라 Index를 0 ~ 4로 측정하였다(0: No Root rot; 1: Mild symptoms (Discoloration but no visible lesions) 2: Obvious lesions; 3: Severe lesions on the stem; 4: Plant death) (Chang et al., 2013).
통계분석처리
C. fusca CHK0059를 콩 종자에 코팅하여 발아율 관찰과 3주간 온실에서 생육한 후의 각 처리구 간의 생육 차이, 건조스트레스 처리 후 건물중 무게, 콩 시들음병 발병도는 비모수 검정법인 Kruskal-Wallis Rank Sum Test (Kruskal et al., 1952)를 통해 처리구 간의 유의미성을 분석하였고, pvalue값 0.05 미만으로 유의미성을 나타내는 결과 값을 대상으로 사후분석으로 Conover Test (Conover et al., 2018)를 수행하여 그룹별 유의성을 나타내었다.
결과 및 고찰
Chlorella fusca CHK0059 종자코팅 후 콩 발아율 증진
콩 종자에 C. fusca CHK0059를 코팅하여 발아율에 대한 평가를 실시하기 위하여 무처리, 1% CMC, Sterilized Chlorella(사멸된 CHK0059), CHK0059를 각각 106, 107, 108 cell/mL 코팅하여 28oC에서 3일간 식물생육상에서 종자 발아율을 조사하였다. 무처리에서 56.7%, 1% CMC에서 73.3%, CHK0059를 사멸시켜 처리한 Sterilized Chlorella에서 73.3%, Chlorella 106 cell/mL에서 80%, 107 cell/mL에서 86.7%, 108 cell/mL에서 9 3.3%로 확인되었다. Chlorella 108 cell/mL 처리구에서 가장 높은 발아율이 확인되었고, 대조구(Untreated, 1% CMC, Sterilized Chlorella)에 비해 CHK0059 처리구에서 높은 콩 종자의 발아율이 확인되었다(Fig. 1). 일반적으로 사용되어지고 있는 종자코팅 방법은 주로 종자의 외형과 상태를 변화시켜 발아율을 향상시키고 생장을 촉진하는 것을 목적으로 한다(Halmer, 2008; Pedrini et al., 2017). 본 연구에서는 CHK0059를 콩 종자코팅을 진행하였으며, 이로 인해 무처리구에 비해 CHK0059, 사멸된 클로렐라, 1% CMC 처리구에서 더 높은 발아율이 관찰되었다. 이 결과를 통해 C. fusca CHK0059가 콩 종자의 발아를 촉진시키는데 효과적인 미생물로서 역할을 하는 것이 확인되었다. 따라서 C. fusca CHK0059를 작물의 종자코팅에 적용할 수 있는 유용 미생물로 사용이 가능하다고 사료된다.
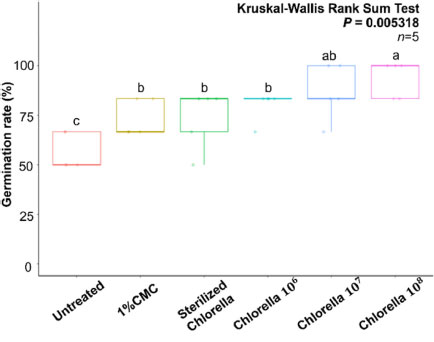
Germination rates of CHK0059 coated soybean seeds. Chlorella fusca CHK0059 was treated on soybean seeds surface with 1% CMC. The concentration of CHK0059 was 106 ~ 108 cell/mL. C. fusca CHK0059 spore stock 10 μL was treated with 1 g sterilized soybean seeds (w/v). After coating CHK0059 to soybean seeds, the seeds were air dried on a clean bench for 2 h. Chlorella-coated soybeans were germinated in sterilized cotton on a petri dish with ddH2O at 27oC the growth chamber (n = 30, Thirty soybean seeds were divided into 5 groups, and the germination rate was calculated for each group). (Light: 16 h, Dark: 8 h; Humidity: 60%) The germination rates were analyzed by the Kruskal-Wallis Rank Sum test followed by the Conover test (P = 0.05) indicated with the R program (version 4.0.3).
C. fusca CHK0059 종자코팅 식물체 생육 촉진 향상
CHK0059를 코팅처리(무처리, 1% CMC, Sterilized Chlorella, Chlorella 106, 107, 108 cell/mL)한 콩 종자를 식물생육상에서 발아시킨 후 CHK0059 처리에 의한 생육 변화를 관찰하기 위해 유리온실에서 콩을 3주간 생육하였다. 각 처리구들의 잎의 개수, 줄기의 길이, 무게, 뿌리의 무게 및 엽록소 함량을 조사하였다(Table 1). 잎의 개수, 줄기의 무게, 뿌리의 무게 및 총 chlorophyll 함량에는 CHK0059(106, 107, 108 cell/mL)가 코팅된 처리구에서 무처리구(무처리, 1% CMC, Sterilized Chlorella)에 비해 통계적으로 유의미한 차이는 보이지 않는 것을 조사되었다(Fig. 2). 그러나, 줄기의 길이에서 CHK0059를 처리한 처리구가 무처리구에 비해 줄기이생육이 향상되는 것을 확인하였다(Fig. 2b). 이는 CHK0059를 딸기에 처리했을 때 줄기의 성장이 증가했던 이전 연구결과(Kim et al., 2020)와 유사하며, CHK0059가 종자코팅방법을 통해 다른 작물에 적용하였을 때도 CHK0059의 식물체 생장 촉진 효과를 나타낼 수 있다는 것을 시사한다. 그러나, CHK0059가 콩에서 보인 줄기 성장 촉진 효과가 어떤 작용에 기인하여 발생한 것인지, CHK0059를 식물체에 시비했을 때의 결과와 동일한 효과를 나타내는지 확인하기 위해선 추가적인 연구가 필요하다고 판단된다.
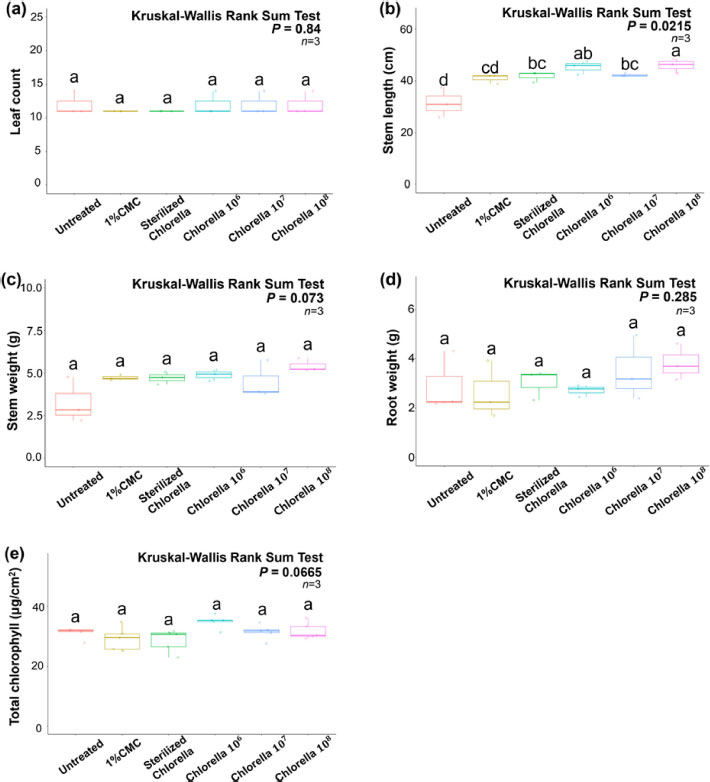
Growth rates of CHK0059 coated soybean seeds. CHK0059 coating soybean seeds grew 3 weeks at 37oC glasshouse (Light: 16 h, Dark: 8 h; Humidity: 60%) after germination. After 3 weeks, each treatment is sampled, and the growth survey is conducted (n = 10, Three soybeans were randomly selected for the growth survey). The growth of each treatment was investigated by measuring the number of leaves, stem length, stem weight, and total chlorophyll content (n = 10). (a) Leaf count, (b) Stem length (cm), (c) Stem weight (g), (d) Root weight (g), (e) Total chlorophyll (μg/cm2). The growth survey rates were analyzed by the Kruskal-Wallis Rank Sum test then the stem length rate was followed by the Conover test (P = 0.05) indicated with R program (version 4.0.3).
Chlorella 종자 처리는 콩의 내건성 증진과 무관
C. fusca CHK0059를 종자코팅한 콩의 건조스트레스 내성 효과를 평가하기 위하여 종자코팅후 발아한 콩을 3주간 유리온실에서 생육하였다. 3주간의 생육 후, 4일간 수분공급을 중단하여 건조스트레스에 콩을 노출시킨 결과, 무처리구, 1% CMC, Sterilized Chlorella, Chlorella 106, 107, 108 cell/mL 모든 처리구에서 건조스트레스에 취약한 표현형이 관찰되었다(Fig. 3). 건조스트레스에 의한 표현형으로 콩 잎이 꺾이고 잎과 줄기가 마른 현상이 관찰되었다. 무처리, 1% CMC, Sterilized Chlorella, Chlorella 106, 107, 108 cell/mL 처리구 간의 건조스트레스 내성 차이를 관찰하기 위해 건물중 무게를 측정한 결과, 무처리구는 평균 5.64 g, 1% CMC 처리구는 평균 5.83 g, Sterilized Chlorella 처리구는 5.36 g, Chlorella 106 처리구는 6.71 g, 107 처리구는 4.51 g, 108 처리구는 평균 5.41 g으로 건물중 무게가 확인되었다(Fig. 3g). 이러한 결과는, CHK0059를 콩 종자에 코팅처리 하였을 때, 콩의 줄기 성장 촉진 효과와 같은 식물의 생장에 도움을 주는 것으로 확인되었지만(Fig. 2), 건조스트레스 감소효과를 나타내지 않는 것을 확인할 수 있었다(Fig. 3). 건조스트레스는 식물의 발달과 성장에 부정적인 영향을 미쳐 작물의 생산량에 큰 영향을 미치는 환경요인으로 건조스트레스 완화를 위한 방법이 필요한 상황이다(Jangra et al., 2019; Qi et al., 2019; Zandalinas et al., 2018). 앞선 연구에서는 Chlorella vulgaris가 브로콜리에서 엽면의 수분 증산 억제 작용을 통해 건조스트레스를 완화한 것으로 확인되었다(Kusvuran, 2021). 그러나 본 연구에서는 C. fusca CHK0059를 이용하여 C. vulgaris와 유사한 건조스트레스 완화 효과를 평가하고자 하였으나, CHK0059를 종자코팅한 처리구(Chlorella 106, 107, 108 cell/mL)들에서는 건조스트레스 완화 효과는 관찰되지 않았다. 이러한 이유는 식물체와 클로렐라 종 또는 strain별로 유의미한 상관관계를 가질 수 있음을 시사하고 있다.
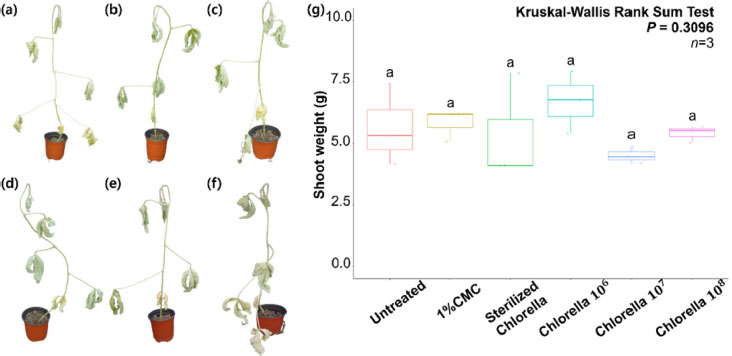
Shoot weights of CHK0059 coating treatment after drought stress. CHK0059 coating soybean grew 3 weeks at glasshouse (Light: 16 h, Dark: 8 h; Humidity: 60%). After 3 weeks, drought stress was treated to CHK0059 coating soybeans by removing water from pots for 4 days. The weights of the shoot were measured by sampling the plants of each treatment after 4 days (n = 10, Three soybeans were randomly selected for shoot weights survey). (a): Untreated, (b): 1% CMC, (c): Sterilized Chlorella (CHK0059 cell 107 cell/mL), (d): Chlorella 106 cell/mL, (e): Chlorella 107 cell/mL, (f): Chlorella 108 cell/mL, (g) the weights rate of each treatment shoot. The result was analyzed by the Kruskal-Wallis Rank Sum Test (P = 0.05) indicated by the R program (version 4.0.3).
Chlorella의 콩 종자처리에 의한 시들음병 감소
Chlorella를 종자코팅 후, 처리에 의한 콩에 시들음병 병원균(Fusarium sp.)을 처리하여 3주간 관찰을 통해 병 감소효과를 평가하였다. 시들음병에 대한 발병억제효과 평가는 잔뿌리 유무와 괴사 정도에 따라 지정한 disease scale을 기준으로 disease index(DI)를 평가하였다. 1주차에는 병징이 관찰되지 않았으나 2주차부터 병이 발병하면서 CHK0059를 종자코팅한 처리구들의 발병도가 병원균 처리구(F)와 1% CMC + F 처리구에 비해 낮은 것으로 조사되었다(Fig. 4b). 2주차와 3주차에서 가장 낮은 병 발병도를 보인 처리구는 CHK0059 107 cfu/mL 농도로 종자코팅한 Chlorella 107+ F 처리구였다. Chlorella 107+ F 처리구에서 DI값이 1 이하의 병 발병도가 관찰되었다. 무처리구에서는 DI 2 이상의 병 발병도가 관찰되어 Chlorella 107 처리구와 비교했을 때, 유의미한 차이를 확인하였다. 이를 통해, CHK0059를 코팅한 Chlorella 106+ F, Chlorella 107+ F, Chlorella 108+ F 처리구에서 무처리구에 비해 콩 시들음병의 발병이 억제된 것을 확인하였다. 이러한 결과를 통해 C. fusca CHK0059의 콩 종자에 코팅처리가 시들음병의 발병을 억제한 것을 확인할 수 있었다. 작물병 발생 억제 효과는 이전 연구에서 C. fusca CHK0059를 오이 잎에 처리하여 Colletotrichum orbiculare이 유발하는 탄저병에 대한 억제 효과, 딸기에 처리하여 Fusasrium oxysporum에 의해 발생하는 딸기 시들음병 억제 효과와 유사하게 관찰되어 CHK0059를 식물체에 시비하는 방법뿐 아니라 종자코팅 방법을 통해 CHK0059의 활용 범위를 넓힐 수 있음을 시사한다(Kim et al., 2018; Kim et al., 2020). 본 연구에서 이용한 C. fusca CHK0059뿐만 아니라 식물병 억제 효과가 입증된 다양한 Chlorellla 종 및 Chlorella 추출물 등을 종자코팅을 통해 활용할 경우, 다양한 식물병 억제 효과를 유도할 수 있을 것으로 예상된다(AI-Nazwani, et al., 2021; Mishra et al., 2022; Righini, H. et al., 2020). 또한, 본 연구에서는 CHK0059를 콩 종자에 코팅 처리하여 시들음병을 억제하기 위한 최적의 코팅농도로 높은 발아율과 낮은 병 발병도를 보인 107 cfu/mL가 적합할 것으로 판단된다(Fig. 4e).

Disease index of CHK0059 coating treatment. After CHK0059 was coated to soybeans, the soybeans were grown for 3 weeks in a glasshouse (Light: 16 h, Dark: 8 h; Humidity: 60%). Then, the treatments were treated with 10 mL Fusarium spore stock (105 cfu/mL) per plant (n = 10, Three soybeans were randomly selected for the disease index survey). The disease index was measured by disease scale (Index 0 ~ 4). The disease index was measured at 2 weeks and 3 weeks. (a) 2 weeks, (b) 3 weeks (F: Fusarium sp.). The results were analyzed with the Kruskal-Wallis Rank Sum Test followed by the Conover Test (P = 0.05) indicated with the R program (version 4.0.3).
Acknowledgments
본 연구는 농촌진흥청 공동연구사업(과제번호: RS-2021-RD009112)의 지원에 의해 수행되었습니다.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
-
Al-Nazwani MS, Aboshosha SS, El-Saedy MA, Ghareeb RY, Komeil DA, 2021. Antifungal activities of Chlorella vulgaris extract on black scurf disease, growth performance and quality of potato. Arch. Phytopathol. 54(19-20):2171-2190.
[https://doi.org/10.1080/03235408.2021.1925434]

-
Accinelli C, Abbas HK, Little NS, Kotowicz JK, Shier WT, 2018a. Biological control of aflatoxin production in corn using non-aflatoxigenic Aspergillus flavus administered as a bioplastic-based seed coating. Crop Prot. 107:87-92.
[https://doi.org/10.1016/j.cropro.2018.02.004]

-
Accinelli C, Abbas HK, Shier WT, 2018b. A bioplastic-based seed coating improves seedling growth and reduces production of coated seed dust. J. Crop Improv. 32(3):318-330.
[https://doi.org/10.1080/15427528.2018.1425792]

-
Ahmed AQ, Javed N, Khan SA, Abbas H, Kamran M, 2016. Efficacy of rhizospheric organism Rhizobium leguminosarum against Meloidogyne incognita in soybean. Pak. J. Agric. Sci. 53(2):377-381.
[https://doi.org/10.21162/PAKJAS/16.1659]

-
Baributsa D, Baoua IB, 2022. Hermetic bags maintain soybean seed quality under high relative humidity environments. J. Stored Prod. Res. 96, 101952.
[https://doi.org/10.1016/j.jspr.2022.101952]

-
Bhuyar P, Yusoff M, Rahim A, Hasabi M, Pragas Maniam G, et al., 2019. Antimicrobial study of algal enzymes extracted from microalgae by ultrasonication. Available at SSRN 3356472.
[https://doi.org/10.2139/ssrn.3356472]

-
Chang KF, Hwang SF, Conner RL, Ahmed HU, Zhou Q, et al., 2015. First report of Fusarium proliferatum causing root rot in soybean (Glycine max L.) in Canada. Crop Prot. 67:52-58.
[https://doi.org/10.1016/j.cropro.2014.09.020]

- Chandrika KSVP, Singh A, Prasad RD, Yadav P, 2017. Prominence of seed coating for biotic and abiotic stresses. Popular Kheti. 5:44-46.
-
Conover WJ, Guerrero-Serrano AJ, Tercero-Gómez VG, 2018. An update on a comparative study of tests for homogeneity of variance. J. Stat. Comput. Simul. 88(8):1454-1469.
[https://doi.org/10.1080/00949655.2018.1438437]

-
Dineshkumar R, Subramanian J, Gopalsamy J, Jayasingam P, Arumugam A, et al., 2019. The impact of using microalgae as biofertilizer in maize (Zea mays L.). Waste Biomass Valori. 10:1101-1110.
[https://doi.org/10.1007/s12649-017-0123-7]

-
Dineshkumar R, Subramanian J, Arumugam A, Ahamed Rasheeq A, Sampathkumar P, 2020. Exploring the microalgae biofertilizer effect on onion cultivation by field experiment. Waste Biomass Valori. 11:77-87.
[https://doi.org/10.1007/s12649-018-0466-8]

- Ehsanfar S, Modarres-Sanavy SA, 2005. Crop protection by seed coating. Commun. Agric. Appl. Biol. Sci. 70(3):225-229.
- Haikal NZ, 2008. Control of Rhizoctonia solani in soybean (Glycin max L.) by seed-coating with Trichoderma viride and Gliocladium virens spores. J. Appl. Biosci. 1(2):34-39.
-
Harijati N, Keane PJ, 2012. Disease development caused by Ascochyta rabiei on chickpea detached leaves in petri dishes. Am. J. Plant Sci. 3(10):1369-1375.
[https://doi.org/10.4236/ajps.2012.310165]

-
Halmer P, 2008. Seed technology and seed enhancement. Acta Hortic. 771:17-26.
[https://doi.org/10.17660/ActaHortic.2008.771.1]

-
Jangra S, Mishra A, Kamboj D, Yadav NR, Yadav RC, 2019. Plant responses and tolerance to drought, in: Hasanuzzaman, M., Nahar, K., Fujita, M., Oku, H., Islam, M.T. (Eds.). In Approaches for Enhancing Abiotic Stress Tolerance in Plants. CRC Press pp.79-90.
[https://doi.org/10.1201/9781351104722-4]

-
Jetiyanon K, Wittaya-Areekul S, Plianbangchang P, 2008. Film coating of seeds with Bacillus cereus RS87 spores for early plant growth enhancement. Can. J. Microbiol. 54:861-867.
[https://doi.org/10.1139/W08-079]

-
Kim I-S, 2021. Current perspectives on the beneficial effects of soybean isoflavones and their metabolites for humans. Antioxidants 10(7):1064.
[https://doi.org/10.3390/antiox10071064]

-
Kim SJ, Ko EJ, Hong JK, Jeun YC, 2018. Ultrastructures of Colletotrichum orbiculare in cucumber leaves expressing systemic acquired resistance mediated by Chlorella fusca. Plant Pathol. J. 34(2):113-120.
[https://doi.org/10.5423/PPJ.OA.09.2017.0204]

-
Kim MJ, Shim CK, Ko BG, Kim J, 2020. Effect of the microalga Chlorella fusca CHK0059 on strawberry PGPR and biological control of Fusarium wilt disease in nonpesticide hydroponic strawberry cultivation. J. Microbiol. Biotechnol. 30(5):708-716.
[https://doi.org/10.4014/jmb.2001.01015]

-
Kim YN, Choi JH, Kim SY, Choe H, Shin Y, et al., 2022. Application effect of Chlorella Fusca CHK0059 as a biofertilizer for strawberry cultivation. Korean J. Environ. Agric. 41(4):282-287.
[https://doi.org/10.5338/KJEA.2022.41.4.34]

-
Kusvuran S, 2021. Microalgae (Chlorella vulgaris Beijerinck) alleviates drought stress of broccoli plants by improving nutrient uptake, secondary metabolites, and antioxidative defense system. Hortiic. Plant J. 7(3):221-231.
[https://doi.org/10.1016/j.hpj.2021.03.007]

-
Kruskal WH, Wallis WA, 1952. Use of ranks in one-criterion variance analysis. J. Am. Stat. Assoc. 47(260):583-621.
[https://doi.org/10.1080/01621459.1952.10483441]

- Masuthi DA, Vyakaranahal BS, Deshpande VK, 2009. Influence of pelleting with micronutrients and botanical on growth, seed yield and quality of vegetable cowpea. Karnataka J. Agric. Sci. 22(4):898-900.
-
Mishra B, Tiwari A, Mahmoud AED, 2022. Microalgal potential for sustainable aquaculture applications: bioremediation, biocontrol, aquafeed. Clean Technol. Environ. Policy. 25:675-687.
[https://doi.org/10.1007/s10098-021-02254-1]

-
Mulbry W, Kondrad S, Pizarro C, 2007. Biofertilizers from algal treatment of dairy and swine manure effluents: characterization of algal biomass as a slow-release fertilizer. J. Veg. Sci. 12:107-125.
[https://doi.org/10.1300/J484v12n04_08]

-
León-Vaz A, León R, Diaz-Santos E, Vigara J, Raposo S, 2019. Using agro-industrial wastes for mixotrophic growth and lipids production by the green microalgae Chlorella sorokiniana. N. Biotechnol, 51:31-38.
[https://doi.org/10.1016/j.nbt.2019.02.001]

-
Oliveira RS, Rocha I, Ma Y, Vosátka M, Freitas H, 2016. Seed coating with arbuscular mycorrhizal fungi as an ecotechnological approach for sustainable agricultural production of common wheat (Triticum aestivum L.). J. Toxicol. Environ. Health. A. 79:329-337.
[https://doi.org/10.1080/15287394.2016.1153448]

-
Pedrini S, Merritt DJ, Stevens J, Dixon K, 2017. Seed coating: science or marketing spin? Trends Plant Sci. 22(2):106-116.
[https://doi.org/10.1016/j.tplants.2016.11.002]

-
Pedrini S, Bhalsing K, Cross AT, Dixon KW, 2018. Protocol development tool (PDT) for seed encrusting and pelleting. Seed Sci. Technol, 46(2):393-405.
[https://doi.org/10.15258/sst.2018.46.2.21]

-
Qi JG, Sun S, Yang L, Li MJ, Ma FW, et al., 2019. Potassium uptake and transport in apple roots under drought stress. Hortic. Plant J. 5(1):10-16.
[https://doi.org/10.1016/j.hpj.2018.10.001]

-
Szemruch CL, Ferrari L, 2013. Encrusting offers protection against phytotoxic chemicals and maintains the physiological quality of sunflower (Helianthus annuus) seeds. Seed Sci. Technol. 41(1):125-132.
[https://doi.org/10.15258/sst.2013.41.1.12]

- Rani K, Sandal N, Sahoo PK, 2018. A comprehensive review on chlorella-its composition, health benefits, market and regulatory scenario. J. Pharm. Innov. 7(7):584-589.
-
Ren X, Liang F, Shuangshi D, Huiwen Y, Dandan Z, 2020. Promoting Chlorella photosynthesis and bioresource production using directionally prepared carbon dots with tunable emission. J. Colloid Interface Sci. 569:195-203.
[https://doi.org/10.1016/j.jcis.2020.02.080]

- Righini H, Roberti R, Quintana AM, 2020. Biocontrol of Rhizoctonia solani by water extracts from Chlorella sp. and Halopithys sp. Open Acc. J. Agric. Res. OAJAR-100029.
-
Rocha I, Ma Y, Carvalho MF, Magalhães C, Janoušková M, et al., 2019a. Seed coating with inocula of arbuscular mycorrhizal fungi and plant growth-promoting rhizobacteria for nutritional enhancement of maize under different fertilization regimes. Arch. Agron. Soil Sci. 65:31-43.
[https://doi.org/10.1080/03650340.2018.1479061]

-
Rocha I, Ma Y, Souza-Alonso P, Vosatka M, Freitas H, et al., 2019b Seed coating: a tool for delivering beneficial microbes to agricultural crops. Front. Plant Sci. 10:1357.
[https://doi.org/10.3389/fpls.2019.01357]

-
Rouphael Y, Colla G, Graziani G, Ritieni A, Cardarelli M, et al., 2017. Phenolic composition, antioxidant activity and mineral profile in two seed-propagated artichoke cultivars as affected by microbial inoculants and planting time. Food Chem. 234:10-19.
[https://doi.org/10.1016/j.foodchem.2017.04.175]

-
Yao Z, Qingqing Z, Huankai L, Hui L, Qian L, 2020. Emerging technologies of algae-based wastewater remediation for biofertilizer production: a promising pathway to sustainable agriculture. J. Chem. Technol. Biotechnol. 96(3):551-563.
[https://doi.org/10.1002/jctb.6602]

-
Zandalinas SI, Mittler R, Balfagón D, Arbona V, Gómez-Cadenas A, 2018. Plant adaptations to the combination of drought and high temperatures. Physiol. Plant. 162(1):2-12.
[https://doi.org/10.1111/ppl.12540]

Hwa-Jung Lee, Division of Applied Life Science (BK21Plus), Gyeongsang National University, Graduate student, http://orcid.org/0009-0008-2899-244X
Youn-Sig Kwak, Research Institute of Life Science, Gyeongsang National University, Professor, http://orcid.org/0000-0003-2139-1808

