경북 영양지역 노지고추 진딧물 발생양상 및 방제전략
 ; Oh-hun Kwon2 ; Min-ji Kwon1 ; Seong-im Park1 ; Hyun-suk Cho1 ; Kil-su Jang1 ; Sang-seok Lee1, *
; Oh-hun Kwon2 ; Min-ji Kwon1 ; Seong-im Park1 ; Hyun-suk Cho1 ; Kil-su Jang1 ; Sang-seok Lee1, *
초록
경북 영양지역 노지고추에 발생하는 진딧물의 방제전략 수립을 위한 발생양상 조사 및 살충제 효과검정 결과는 다음과 같았다. 진딧물 발생을 조사한 결과 5월 중순부터 발생이 시작되어 6월 4주차에 발생최성기를 나타내었으며, 이후 낮을 밀도를 유지하다 8월 3주차부터 다시 밀도가 증가하였다. 목화진딧물, 복숭아혹진딧물 2종이 관찰되었으며, 복숭아혹진딧물의 발생밀도가 2.2배 높게 관찰되었다. 진딧물 매개 바이러스를 조사한 결과, PepMoV, BBWV2 2종 바이러스의 비율이 6월, 7월, 8월 각각 88.0%, 87.5%, 89.8%로 우점하여 발생하였으며, 특히 PepMoV 발생비율은 생육후기로 갈수록 증가하였다. 8종 진딧물 방제용 약제의 노지포장 효과검토 결과, afidopyrofen, pyrifluquinazon, spirotetramat 3종의 약제는 약제처리 7일 후, 15일 후, 22일 후 모두 95% 이상의 우수한 약효를 나타내었다. 방제 시작시기별 교호살포(rotation) 효과검토 결과, 5월 중순부터 방제를 시작할 경우 생충수 기준 100%, 바이러스 감염주율(%) 기준 95.3%의 우수한 방제효과를 나타내어, 5월 중순부터 방제가 이루어져야 한다고 판단된다. 약제처리 간격별 효과검토 결과, 10일 간격 처리가 20일 간격 처리구 대비 높은 바이러스 감염주율 억제효과를 보였다. 13종 진딧물 방제용 정식 전 처리제의 노지포장 효과검토 결과, dimpropyridaz 토양혼화처리, spirotetramat 육묘상관주처리는 정식 60일 이후 각각 97.3%, 90.3%의 방제효과를 나타내었으며, cyantraniliprole 3종 약제는 정식 60일 이후 약 85% 수준의 방제효과를 나타내었다.
Abstract
This study examined seasonal occurrences and efficiency testing of insecticides with a focus on aphid management for red pepper in Yeongyang-Gun, Gyeongbuk province. In open fields cultivating red pepper, aphids were first observed in mid-May and the aphids density was highest in the fourth week of june. After the first density peak, the aphid population decreased and increased again in the third week of August. Two aphid species, Aphis gossypii and Myzus persicae were observed and the population of M. persicae was 2.2 times larger than that of A. gossypii at the highest density season. Among five red pepper viruses, Broad bean wilt virus 2 (BBWV2), and Pepper mottle virus (PepMoV) were dominant and the combined incidence proportion for these two viruses was 88.0% in June, 87.5% in July, and 89.8% in August. The proportion of PepMoV continued to increase until the later stages of red pepper growth. Field efficiency testing of eight insecticides sprayed on foliage showed that afidopyrofen, pyrifluquinazon, and spirotetramat had a control value of more than 95% at seven, 15, and 22 days after treatment. In open field testing, control efficiency by insecticide rotation with different application schedules was highest at the start in mid-May. The ten-day spraying interval showed a higher suppression effect on viral infection compared with that of 20-day. At field efficiency testing of 13 insecticides used before transplanting, dimpropyridaz soil treatment, and spirotetramat seedling tray drenching showed a control value of 97.3% and 90.3% at 60 days after transplanting, respectively. Three different types of cyantraniliprole formulation commonly showed a control value of 85% at 60 days after transplanting.
Keywords:
Red pepper, Aphids, Insecticide, Control키워드:
고추, 진딧물, 살충제, 방제서 론
고추(Capsicum annuum L.)는 우리나라 전체 채소 중 가장 많은 재배면적과 생산액을 차지하는 국민 식생활에서 중요한 조미채소로 2023년 재배면적은 27,129 ha로 전체 조미채소 재배면적의 31.6%를 차지하고 있다. 도별 재배면적은 경북이 7,269 ha로 가장 넓고, 전남 4,050 ha, 전북 3,106 ha 순이다(KOSTAT, 2023; KOSIS, 2024). 그 중에서도 안동, 영양, 봉화 등 경북 북부지역의 고추 재배면적은 각각 1,456 ha, 1,190 ha, 960 ha로 국내 최대 고추 주산지로 꼽히고 있다(KOSIS, 2015). 그러나 매년 고추에서 발생하는 병해충으로 인해 생산량은 감소되고 상품성은 낮아져 경제적 손실이 발생하고 있다.
우리나라에서 고추에 발생하는 해충은 담배나방, 점박이응애, 꽃노랑총채벌레, 진딧물 등 모두 28종이 알려져 있으며(RDA, 2024), 비가림하우스에서는 진딧물, 총채벌레, 가루이, 잎응애, 담배나방 등이 주로 피해를 주고(Kim et al., 2012a), 노지 재배지에서는 진딧물, 총채벌레 (Moon et al., 2006; Seo et al., 2018) 및 바이러스 매개에 의한 피해가 심한 편이다(Kwon et al., 2017). 국내 고추 바이러스 발생과 관련하여 1980년대 후반에는 Tobamovirus인 Tobacco mosaic virus (TMV)가 90% 이상 발생하는 것으로 나타났으나(Kim et al., 1990), 2000년 이후 진딧물 전염성인 Cucumber mosaic virus (CMV), Broad bean wilt virus 2 (BBWV2), Pepper mottle virus (PepMoV)의 발생비율이 증가하였다(Cho et al., 2007; Kim et al., 2012b; Kwon et al., 2017; Lee et al., 2004). 특히 노지 재배지의 경우 바이러스를 보독한 진딧물(매개충)의 이동으로 CMV, BBWV2, PepMoV 등의 발생비율이 시설 재배지보다 높은 것으로 나타난다는 보고가 있다(Lee et al., 2004).
해외의 고추 재배지에서는 목화진딧물(Aphids gossypii), 복숭아혹진딧물(Mysus persicae), 감자수염진딧물(Macrosiphum euphorbiae), 싸리수염진딧물(Aulacorthum solani)이 발생한다고 보고되어 있으며(Blackman and Eastop, 2000), 국내에서는 목화진딧물, 복숭아혹진딧물 2종이 우점하여 발생한다고 보고되어 있다(Kim et al. 1986). 목화진딧물과 복숭아혹진딧물은 전 세계적으로 분포하며 다양한 작물을 가해하는 주요 농업해충이다. 작물을 흡즙하는 직접적인 피해 외에도 다양한 식물바이러스를 매개하여 작물에 2차적인 피해를 준다(Blackman and Eastop, 2000; Ebert and Cartwright, 1997 ).
고추 재배지에서 진딧물 피해를 경감하기 위해서는 화학적 방제법이 널리 사용되고 있다. 1940년대 유기인계(organophosphates), 1950년대 카바메이트계(cabamates), 1970년대 피레스로이드계(pyrethroids) 살충제가 개발되어 진딧물 방제에 사용되었으며(Tomlin CDS, 2009), 1990년대부터 개발된 imidaclorpid로 대표되는 네오니코티노이드계(neonicotinoids) 살충제는 곤충 신경연접의 Acetylcholine receptor에 결합하여 빠른 약효 및 넓은 해충 스펙트럼을 나타낸다는 장점으로 전 세계에 널리 보급되었다(Chao et al., 1997, Larry, 2010). 이처럼 진딧물의 방제에서 살충제의 사용은 중요한 전략 중 하나지만, 저항성을 유발하기도 한다. 살충제에 대한 진딧물의 저항성은 1960년대 유기인계 약제에 대한 목화진딧물의 저항성이 보고된 후, pyrethroids계, cabamates계, neonicotinoids계 등 다양한 계통의 약제에 대한 저항성 사례가 발표되고 있다(Herron and Wilson, 2011; Toor et al., 2008; Wang et al., 2007). 국내에서도 진딧물의 살충제 저항성 문제는 1980년대부터 다양한 계통의 살충제에 대하여 보고되고 있으며(Choi and Kim, 1986; Choi et al., 1989), 2000년 이후에는 neonicotinoids계통 약제에 대한 저항성 보고가 증가하였다(Choi et al., 2001, Choi et al., 2005, Koo et al., 2014). 이에 따라 국내에서도 neonicotinoids계통과 동일한 작용기작을 가지지만 화학적그룹이 다른 sulfoximines계 sulfoxaflor(2011년 등록), flonicamid계 flonicamid(2006년 등록), pyridine azomethine derivatives계 pyrifluquinazon(2012년 등록), tetronic and tetramic acid derivatives계 spirotetramat(2012년 등록), diamides계 cyantraniliprole(2012년 등록), pyropenes계 afidopyropen (2020년 등록), pyridazine pyrazolecarboxamides계 dimpropyridaz (2023년 등록) 등의 새로운 계통 진딧물 약제들이 출시되어 고추에 살포되고 있으며(RDA, 2024), 그에 따른 고추에 사용되는 진딧물 약제들에 대한 활성평가와 이를 통한 방제전략 수립이 중요하다. 본 연구에서는 진딧물 종합방제 기초자료를 제공하기 위하여 고추 노지 재배지에서 진딧물 발생양상 및 바이러스 발생분포를 조사하였으며, 진딧물 적용약제에 대한 약제별, 처리방법별, 처리시기별, 처리간격별 포장 효과검정을 수행하였다.
재료 및 방법
진딧물 발생 모니터링
재배기간 진딧물 발생 모니터링은 영양고추연구소 노지포장에서 실시하였다. 2012년부터 매년 진딧물 발생을 조사하였으며, 5월 3주차부터 9월 4주차까지 7일 간격으로 고추의 상위엽, 중위엽, 하위엽 총 100엽에 발생하는 진딧물의 평균 마리수를 조사하였다.
재배기간 중 진딧물 종별 발생 모니터링 또한 영양고추 연구소 노지포장에서 실시하였다. 2023년 5월 2주차부터 10월 1주차까지 7일 간격으로 총 100엽(20주에서 주당 5엽씩 조사)에 발생하는 진딧물을 조사하였으며, 종 동정은 루페(10X, Nikon, Tokyo, Japan)를 이용하여 RDA(2022)의 형태특성을 참고하여 종 동정하였다.
고추 바이러스 발생 모니터링
영양지역 내 노지 고추포장 20곳에서 2012년부터 매년 바이러스 감염정도를 조사하였다. 7월 상순부터 9월 상순까지 10일 간격으로 포장별로 1,000주에 발생하는 바이러스 감염주를 조사하였다. Kwon et al.(2017)이 발표한 고추 바이러스 발생증상(모자이크, 퇴곡, 황화, 괴저, 기형잎 등)을 보이는 고추를 육안으로 확인하여 바이러스 감염주로 카운팅하였으며, 바이러스 감염주율(%)은 감염주/조사주 x 100으로 산출하였다.
바이러스 종류별 발생정도는 영양고추연구소 노지포장에서 실시하였다. 2023년 월 1회(6월 7일, 7월 8일, 8월 2일) 바이러스에 감염된 고추를 약 40점씩 샘플링 한 후 실험실로 가져와 고추 5종 바이러스(BBWV2, CMV, PMMOV, PepMoV, TSWV) 특이적 primer(Table 1)를 이용하여 reverse transcription polymerase chain reaction (RT-PCR) 방법으로 진단하였다. 바이러스 감염이 의심되는 고추 잎(지름 0.5cm 원형 시료)을 2.0 ml tube (eppendorf, Hamburg, Germany)에 넣고, TissueLyser Ⅱ (Qiagen, Hilden, Germamy)에서 1,500 rpm으로 30초간 분쇄 후 Viral DNA/RNA Extraction Kit (Intron, Seongnam, Korea)를 이용하여 핵산을 추출하였다. 추출된 핵산을 SuPrimeScript RT-PCR premix (GenetBio, Daejeon, Korea)에 첨가하여 RT-PCR을 진행하였다. 먼저 50℃에서 30분간 역전사 반응을 진행하여 cDNA를 확보하였다. 확보된 cDNA는 다시 95℃에서 2분간 초기 변성과정 이후 95℃에서 30초, 57℃에서 30초, 72℃에서 45초의 온도 주기로 총 35회 진행되었다. 이후 72℃에서 10분 최종연장을 추가하였다. 증폭된 PCR 산물은 전자전기영동장치인 QIAxcel Advanced (Qiagen, Hilden, Germamy)를 이용하여, DNA 증폭여부 및 증폭량을 확인하였다.
경엽처리제 포장 효과검정
국내에서 고추에 진딧물 방제용 경엽처리제로 등록되어 판매중인 단제 8종(acetamiprid, clothianidin, dinotefuran, imidacloprid, afidopyrofen, flonicamid, pyrifluquinazon, spirotetramat)에 대한 포장 효과검토를 진행하였다(Table 2). 시험은 영양고추연구소 내 노지포장에서 난괴법 3반복으로 수행하였다. 2022년 5월 4일 정식(120 cm x 40 cm, 한줄 정식)한 고추(PR백두홍)를 대상으로 진행하였으며, 무처리 진딧물 평균밀도가 주당 평균 189.3마리 이상 수준일 때 동력분무기(EP-55W4H, ASABA, Nagano, JAPAN)를 이용하여 경엽처리(5월 31일) 하였다. 약제처리 전 및 처리 7일 후, 15일 후, 처리 22일 후 생충수(반복당 10주)를 조사하였다. 방제효과(Control value, %)는 [(a-b)/a]x100으로 산출하였으며, a는 무처리 생충률(%), b는 처리구 생충률(%) 이다. 유기인계, 카바메이트계, 피레스로이드계통 약제는 최근에 진딧물 방제용으로 사용이 많지 않으므로 검토에서 제외하였다.
진딧물 방제시기별 효과검정
방제시기별 효과검정은 영양고추연구소 내 노지포장에서 난괴법 3반복으로 수행하였다. 2022년 5월 4일 정식한 고추(PR백두홍)을 대상으로 방제 시작시기를 다르게 한 4개 처리구(5월 중순 시작, 5월 하순 시작, 6월 상순 시작, 6월 중순 시작)에 대한 진딧물 생충수(반복당 10주)와 바이러스 감염주율(반복당 30주)을 조사하여 방제효과로 산출하였다. 바이러스 감염주는 Kwon et al.(2017)이 발표한 고추 바이러스 발생증상을 참고하여 육안으로 조사하였다. 약제처리는 동력분무기를 이용하였으며, 시기 및 순서는 Table 4와 같이 10일~15일 간격으로 진행하였다.
진딧물 약제처리 간격별 효과검정
약제처리 간격별 효과검정은 영양고추연구소 내 노지포장에서 난괴법 3반복으로 수행하였다. 2022년 5월 4일 고추를 정식하였으며, 품종은 진딧물 및 바이러스 발생피해가 많은 경북 영양지역 재래종 고추품종인 “영교5호”와 “영교6호”를 정식하였다. 5월 중순(5월 16일)부터 방제를 시작하여 처리 간격별(10일 간격 처리, 20일 간격 처리) 효과를 비교하였으며, 효과평가는 진딧물 생충수(반복당 10주)와 바이러스 감염주율 (반복당 60주)을 조사하여 방제효과로 산출하였다. 약제처리는 동력분무기를 이용하였으며, 약제처리 내역은 Table 5와 같이 진행하였다.
정식 전 처리제 포장 효과검정
국내에서 고추에 진딧물 정식 전 처리제로 등록되어 판매중인 단제 및 합제 13종(Dinotefuran WG/GR, Imidacloprid GR, Thiamethoxam GR, Benfuracarb+Imidacloprid GR, Buprofezin+Imidacloprid GR, Tefluthrin+Thiamethoxam GR, Cyantranililprole SC/GR, Cyantraniliprole +Pymetrozine WG, Dimpropyridaz GR, Flonicamid GR, Spirotetramat SC)에 대한 포장 효과검토를 진행하였다(Table 3). 고시된 농약 처리방법 및 기준(RDA, 2024)을 참고하여 파종시 혼화처리(2월 13일), 토양 처리(3월 30일), 육묘상 처리/육묘상 관주처리(5월 2일) 한 후 고추(PR백두홍) 육묘를 2023년 5월 3일 영양고추연구소 내 노지포장에 정식(120 cm x 40 cm, 한줄 정식) 하였으며, 정식 30일 후, 51일 후, 60일 후 생충수(반복당 10주)를 조사하였다. 방제효과(Control value, %)는 [(a-b)/a] x100으로 산출하였으며, a는 무처리 생충수, b는 처리구 생충수이다.
통계분석
약제별 효과검정, 처리시기별 효과검정 결과분석은 Duncan’s multiple range test로 유의수준 5%에서 생충률(%), 생충수, 바이러스 감염주율(%)의 차이를 비교하였다(R version, 4.2.1).
결 과
노지포장 진딧물 연중 발생변화
2012년부터 진딧물 발생조사를 한 결과(fig. 2), 평년(2012년~ 2021년)의 경우 5월 중순부터 발생이 시작되어 6월 4주차에 발생최성기를 나타내었으며, 이후 7월 4주차부터 8월 2주차까지 잎당 0.1마리 이하로 낮은 밀도를 유지하다 8월 3주차부터 다시 밀도가 증가하여 수확이 끝나는 9월 4주차까지 지속적으로 진딧물의 발생이 관찰되었다. 2023년의 경우도 평년과 마찬가지로 5월 중순부터 발생이 시작되어 6월 4주차에 발생최성기를 나타내었으며, 7월 3주차, 4주차에 잎당 0.2마리 이하로 낮은 밀도를 유지하다가 7월 5주차부터 다시 밀도가 증가하여서 9월 4주차까지 지속적으로 진딧물 발생이 관찰되었다. 한편 2022년의 경우 5월부터 7월 상순까지 지속적인 가뭄으로 고온건조한 기후가 형성되면서 7월 1주차까지 진딧물 발생이 지속적으로 증가하였으며 발생밀도는 발생최성기 기준 평년대비 4.9배 증가하는 양상을 보이기도 하였다.
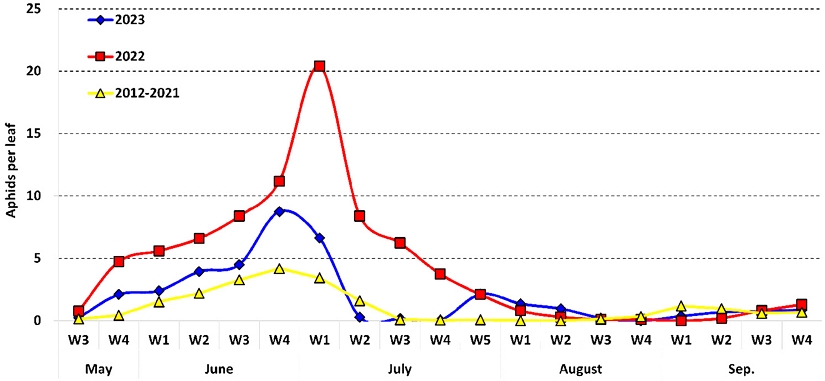
Population dynamics of aphids in open fields of red peppers. ‘W1 ~ W5’ means the number of week of the month.
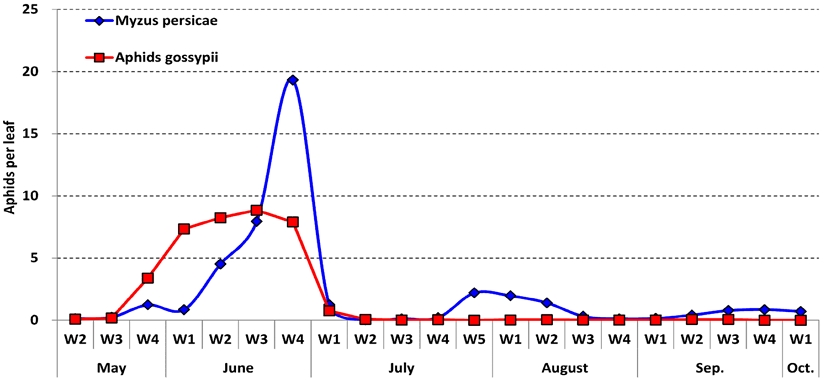
2023년 진딧물 종별 발생조사를 한 결과(fig. 3), 복숭아혹진딧물, 목화진딧물 2종 모두 5월 2주차부터 발생이 관찰되었다. 목화진딧물은 6월 3주차에 발생최성기를 나타내었으며, 이후 밀도가 감소하여 수확이 끝날 때까지 잎당 0.1마리로 낮은 밀도를 유지하였다. 복숭아혹진딧물은 6월 4주차에 발생최성기를 나타내었으며, 이후 강우로 인해 밀도가 급격하게 감소하였다가 7월 5주차부터 다시 밀도가 증가하여서 10월 상순까지도 발생이 관찰되었다. 발생최성기 기준 복숭아혹진딧물은 잎당 19.3마리, 목화진딧물은 잎당 8.9마리로 복숭아혹진딧물의 발생밀도가 2.2배 높게 관찰되었다.
노지포장 바이러스 발생양상
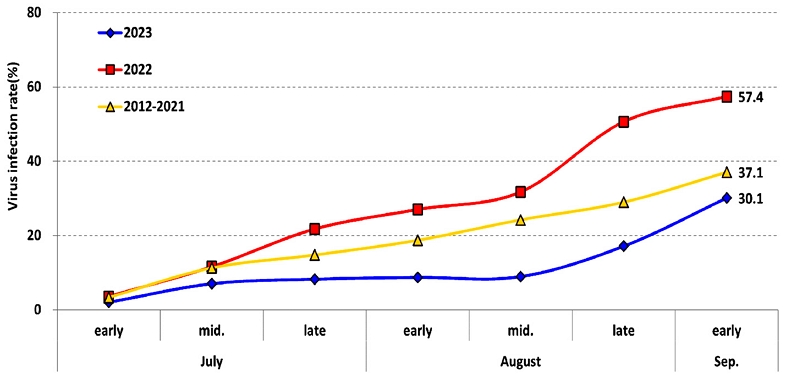
영양지역 내 노지 고추포장에서 2012년부터 바이러스 감염정도를 조사한 결과(fig. 4), 평년(2012년 ~ 2021년)의 경우 7월 상순에는 5% 이하의 감염주율을 보였으며 이후 지속적으로 바이러스 감염주가 증가하여서 수확기인 9월 상순에는 37.1% 감염주율을 보였다. 2022년, 2023년 또한 7월 상순에는 각각 3.6%, 2.1%의 낮은 감염주율을 보였으나 이후 수확기까지 지속적으로 증가하여서 9월 상순에는 각각 57.4%, 30.1%의 높은 감염주율을 보였다.
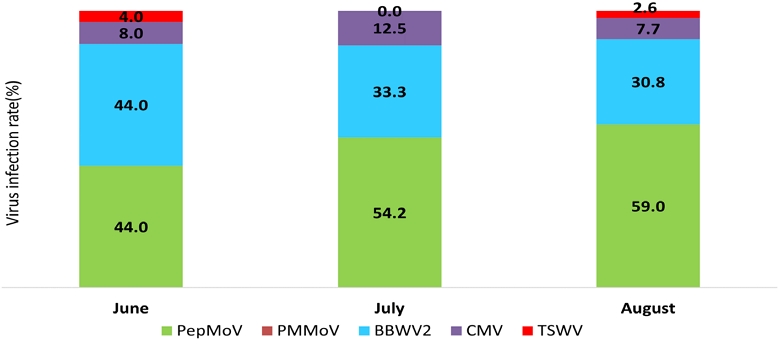
2023년 고추에 발생하는 5종 바이러스 감염정도를 조사한 결과(fig. 5), 진딧물이 매개하는 PepMoV, BBWV2, CMV 3종 바이러스의 비율이 6월, 7월, 8월 각각 96.0%, 100%, 97.5%로 가장 높게 나타났다. 그 중 PepMoV, BBWV2 2종 바이러스의 비율이 6월, 7월, 8월 각각 88.0%, 87.5%, 89.8%로 우점하여 발생하였으며, PepMoV의 경우 6월 44.0%, 7월 54.2%, 8월 59.0%로 생육후기로 갈수록 감염비율이 높아짐을 알 수 있었다.
경엽처리제 포장 효과검정
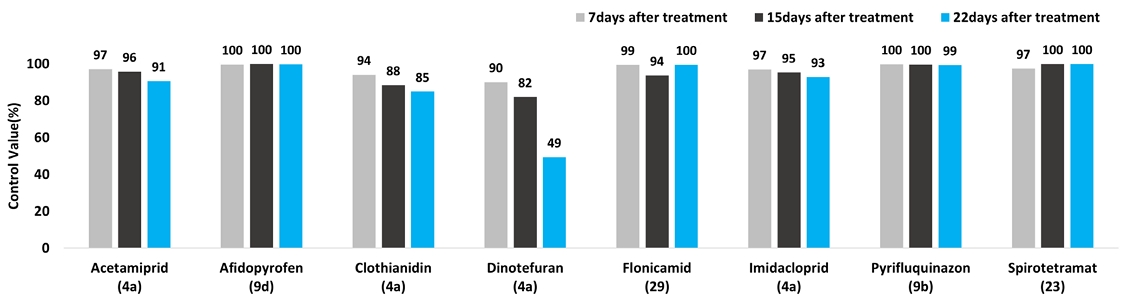
8종 진딧물 방제용 약제를 대상으로 노지포장에서 포장검정을 수행한 결과는 Fig. 6와 같다. 약제처리 7일, 15일, 22일 후 생충수를 조사한 결과 acetamiprid와 imidacloprid는 처리 7일 후, 15일 후 모두 95% 이상의 방제효과를 보였지만 22일 후 95% 이하의 방제효과를 나타내었다. Clothianidin과 Dinotefuran은 처리 7일, 15일, 22일 후 모두 95% 이하의 방제효과를 나타내었다. Flonicamid는 처리 7일 후, 22일 후 95% 이상의 방제효과를 보였지만, 처리 15일 후 95% 이하의 방제효과를 나타내었다. 반면에 afidopyrofen, pyrifluquinazon, spirotetramat 3종의 약제는 약제처리 7일 후, 15일 후, 22일 후 모두 95% 이상의 우수한 약효 및 지속효과를 나타내었다.
진딧물 방제시기별 효과검정
노지포장에서 진딧물 경엽처리제의 방제시작 시기를 다르게 적용한 결과는 Table 4와 같았다. 진딧물 발생최성기인 6월 하순 생충수를 조사한 결과, 5월 중순, 5월 하순, 6월 상순부터 방제를 시작한 경우는 각각 100%, 100%, 97.7%의 높은 방제효과를 보였으며, 6월 중순부터 방제를 시작한 경우 84.5%의 낮은 방제효과를 나타내었다. 고추 바이러스 발생이 증가하는 7월 상순 바이러스 감염주율을 조사한 결과, 5월 중순, 5월 하순, 6월 상순, 6월 중순 방제를 시작한 경우 각각 95.3%, 85.8%, 61.8%, 28.3%의 방제효과를 나타내어 진딧물 방제 시작시기가 늦어질수록 바이러스 감염주율이 높아지는 경향을 보였다.
진딧물 약제처리 간격별 효과검정
노지포장에서 진딧물 경엽처리제의 처리간격을 다르게 적용한 결과는 Table 5와 같았다. 5월 중순부터 진딧물과 바이러스 피해가 많은 영양지역 재래종 고추품종인 “영교 5호”, “영교 6호”를 대상으로 방제를 시작하여 발생최성기인 6월 하순 생충수를 조사한 결과, 10일 간격 처리구, 20일 간격 처리구 모두 99.0% 이상의 높은 방제효과를 나타내었다. 7월 상순 바이러스 감염주율을 조사한 결과, “영교 5호” 품종에서는 10일 간격 처리구와 20일 간격 처리구의 간의 통계적 유의성은 관찰되지 않았으나, “영교 6호” 품종에서는 10일 간격 처리구, 20일 간격 처리구 각각 85.1%, 53.3%의 방제효과를 나타내어 10일 간격 처리시 바이러스 감염이 억제되는 경향을 보였다.
정식 전 처리제 포장 효과검정
13종의 진딧물 방제용 정식 전 처리제를 대상으로 노지포장에서 포장검정을 수행한 결과는 Table 6과 같다. 정식 30일 후, 51일 후, 60일 후 진딧물 생충수를 조사한 결과, dinotefuran WG(육묘상 관주처리), dinotefuran GR(육묘상 입제처리)은 정식 30일 후 각각 95.7%, 87.3%의 방제효과를 나타내었으며, 정식 60일 후에는 각각 70.8%, 63.2%로 방제효과가 감소하였다. Imidacloprid 단제 및 합제 3종(imidaclorpid GR, benfuracarb+imidacloprid GR, buprofezin+ imidacloprid GR)을 토양처리시 정식 30일 후 90% 수준의 방제효과를 나타내었으며, 정식 60일 후 80% 수준의 방제효과를 나타내었다. Thiamethoxam GR, Tefluthrin+Thiamethoxam GR은 토양처리시 정식 30일 후 각각 91.4%, 81.8%의 방제효과를 나타내었으며, 정식 60일 후는 70% 수준으로 방제효과가 감소하였다. Flonicamid GR은 토양처리시 정식 30일 후 88.3%이 방제효과를 나타내었으며, 정식 60일 후 40.7%로 방제효과가 감소하였다. Cyantraniliprole 단제 및 합제 2종(cyantraniliprole SC, cyantraniliprole +pymetrozine WG)을 육묘상 관주처리시 정식 30일 후 각각 96.6%, 88.0%의 방제효과를 나타내었으며, 정식 60일 후 각각 83.7%, 86.7%의 방제효과를 나타내었다. Cyantraniliprole GR을 파종시 상토혼화처리 할 경우, 정식 30일 후, 정식 60일 후 각각 97.2%, 86.2%의 방제효과를 나타내었다. Dimpropyridaz GR은 토양처리시 정식 30일 후, 정식 60일 후 각각 99.7%, 97.3%의 높은 방제효과 및 지속효과를 나타내었다. Spirotetramat SC를 육묘상 관주처리시 정식 30일, 정식 60일 후 각각 97.0%, 90.3%의 높은 방제효과 및 지속효과를 나타내었다.
고 찰
본 연구는 경북 북부지역 고추 노지포장에서 진딧물 발생양상 및 바이러스 발생분포를 조사하였으며, 진딧물 적용약제에 대한 약제별, 처리방법별, 처리시기별, 처리간격별 포장 효과검정을 통하여 진딧물 및 바이러스 방제에 활용 가능한 자료를 제공하고자 수행하였다.
Kim et al.(1986)에 따르면 우리나라 고추 진딧물의 발생은 5월 상중순부터 유입이 되어, 6월 하순과 9~10월에 최고밀도를 나타내는 쌍봉형곡선을 나타낸다고 하였다. 본 연구에서도 고추 진딧물 발생은 5월 중순부터 발생하여 6월 4주차 발생최성기를 나타낸 후 감소하다 8월 3주차부터 다시 밀도가 증가하는 동일한 경향을 나타내었다. 또한 선행연구에서 7~8월에 밀도가 급감하는 이유는 평균 25℃ 이상의 고온과 함께 강우의 영향이 매우 크며, 고추와 같이 엽면적이 작은 채소는 강우량에 의한 치사효과가 크기 때문이라고 하였다(Kim et al., 1986). 2022년 조사시 7월 상순까지 밀도가 지속적으로 증가하였으며, 높은 밀도(평년대비 4.9배 증가)를 나타낸 원인 또한 7월 상순까지 이어진 지속적인 가뭄이 진딧물 발생에 영향을 준 것이라고 판단된다. 2023년 진딧물의 종별 발생조사에서 1차 발생시기(5월~6월)에는 복숭아혹진딧물, 목화진딧물 2종 모두 비슷한 발생양상을 보였으며, 복숭아혹진딧물이 2.2배 높은 밀도를 나타내었다. 2차 발생시기(8월~9월)에는 대부분 복숭아혹진딧물만 관찰이 되었다. 고추 가해 진딧물의 우점종은 계절간에 다르게 나타나고 있으므로(Kim et al., 1986), 지속적 종별 발생모니터링이 필요하다고 판단된다. 또한 5월에는 대부분 신초에 발생하였으나, 8월 중하순부터는 대부분 하위엽에 발생하는 경향을 나타내었다. 진딧물의 발생위치는 방제에 있어서 중요한 참고사항이 될 수 있으므로 시기별, 종별 발생위치 또한 검토가 되어야 할 것으로 판단된다.
2004년 전국의 노지 고추포장 바이러스 발생조사에서 8월 상순 조사지역에 비해 9월 상순 조사지역은 바이러스 발병률이 매우 높게 나타났으며, 생육 후기에는 100%에 가까운 발병률을 보이는 포장을 흔히 볼 수 있다고 하였다(Lee et al., 2004). 영양지역 노지 고추포장에서도 7월 상순까지 5% 이하의 바이러스 감염주율을 보여주었으나 이후 수확기인 9월까지 지속적으로 증가하는 경향을 나타내었다. 이는 봄철에 발생하여 7월 상순까지 이어지는 진딧물 발생이 7월부터 바이러스 감염주가 확산하는데 영향을 준 것으로 판단된다. 또한 8월부터 재발생하는 진딧물은 수확기인 8월, 9월 바이러스 확산에 영향을 준 것으로 판단된다.
2002년 우리나라 노지고추에서는 진딧물이 매개하는 BBWV2, CMV, PepMoV가 우점하며, 특히 경북지역에서는 BBWV2, PepMoV 발생비율이 높다고 하였다(Lee et al., 2004). 2012년부터 2016년까지 영양지역 노지고추에서는 CMV 46.1%, BBWV2 41.5%, PepMoV 2.0%, PVY 2.0%, PMMoV 4.4%, TSWV 0.1%로 CMV와 BBWV2가 우점하는 바이러스로 나타났다(Kwon et al., 2017). 본 연구결과에서도 BBWV2, CMV, PepMoV 3종 바이러스의 비율이 90% 이상을 차지할 정도로 진딧물 매개 바이러스의 비율이 높게 나타나는 경향을 보였으며, 특히 PepMoV의 경우 7월, 8월 발생비율이 50%를 넘을 정도로 높게 나타나서 지속적인 발생 모니터링 및 감염양상에 대한 연구가 필요하다.
진딧물 적용 살충제에 대한 국내 선행연구 결과, nicotinoids계(Mode of Action : 4A)에 포함된 acetamiprid, clothianidin, imidacloprid, thiamethoxam, thiacloprid 등 살충제에 대한 진딧물의 저항성 발현이 보고되었다(Choi et al., 2005; Koo et al., 2014). 본 연구에서도 neonicotinoids 계에 포함된 acetamiprid, clothianidin, imidacloprid, dinotefuran은 노지포장에서 경엽처리시 대체로 저조한 약효를 나타내어 neonicotinoids계 약제에 대한 진딧물의 저항성 발현이 있을 것으로 추측된다. 한편 살충제의 약제저항성 발현 억제를 위해서는 다른 계통 약제의 교호살포가 매우 중요하다(Sparks and Nauen, 2015; Harron and Wilson, 2017). Neonicotinoids계통이 아닌 afidopyrofen (MoA : 9D), pyrifluquinazon (MoA : 9B), spirotetramat (MoA : 23) 3종 약제는 처리 후 22일까지 95% 이상의 우수한 약효를 나타내어서 지역내 진딧물 방제에 우선 적용이 되어야 할 것으로 판단된다. Flonicamid (MoA : 29)는 경엽처리 7일, 22일 후에는 우수한 효과를 나타내었지만, 15일 후에는 95% 이하로 방제효가가 낮아졌다. 고추 목화진딧물 채집개체를 대상으로 한 선행연구 결과에서도 flonicamid는 7종 살충제 중 채집집단에 따른 살충활성 편차가 가장 크게 나타나서(Kang et al., 2023), nicotinoids계통 약제와 함께 지역내 개체의 저항성 발현에 대한 추가적인 분석이 필요하다. 또한 본 연구에서 우수한 약효를 나타낸 afidopyrofen, pyfluquinazon, spirotetramat를 포함하여, 본 연구에서 검토하지 않은 신규약제인 dimpropyridaz (MoA : 36), neonicotinoids계통과 동일한 작용기작을 가지지만 sulfoximines계(MoA 4C)에 속하는 sulfoxaflor을 포함한 진딧물 적용 살충제 전반에 대한 약효평가와 지속적인 저항성 모니터링이 필요할 것으로 생각된다.
노지고추 해충방제시 해충 발생시기에 연계한 방제 시작시기의 설정은 매우 중요하다(Lee et al., 2022). 경북 북부지역 노지고추 재배농가의 관행적 진딧물 방제 시작시기를 조사한 결과, 정식(5월 상순) 후 잎과 줄기의 본격적인 생장이 시작되는 5월 하순부터 방제를 시작한다. 본 연구에서 진딧물의 발생이 시작되는 5월 중순부터 진딧물 약제를 교호살포(rotation) 하였을 경우, 5월 하순부터 방제를 시작한 경우보다 우수한 바이러스 감염주 억제효과를 나타내어서, 진딧물의 유입과 동시에 빠른 약제살포가 이뤄져야 한다. 해충방제시 방제간격 또한 방제효율에서 매우 중요한 요소이다(Miranda et al., 2021). 지역 고추 재배농가의 관행적 방제패턴을 조사한 결과 재배초기인 5월, 6월에는 주로 14일에서 20일 간격으로 약제살포를 하다가 착과기인 7월, 8월에는 7일에서 10일 간격으로 약제살포 간격을 줄인다. 5월 중순부터 진행한 처리간격별 시험에서 10일 간격 처리구, 20일 간격 처리구 모두 우수한 진딧물 방제효과를 나타내었지만, 10일 간격 처리구가 보다 낮은 바이러스 감염주율을 나타내어서 진딧물 매개 바이러스 피해가 많은 지역에서는 처리간격을 10일 이하로 줄여서 방제할 필요가 있다.
진딧물의 효과적인 방제를 위해서는 경엽처리와 함께 정식 전 처리제 사용이 매우 중요하다. 침투이행성을 가진 살충제의 정식 전 처리는 재배 초기부터 발생하는 진딧물을 효과적으로 방제하여 바이러스 발생을 줄여 줄 수 있다. 국내에서 기존 진딧물 정식전 처리제 사용유형은 입제를 활용한 “토양혼화처리” 또는 “토양파구처리” 형식이였지만, 최근에는 작물체내의 약제침투율 상승, 농작업 편리성 향상, 작업자 약제노출 감소 등의 목적으로 파종시 또는 육묘단계에 처리하는 “파종시 상토혼화처리”, “육묘상 처리”, “육묘상 관주처리” 등의 방식으로 약제가 사용되어지고 있으며, 액상수화제, 유탁제, 입상수화제 등 다양한 제형의 약제가 적용되고 있다(RDA, 2024). 또한 neonicotinoids계통으로 구성되었던 진딧물 정식 전 처리제는 침투이행성을 가진 다양한 계통의 약제들(cyantraniliprole, dimpropyridaz, flonicamid, spirotetramat)로 대체되어 사용되고 있다(RDA, 2024). 국내에서 진딧물 정식 전 처리제로 사용되는 13종 살충제의 포장검토 결과, 대부분의 약제는 침투이행에 의해 정식 60일 이후까지도 60% 이상의 약효를 보여주었으며 원제성분 및 제형에 따른 약효차이를 보여주었다. 그 중 dimpropyridaz는 곤충의 현음기관인 chordotonal organ의 기능을 저해하여 흡즙해충의 행동이상을 일으키는 pyridazine pyrazolecarboxamides계(MoA : 36)에 속하는 신규 진딧물 방제제로(Christian et al., 2023), 토양혼화처리시 정식 60일 이후 95% 이상의 우수한 약효를 나타내었다. Tetronic and tetramic acid derivatives계(MoA : 23) spiroteramat는 곤충의 지방산 생성을 억제하여 탈피과정을 저해하는 약제로(Nauen et al. 2008), 육묘상관주처리시 정식 60일 후 90% 이상의 약효를 나타내었다. Diamides계(MoA : 28) cyantraniliprole은 흡즙해충에 작용시 근육의 ryanodine receptor에 작용하여 구침마비를 통한 섭식저해를 일으키며(Selby et al., 2013; Lee et al., 2022), 이러한 탐침활동의 저해로 Tomato spotted wilt virus (TSWV), Tomato yellow leaf curl virus (TYLCV)와 같은 흡즙해충 매개 바이러스의 억제효과가 있다고 알려져 있다(Jacobson and Kennedy, 2013; Lee et al., 2014). 진딧물, 가루이, 나방 등 적용해충의 범위가 넓고(Selby et al., 2013), 침투이행이 우수한 약제특성으로 국내에서는 4가지 제형이 정식 전 처리제로 사용되고 있으며, 검토결과 cyantraniliprole 3종은 정식 60일 이후 약 85% 수준의 방제효과를 나타내었다. 이처럼 정식 전 처리제의 사용은 진딧물 방제에서 매우 중요한 요소이며, 진딧물 문제농가에서는 반드시 효과적인 정식 전 처리제 사용이 권장된다. 하지만 정식 전 처리제와 정식 후 사용되는 경엽처리제는 제형, 처리시기, 처리방법은 다르지만 대부분 동일계통 약제로 이루어져 있으므로, 동일계통 약제의 연용으로 살충제 저항성 발현이 앞당겨질 수도 있다(Herron et al., 2017). 따라서 정식 전 처리제와 정식 후 경엽처리제는 교호살포(rotation)의 개념으로 함께 관리되어져야 한다고 판단되며, 지속적인 저항성 모니터링도 필요하다.
Acknowledgments
본 연구는 농촌진흥청 지역특화작목 기술개발사업(과제번호 : PJ016958 012022)에 의해 수행한 “지역특화 재래종 고추의 소비확대를 위한 고품질 안전생산 및 부가가치 향상 기술 개발” 과제로 수행되었습니다.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
- Blackman RL, Eastop VF, 2000. Aphids on the world’s crops; An identification and information guide. John Wiley & Sons Ltd., London. UK. pp.61.
-
Chao SL, Dennehy TJ, Casida JE, 1997. Whitefly (Hemiptera: Aleyrodidae) binding site for imidacloprid and related insecticides: a putative nicotinic acetylcholine receptor J. Econ. Entomol. 90(4):879-882.
[https://doi.org/10.1093/jee/90.4.879]

-
Cho JD, Kim JS, Lee SH, Choi,GS, Chung BN, 2007. Viruses and symptoms on peppers, and their infection types in Korea, and their infection types in Korea. Res. Plant Dis. 13(2):75-81. (In Korean)
[https://doi.org/10.5423/RPD.2007.13.2.075]

- Choi BR, Lee SW, Park HM, Yoo JK, Kim SG, et al., 2005. Monitoring on insecticide resistance of major insect pests in plastic house. Korean J. Pestic. Sci. 9(4):380-390. (In Korean)
- Choi BR, Lee SW, Yoo JK, 2001. Resistance mechanisms of green peach aphid, Myzus persicae (Homoptera: Aphididae), to imdacloprid. Korean. J. Appl. Entomol. 40, 265-271. (In Korean)
- Choi BY, Lee, SW, Lyu JK, 2001. Resistance Mechanisms of Green Peach Aphid, Myzus persicae (Homoptera: Aphididae), to imidacloprid. Kor. J. Appl. Entomol. 40:265-271.
- Choi SW, Kim, GH, 1986. Studies on the resistance of green peach aphids to insecticides (II)-local differences in susceptibility. Kor. J. Appl. Entomol. 25:151-157.
- Choi SW, Kim GH, Ahn YJ, 1989. Studies of the insecticide resistance in the green peach aphid, Myzus persicae Sulzer(V). development of cypermethrin and pirimicarb resistance, and cross resistance. Kor. J. Appl. Entomol. 28:23-27.
-
Christian S, Vincent LS, Narayanan B, Michael DD, Martin CG, et al., 2023. The novel pyridazine pyrazolecarboxamide insecticide dimpropyridaz inhibits chordotonal organ function upstream of TRPV channels. Wiley Online Library..
[https://doi.org/10.1002/ps.7352]

- Ebert TA, Cartwright B, 1997. Biology and ecology of Aphis gossypii glover (Homoptera: Aphididae). Department of entomology, Oklahoma State Univ., Stillwater. USA.
-
Herron GA, Wilson LJ, 2011. Neonicotinoid resistance in Aphis gossypii glover (Aphididae: Hemiptera) from Australian cotton. Australian J. Entomol. 50(1):93-98.
[https://doi.org/10.1111/j.1440-6055.2010.00788.x]

-
Herron GA, Wilson LJ, 2017. Can resistance management strategies recover insecticide susceptibility in pests?: a case study with cotton aphid Aphis gossypii (Aphididae: Hemiptera) in Australian cotton. Austral Entomology. 56:1-13.
[https://doi.org/10.1111/aen.12236]

-
Jacobson AL, Kennedy GG, 2013. Effect of cyantraniliprole on feeding behavior and virus transmission of Frankliniella fusca and Frankliniella occidentalis (Thysanoptera: Thripidae) on Capsicum annuum. Crop Protection. Volume 54:251-258.
[https://doi.org/10.1016/j.cropro.2013.08.018]

-
Larry PS, 2010. Imidacloprid: A Neonicotinoid Insecticide. Hayesʼ Handbook of Pesticide Toxicology (Third Edition). Academic press. Riverside. pp.2055-2064.
[https://doi.org/10.1016/B978-0-12-374367-1.00095-1]

-
Lee DH, Kim CY, Kim KS, Shin JH, Youn YN, et al., 2022. Seasonal occurrence and management strategies for thrips on red pepper in Northern Gyeongbuk province. Korean J. Pestic. Sci. 26(4):259-271. (In Korean)
[https://doi.org/10.7585/kjps.2022.26.4.288]

-
Lee MH, Lee HK, Lee HG, Lee SG, Youn YN, et al., 2014. Effect of cyantraniliprole against of Bemisia tabaci and prevention of Tomato Yellow Leaf Curl Virus (TYLCV). Korean J. Pestic. Sci. 18(1):33-40. (In Korean)
[https://doi.org/10.7585/kjps.2014.18.1.33]

-
Lee SH, Lee JB, Kim SM, Choi HS, Moon JS, et al., 2004. The incidence and distribution of viral diseases in pepper by cultivation types. Research in Plant Disease. 10(4):231-240. (In Korean)
[https://doi.org/10.5423/RPD.2004.10.4.231]

-
Kang DH, Lee Y, Kim SE, Moon HH, Kim GH, et al., 2023. Susceptibility assessment of cotton aphid, Aphis gossypii (Hemiptera: Aphididae) field populations in Korea to 11 insecticides. Korean J. Pestic. Sci. 27(3) :259-271. (In Korean)
[https://doi.org/10.7585/kjps.2023.27.3.259]

-
Kim JH, Byeon YW, Choi MY, Ji CW, Heo SY, et al., 2012a. Control efficacy of natural enemies on four arthropod pests found in greenhouse red pepper. Korean J. Appl. Entomol. 51(2):83-90. (In Korean)
[https://doi.org/10.5656/KSAE.2012.02.1.73]

- Kim JS, Kim SK, Choi GS, Lee MW, 1990. Virus disease incidence and symptom appearance in red pepper. Korean J. Plant Pathol. 6: 125-132. (In Korean)
-
Kim JS, Lee SH, Choi HS, Kim MK, Kwak HR, et al., 2012b. 2007-2011 characteristics of plant virus infections on crop samples submitted from agricultural places. Res. Plant Dis. 18: 277-289. (In Korean)
[https://doi.org/10.5423/RPD.2012.18.4.277]

- Kim SH, Kim IS, Lee SY, Lee MH, 1986. Colonizing aphid species and their seasonal fluctuations in some vegetable crops. Korean J. Plant. Prot. 25(3):129-132. (In Korean)
-
Ko S J, K ang BR, Choi DS, K im D I, L ee GS, et a l., 2013. Pattern of the occurrence of tomato spotted wilt virus in Jeonnam Province. Res. Plant Dis. 19(4):273-280. (In Korean)
[https://doi.org/10.5423/RPD.2013.19.4.273]

-
Koo HN, An JJ, Park SE, Kim JI, Kim GH, 2014. Regional suscepti bilities to 12 insecticides of melon and cotton aphid, Aphis gossypii (Hemiptera: Aphididae) and a point mutation associated with imidacloprid resistance. Crop Prot. 55:91-96.
[https://doi.org/10.1016/j.cropro.2013.09.010]

- Korean National Statistical Office (KOSTAT). 2024. Survey of red pepper and rice cultivation area in 2023. https://kostat.go.kr/board.es?mid=a10301010000&bid=229&list_no=426787&act=view&mainXml=Y, . (Accessed Apr. 10. 2024). (In Korean)
- Korean Statistical Information Service (KOSIS). 2015. Current state of cultivation area of major pepper production areas. https://kosis.kr/statHtml/statHtml.do?orgId=101&tblId=DT_1ET0069&vw_cd=MT_ZTITLE&list_id=K1_15&seqNo=&lang_mode=ko&language=kor&obj_var_id=&itm_id=&conn_path=MT_ZTITLE, . (Accessed Apr. 10. 2024). (In Korean)
- Korean Statistical Information Service (KOSIS). 2024. Current state of cultivation area of open field vegetables. https://kosis.kr/statHtml/statHtml.do?orgId=101&tblId=DT_1ET0069&vw_cd=MT_ZTITLE&list_id=K1_15&seqNo=&lang_%20%20%20%20%20%20%20mode=ko&language=kor&obj_var_id=&itm_id=&conn_path=MT_%20%20%20%20%20ZTITLE, . (Accessed Apr. 10. 2024). (In Korean)
-
Kwak HR, Kim MK, Nam M, Kim JS, Choi HS, et al., 2013. Genetic compositions of Broad bean wilt virus 2 infecting red pepper in Korea. Plant Pathol. J. 29:274-284.
[https://doi.org/10.5423/PPJ.OA.12.2012.0190]

-
Kwon OH, Lee JH, Jang GS, Kim DJ, Kim CY, et al., 2017. Incidence of viral diseases on red pepper in Yeongyang-gun, Gyeongbuk province. Res. Plant Dis. 23(3):234-240. (In Korean)
[https://doi.org/10.5423/RPD.2017.23.3.234]

- Nauen R, Thielert W. 2008. Biological profile of spirotetramat (Movento) a new two way systemic (amimobile) insecticide against sucking pests. Bayer CropScience Journal. 61:245-278.
-
Miranda MP, Scapin MS, Vizoni MC, Zanardi OZ, Volpe HXL, et al., 2021. Spray volumes and frequencies of insecticide applications for suppressing Diaphorina citri populations in orchards. Crop Prot. 140:105406.
[https://doi.org/10.1016/j.cropro.2020.105406]

- Moon HC, Cho IK, Im JR, Goh BR, Kim DH, et al., 2006. Seasonal occurrence and damage by thrips on open red pepper in Jeonbuk province. Korean J. Appl. Entomol. 45(1):9-13. (In Korean)
- Rural Development Administration (RDA), 2022. Myzus persicae and Aphis gossypii. https://www.nongsaro.go.kr/portal/ps/pss/pssa/insectSearchDtl.ps?menuId=PS00403&spcsCode=ZM1AJ0096, . (In Korean)
- Rural Development Administration (RDA), 2024. Pesticide searching. https://psis.rda.go.kr/psis/agc/res/agchmRegistStusLst.ps?menuId=PS00263, . (Accessed Apr. 10. 2024). (In Korean)
-
Selby TP, Lahm GP, Stevenson TM, Hughes KA, Cordova D, et al., 2013. Discovery of cyantraniliprole, a potent and selective anthranilic diamide ryanodine receptor activator with cross-spectrum insecticidal activity. Bioorg. Med. Chem. Lett. 3:6341–6345.
[https://doi.org/10.1016/j.bmcl.2013.09.076]

-
Seo MH, Lee SC, Yang CY, Yoon JB, Park J, 2018. Monitoring occurrence status of thrips populations on field-cultivated pepper at major cultivated region in west coast, Korea. Korean J. Environ. Biol. 36(4):544-549. (In Korean)
[https://doi.org/10.11626/KJEB.2018.36.4.544]

-
Sparks T, Nauen, R, 2015 IRAC : Mode of action classification and insecticide resistance management. Pestic. Biochem. Physiol. 121: 122-128.
[https://doi.org/10.1016/j.pestbp.2014.11.014]

- Tomlin CDS, 2009. The pesticide manual; A world compendium. BCPC, Hampshire. UK.
-
Toor RF, Foster SP, Anstead JA, Mitchinson SM, Kasprowicz L, et al., 2008. Insecticide resistance and genetic composition of Myzus persicae (Hemiptera: Aphididae) on field potatoes in New Zealand. Crop Prot. 27(2):236-247.
[https://doi.org/10.1016/j.cropro.2007.05.015]

-
Wang KY, Guo QL, Xia XM, Wang HY, Liu TX, 2007. Resistance of Aphis gossypii (Homoptera: Aphididae) to selected insecticides on cotton from five cotton production regions in Shandong, China J. Pest. Sci. 32(4):372.
[https://doi.org/10.1584/jpestics.G06-51]

Dae-hong Lee, Gyeongsangbukdo Agricultural Research and Extension Services, Ph.D., https://orcid.org/0000-0002-9749-3432, Research design, Investigation, Data analysis, Writing original draft preparation
Oh-hun Kwon, Gyeongsangbukdo Agricultural Research and Extension Services, Master, Investigation, Data analysis Min-ji Kwon, Gyeongsangbukdo Agricultural Research and Extension Services, Master, Data analysis
Seong-im Park, Gyeongsangbukdo Agricultural Research and Extension Services, PhD., Data analysis
Hyun-suk Cho, Gyeongsangbukdo Agricultural Research and Extension Services, PhD., Data analysis
Kil-su Jang, Gyeongsangbukdo Agricultural Research and Extension Services, Master, Data analysis
Sang-seok Lee, Gyeongsangbukdo Agricultural Research and Extension Services, Ph.D., https://orcid.org/0000-0002-8804-6745, Writing- review and Editing