대량한천희석법을 이용한 감귤검은점무늬병균에 대한 살균제 저항성 모니터링
초록
Benomyl, fluazinam, kresoxim-methyl, prochloraz manganese에 대한 감귤검은점무늬병균인 Diaporthe citri의 저항성 검정을 실시하였다. 제주도 지역의 감귤원에서 278개의 균주를 분리하여 대량 한천희석법으로 각 살균제의 균사생장 억제효과를 조사하였으며, 억제율이 5 0% 이하인 균주를 저항성으로 판정하였다. 실험에 사용한 278개 균주 중에서 kresoxim-methyl에 대해서 54개인 균주가 50% 이하의 균사생장 억제율을 보여 저항성 균주로 판정하였는데, 이는 전체 균주에 대해서 19.4%가 저항성 균주임을 보여주었다. 제주도의 서로 다른 지역인 제주시와 서귀포시를 비교하여 보면, 제주시에서는 저항성균의 분리율이 5.6%와 26.1%로 서귀포시의 저항성균 분리 비율이 높게 나타났다. 하지만 대량 한천희석법에서 benomyl, fluazinam, prochloraz manganese에 대한 저항성 균주는 확인되지 않았다. 이런 결과는 포장에서의 방제용 살균제 선발과 저항성 관리에 중요한 정보를 제공하리라고 생각한다.
Abstract
In the present study, fungicidal resistance of Diaporthe citri, the causative agent of citrus melanoses, against benomyl, fluazinam, kresoxim-methyl, and prochloraz manganese was studied. Total 278 isolates of D. citri were obtained from dieback twigs collected from orchards located on Jeju-do. The efficacy of each fungicide against the mycelial growth of D. citri was assessed using the mass agar dilution method. The isolates with of 50% or less inhibition rate were classified as resistant to the fungicides. Among the 278 isolates tested, 54 isolates, i.e. 19.4% of the isolates, exhibited a mycelial growth inhibition rate of 50% or less toward kresoxim-methyl. On the other hand, the resistance rates against kresoxim-methyl of the D. citri obtained from Jeju-si and Seogwipo-si were 5.6% and 26.1%, respectively, indicating that the resistance rate was higher in Seogwipo-si than in Jeju-si. By contrast, no isolates could be identified using the mass agar dilution method which are resistant to benomyl, fluazinam, or prochloraz manganese. These findings provide valuable information which will be helpful during the selection of fungicides to manage citrus melanoses and for implementing resistance management strategies in the field.
Keywords:
Citrus melanose, Diaporthe citri, Fungicidal resistance, Kresoxim-methyl키워드:
감귤 검은점무늬병, 살균제 저항성서 론
감귤에 발생하는 병해는 세계적으로 90종 이상이 보고되고 있으며, 우리나라 감귤에는 바이러스병을 포함하여 35종 이상의 병이 발생하는 것으로 보고되고 있다(Korean Society of Plant Pathology, 2024). 이들 중 방제에 문제가 되는 병해는 검은점무늬병, 더뎅이병, 궤양병으로 알려져 있는데, 이 중에서도 검은점무늬병의 방제가 가장 중요하다(Kwon et al., 2003). 감귤검은점무늬병균은 자낭균의 일종으로 잎, 가지, 과실 등에 발생하여 피해를 주지만 가장 문제가 되는 것은 과실에 대한 피해이다. 특히 과실 생육기인 6월부터 8월에 걸쳐 강우가 많은 시기에 발생량이 많고, 감염이 된 과실은 상품성이 저하되어 농가 소득에 큰 영향을 미친다. 제주도에서 감귤 검은점무늬병은 7 0년대 후반까지는 방제의 중요성이 높지 않았으나, 80년대에 들어서면서부터 재배면적의 증가와 나무의 성목화, 밀식화 등이 이루어지면서 현재는 방제에 대한 중요도가 높아진 병해 중에 하나이다. 감귤 검은점무늬병에 의한 발병과율을 2003년부터 10년간 조사한 결과, 2005년에 3.8%로 가장 낮았고 2010년에 16.8%로 가장 심하였으며, 10년간 평균 발병과율은 8.8%이었다(Hyun et al., 2013). 감귤 검은점무늬병은 마른 가지에 형성된 분생포자가 빗방울에 섞여 잎, 가지, 과실 등에 전파, 감염되는 것으로 알려져 있다. 마른 가지는 수령이 오래된 감귤원에서 많이 관찰되며, 6~8월에 많이 발생하고, 특히 7월에 가장 많이 발생하는데, 마른 가지에서 약 1 mm 크기의 분생포자각이 관찰된다. 마른 가지와 분생포자각의 형성, 분생포자의 비산 시기는 비슷한 양상으로 진전되고, 그 해의 병 발생은 6, 7월의 포자 비산량과 밀접한 관련이 있으므로, 6, 7월에 적절한 방제용 약제를 처리하는 것이 중요하다(Hur and Park, 2005). 감귤 검은점무늬병 방제용 살균제로는 퀴논계, 카복사마이드계, 트리아졸계, 유기유황계, 디티오카바메이트계, 디니트로아니린계, 벤지미다졸계, 스트로빌루린계 등 다양한 작용 기작을 가진 살균제들이 등록되어 있다(Rural Development Administration, 2024), 실제 감귤원에서는 5월 상순에 트리아졸계와 디니트로아니린계 및 보르도액, 5월 중순에 스트로빌루린계를 사용하고 있었으며, 5월 하순이나 6월 상순부터 12~16일 간격으로 유기유황계 살균제로 5~6회 정도 사용하고 있다(미발표). 감귤 검은점무늬병에 대해서 보다 효과적인 방제 전략을 수립하기 위해서는 방제용 살균제의 각 지역별 저항성 발현 여부를 조사하는 것이 필요하다. 따라서 본 연구는 감귤검은점무늬병균을 제주도의 지역별로 분리하고 작용 기작이 다른 4종의 살균제에 대한 감수성 정도를 대량 한천희석법으로 조사하였다.
재료 및 방법
병든 가지의 채집 및 병원균의 분리
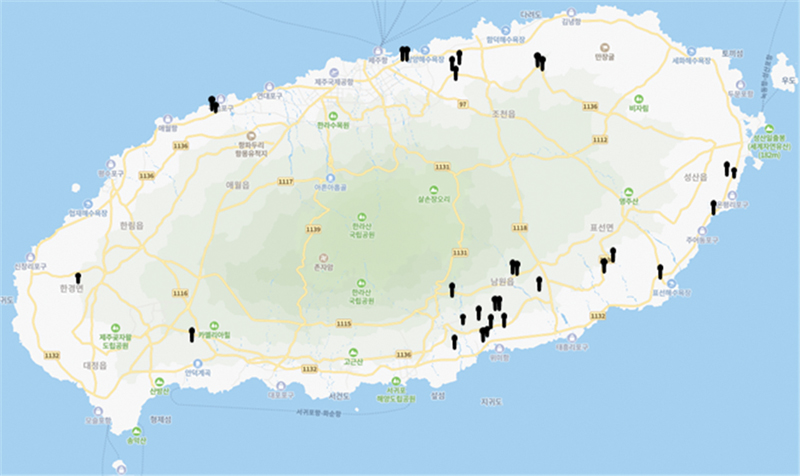
감귤 농가에서 겨울전정을 시작하기 전인 2024년 1월 29일부터 1월 31일까지 3일간 감귤 주 재배 지역인 제주시와 서귀포시를 중심으로 병든 가지를 채집하였다. 제주시의 9개 농가, 그리고 서귀포시의 21개 농가의 감귤원에서 직경 0.3~1.0 cm 정도의 병든 마른 가지를 채집하였다(Fig. 1).
채집한 가지는 각 농가 별로 폴리백에 담아 4oC 냉장고에 보관하면서, 병원균인 Diaporthe citri를 분리하여 실험에 사용하였다. 보관된 감귤 가지는 건전 부위와 발병 부위를 함께 3 mm × 3 mm 크기로 잘라 2%의 차아염소산나트륨 용액에 30초간 1회 침지하고, 70% ethanol 용액에서 30초간 2회 표면소독하였다. 소독한 조직은 살균 증류수에서 30초간 3회 세척하고, 물한천(WA; water agar, Junsei) 배지에 치상하여 25oC 배양기에서 3~5일간 배양하였다. 조직에서 생장한 병원균의 단균사를 떼어내어 PDA (Potato Dextrose Agar, DifcoTM) 배지에 이식하고 25oC의 배양기에서 7일간 배양하였다. 병원균은 특징적인 균총 모양과 α와 β의 분생포자를 확인하여 동정하고 실험에 사용하였다. 병원균은 각 농가 포장 당 5~10개의 균주를 분리하였다. 분리한 병원균은 PDA 사면 배지에 이식하여 25oC에서 5일간 배양한 후, 4oC에서 보관하며 실험에 사용하였다.
실험에 사용한 살균제
감귤검은점무늬병균에 대한 살균제 저항성 발현 여부를 조사하기 위하여, 방제용으로 등록된 살균제 중에서 균사 생장을 억제하는 것으로 알려진 benomyl, fluazinam, kresoxim-methyl, prochloraz manganese를 각각 선발하여 실험하였다(Table 1).
대량 한천희석법을 이용한 살균제의 균사생장 억제효과 조사
선발된 4종 살균제의 균사생장 억제효과는 한천희석법을 개선한 대량한천희석법을 사용하여 조사하였다. 실험에 사용한 benomyl, fluazinam, kresoxim-methyl, prochloraz manganese를 멸균 증류수를 사용하여 희석한 다음, PDA 배지에서 최종농도가 각각 3.0, 1.0, 30.0, 20.0 μg/mL가 되도록 첨가하였다. 대량한천희석법의 농도는 각 지역 대표 균주를 사용하여 실험한 한천희석법의 결과를 바탕으로, 균주에 대한 억제효과가 7 0% 이상이 되는 농도를 설정하였다. 다만, kresoxim-methyl의 경우는 50% 이상이 되는 농도로 조정하였다(Soe et al., 2023). 접종원으로는 25oC의 PDA 배지에서 5일간 배양한 병원균의 균총의 선단에서 직경 3mm의 균사 조각을 떼어내어 사용하였다. 병원균의 균사 조각을 균사면이 PDA 배지에 닿을 수 있도록 뒤집어서 접종하고, 25oC에서 5일간 배양한 후, 균총의 직경을 측정하였다. 살균제의 균사생장 억제효과는 아래의 식과 같이 살균제가 첨가되지 않는 배지에서의 균총의 직경과 비교하여 균사생장 억제율(%)을 계산하였다.
실험에는 직경 15 cm의 페트리 접시를 사용하였으며, 한개의 페트리 접시에 11개의 균주를 동시에 접종하였다. 살균제를 첨가하지 않은 PDA 배지의 동일한 위치에 동일한 병원균을 접종하여 대조 균주로 사용하였다. 모든 실험은 3반복으로 실시하였다. 실험에 사용한 4종 살균제에 대한 병원균의 균사생장 억제율이 50% 이하인 균주를 해당 살균제에 대한 저항성 균주로 정하고 지역간의 저항성균 발생 정도를 계산하였다.
결과 및 고찰
병원균의 분리
감귤검은점무늬병균은 살아 있는 잎이나 과실을 침입한 후, 기주식물체 내에서 죽고 죽은 가지에서 만든 분생포자각에서 분생포자를 형성하여 전염원이 된다(Whiteside, 2000). 잎, 가지 및 과실 등을 침입하고 병징을 형성한 후, 조직 내부에서 죽기 때문에, 오래된 병반에서 병원균을 분리하는 것은 매우 어렵다(Hyun et al., 2013; Whiteside, 2000). 그러므로 본 시험에서는 잎이나 과실의 병반으로부터 병원균을 분리하지 않고, 겨울철에 마른 가지를 채집하여 병원균을 분리하였다. 제주시와 서귀포시의 감귤원에서 병든 마른가지를 채집하여 각각 90개의 균주와 188개의 균주를 분리하였다. 분리한 모든 균주는 배지에서 형성하는 α와 β 포자를 확인한 후, 실험에 사용하였다(Table 2).
살균제에 대한 병원균의 감수성
본 실험에서는 병원균 포자의 발아를 저해하여 병 발생을 억제하는 카군 살균제는 제외하였다. 왜냐하면 한천희석법은 병원균의 포자발아보다 균사생장 억제효과를 검정하는 방법으로, 카군 살균제의 효과를 정확하게 판단할 수 있는 검정 방법이 아니다(Lee et al., 2019; Park and Kim, 2023). 따라서 카군 살균제를 선정하여 검정할 경우 효과가 낮아 저항성 균이 출현한 것으로 오판할 가능성이 있고, 현재까지 카군 살균제에 대한 저항성 발생 보고는 거의 없기 때문에 본 실험에서 제외하였다. 대량 한천희석법으로 실험한 benomyl, fluazinam, prochloraz manganese는 처리한 3.0, 1.0, 20.0 μg/mL에서 대부분의 균주가 전혀 생육하지 못하여 모두 감수성으로 판정하였다(Fig. 2).
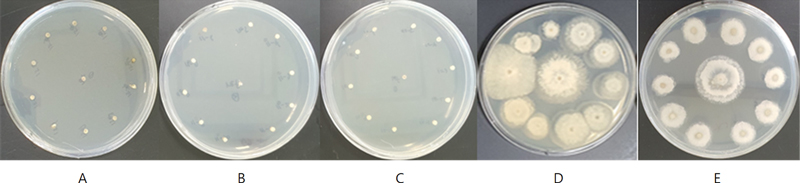
A Mass agar dilution method performed to investigate the mycelial growth inhibition effect of fungicides on Diaporthe citri. Four fungicides used in this study were benomyl (A), fluazinam (B), prochloraz-manganese (C) and kresoxim-methyl (D). In the Mass agar dilution method, D. citri 2NEL3-2 was used as a reference isolate. The final concentrations of each fungicide in the PDA medium were adjusted to 3.0 μg/mL of benomyl, 1.0 μg/mL of fluazinam, 30.0 μg/mL of prochloraz-manganese and 20.0 μg/mL of kresoxim-methyl, and isolates with less than 50% fungicide mycelial growth inhibition effect were classified as resistant ones. In this Figure, E was PDA medium without no fungicides as a untreated control.
Kresoxim-methyl에 대한 균사생장 억제율은 Fig. 3에서와 같이 균사생장 억제율 100%인 균주가 219개, 40% 이하인 균주가 54개로 나누어져 나타나서, 균사생장 억제율이 50%이하인 균주를 저항성 균주, 50% 이상인 균주를 감수성 균주로 구분할 수 있었다. 이 기준에 의하여 약제 간 저항성 균주의 출현 비율은 benomyl, fluazinam, kresoxim-methyl, prochloraz manganese에서 각각 0, 0, 19.4, 0%로 kresoxim-methyl에서만 저항성 균주가 분리되었다(Fig. 4).
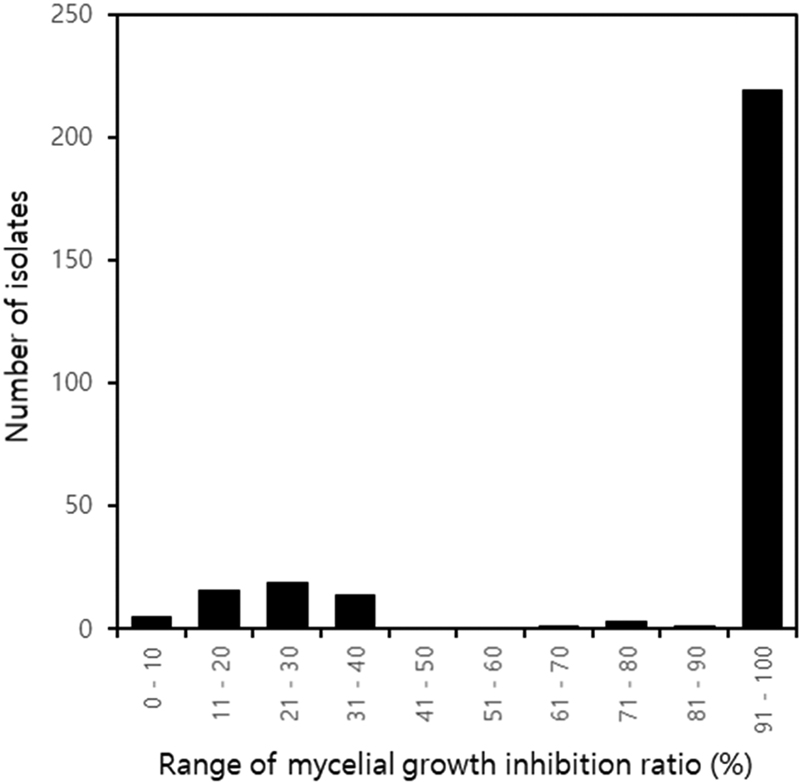
Number of Diaporthe citri isolates according to mycelial growth inhibition ratio range. A total of 278 isolates were used in the experiment. Mycelial growth inhibition rate was tested by the mass agar dilution method. The mycelial growth inhibition rate of each isolate used in the experiment against kresoxim-methyl was calculated by comparing the colony diameter on the PDA medium without the fungicide with that on the PDA medium treated with 30.0 μg/mL of kresoxim-methyl.
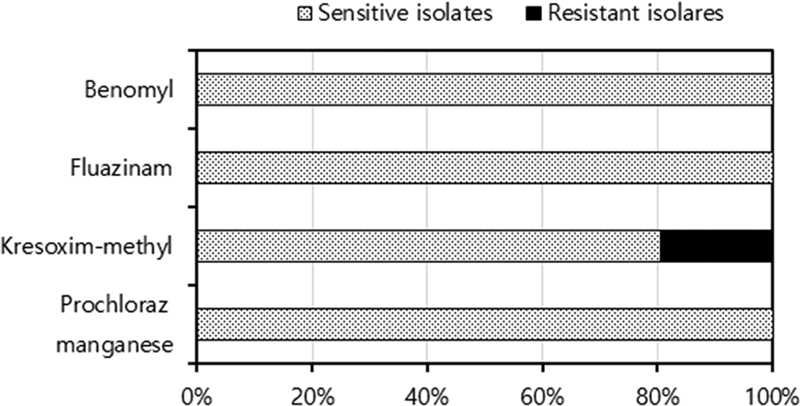
Ratio (%) of Diaporthe citri isolates sensitive and resistant to four fungicides as benomyl, fluazinam, kresoxim-methyl and prochloraz manganese. Inhibition ratio of mycelial growth of Diaporthe citri was conducted through the mass agar dilution method to each fungicide, as benomyl, fluazinam, kresoxim-methyl and prochloraz manganese, of which the concentrations were 3.0, 1.0, 30.0, 20.0 μg/mL in PDA medium, respectively. isolates with a mycelial growth inhibition rate of 50% or less at the tested concentration of each fungicide were considered resistant isolates.
Benomyl은 벤지미다졸 계통으로 침투이행성이 있으며, 식물병원진균의 β-tubulin 단백질에 결합하여 미세소관 형성을 저해함으로써 병원균의 세포분열을 억제하는 살균제로 알려져 있다(Park et al., 1997). 벤지미다졸계 살균제는 오랜 기간 동안 다양한 식물병원성 곰팡이의 방제에 사용하다보니 Botrytis cinerea, Monilinia fructicola, Penicillium expansum, Venturia inaequalis, Sclerotinia sclerotiorum, Fusarium species 등에서 약제 저항성균이 출현하고, 그로인하여 방제 효과가 감소되었다(Gossen et al., 2001; Kim et al., 2007; Koenraadt et al., 1992; Moorman and Lease, 1992; Rogenberger et al., 1991; Ryu et al., 2024). 하지만 Fig. 4에서 보는 것과 같이 benomyl에 저항성인 감귤검은점무늬병균은 분리되지 않았다. 실제 감귤원에서는 벤지미다 졸계 살균제를 1년에 1회 정도 사용하거나, 전혀 사용하지 않는 농가도 있어서 감귤원에서의 저항성 발현이 되지 않았다고 생각한다. 하지만 벤지미다졸계 살균제는 저항성 발현이 쉬운 약제이며, 다양한 기주식물의 여러 가지 병원균의 방제를 위해서도 사용하고 있기 때문에 지속적인 모니터링이 필요할 것으로 생각한다. Fluazinam은 디니트로아닐린계 살균제로 병원균의 산화적 인산화 반응을 저해하여 ATP 생성을 억제함으로써 병 방제를 하는 광범위 살균제로 사용되고 있다. Phytophtora infestans, Sclerotinia sclerotiorum, Ustilago maydis 등에서 아직까지 저항성 발현이 되지 않았고, ATP 합성 효소에 작용하는 약제의 특성으로 저항성 발현이 쉽지 않은 약제로 알려져 있다(Mao et al., 2018; Schepers et al., 2018; Vitoratos 2014). 본 실험에서도 분리한 2 7 8개 균주 중 fluazinam에 저항성을 발현하는 균주는 분리되지 않았다. Kresoxim-methyl은 광범위한 적용 범위를 가지고 있는, 다3군에 속하는 Strobilurin계 살균제이다. 병원균의 세포 호흡 과정에서 미토콘드리아의 cytochrome b와 cytochrome c1 사이의 환원효소를 저해함으로써 미토콘드리아에서 결국 ATP 생성을 억제하여, 식물병을 방제한다(Sauter et al., 1999; Ypema and Gold, 1999). Strobilurin계 살균제의 저항성 기작은 살균제의 작용점 유전자인 cyt b유전자에서 발생하는 점돌연변이가 원인으로 알려져 있는데, 주로 143번째의 아미노산이 glycine에서 alanine으로 치환되면서 살균제에 대한 병원균의 감수성이 저하되어 병 방제효과가 감소한다(Baumler et al., 2003; Ishii et al., 2001; Kim et al., 2003; Ma and Michailides, 2003; Sierotzki et al., 2000). 다양한 식물병원균에서 저항성 균이 출현한 것처럼 본 실험에서도 278개의 D. citri 균주에서 저항성을 나타내는 균주가 54개가 분리되어, 저항성 균주의 비율이 19.4%로 나타났다. 하지만 Soe et al. (2024)은 저항성균의 cyt b유전자에서 점돌연변이가 없다고 보고하였다. 살균제 저항성의 기작은 점돌연변이 이외에 작용점 유전자의 과발현, 세포 외부로의 방출 등이 알려져 있다(Yin et al., 2023). 따라서 감귤검은점무늬병균의 kresoxim-methyl에 대한 저항성 기작의 구명을 위해서 계속적인 연구가 필요할 것으로 생각한다. Prochloraz manganese는 병원균의 sterol 생합성 과정에서 C14-demethylase의 활성을 억제함으로써 균사 생장을 억제하는 넓은 적용 기주 범위를 갖는 살균제이다. 다양한 작물의 병 방제에 오랜 기간 동안 사용하면서, 살균제에 대한 병원균의 감수성이 저하되거나, 저항성균의 계속적으로 출현이 보고되어 왔다(Frenkel et al., 2015; Karaoglanidisa et al., 2000; Schepers, 1985). 하지만 실제 포장에서 저항성 병원균이 출현하여 벤지미다졸계나 페닐아마이드 살균제처럼 방제에 크게 실패한 예는 찾아보기 어렵다. 본 시험에서도 prochoraz manganese에 저항성인 균주는 분리되지 않았다. 그러나 이 약제에서도 지속적으로 저항성이 보고되고 있으므로 저항성 발현에 관한 지속적인 모니터링이 필요할 것으로 생각한다.
지역에 따른 kresoxim-methyl 저항성 균의 분포
감귤검은점무늬병균의 저항성 발현 정도를 지역 별로 분석한 결과, 제주시에서는 9개 감귤원 중에서 1개 감귤원에서, 서귀포시에는 21개 감귤원 중에서 6개에서 저항성균이 분리되어 11.1%와 28.6%의 감귤원에서 저항성 균주가 분리되었다. Kresoxim-methyl 저항성 균주가 분리된 1개의 제주시 감귤원에서는 10개 균주 중 5개가 저항성 균주로 판명되었고, 서귀포시의 6개 감귤원에서는 각 농가당 분리된 10개의 균주 중 kresoxim-methyl 저항성으로 판명된 균주가 5개, 7개, 8개, 9개가 분리된 감귤원이 각각 1농가, 10개 모두가 저항성으로 분리된 감귤원이 2농가로 나타나, kresoxim-methyl 저항성 균주는 제주시에서 5.6%, 서귀포시에는 26.1%로 서귀포시에서 상대적으로 높은 저항성 균주가 분리되었다(Fig. 5).
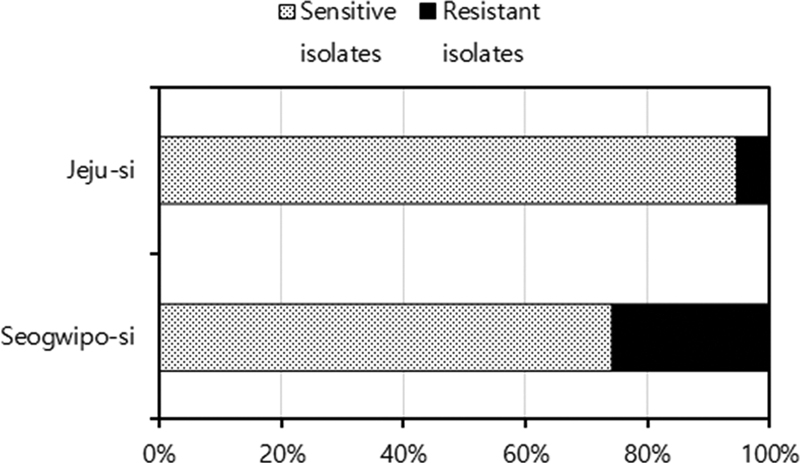
Ratio (%) of Diaporthe citri isolates sensitive and resistant to kresoxim-methyl, according to the location where the diseased and dry twigs were collected.
고추탄저병균의 경우 동일한 strobilurin계에 속하는 pyraclostrobin에 대한 저항성균의 비율이 25%가 될 때, 방제 효과가 50% 미만으로 감소하기 때문에, 서귀포시 부근의 감귤원에서는 병 방제를 위한 살균제 선정 시에 주의가 필요할 것으로 본다(Park, 2022). 또한 Strobilurin계 살균제 저항성균이 감수성균보다 포장 적응력이 우수하기 때문에(Kim et al., 2019), strobilurin 살균제의 효과적인 사용과 저항성 관리를 위해서는 지속적인 모니터링이 필요하다고 본다. 실제 제주도의 감귤 농가에서는 검은점무늬병을 방제하기 위해서 보호 살균제인 mancozeb를 연용하는 것으로 알려져 있다. 이런 상황에서 strobilurin계에 속하는 kresoxim-methyl에 대한 저항성균의 발현은 일반적이지 않을 수 있다. Kresoxim-methyl이 검은점무늬병균에 등록되어 있지 않은 살균제이지만, 매우 다양한 작물의 여러 가지 병의 방제에 등록되어 사용하고 있기 때문에, 검은점무늬병균의 살균제 반응에 영향을 미쳤을 것은 충분히 생각할 수 있는 상황이다. 따라서 포장에서의 계속적인 모니터링이 지속되어야 하며, 이런 결과는 방제를 위한 살균제의 선발과 저항성 관리에 유용한 정보를 제공할 수 있을 것으로 생각한다.
Acknowledgments
본 연구는 농촌진흥청 공동연구사업(과제번호: RS-2022-RD010350)의 지원에 의하여 수행되었습니다.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
-
Baumler S, Felsenstein FG, Schwarz G, 2003. CAPS and DHPLC analysis of a single nucleotide polymorphism in the cyt b gene conferring resistance to strobilurin in field isolates of Blumeria graminis f. sp. hordei. J. Phytopathol. 151(3):149-152.
[https://doi.org/10.1046/j.1439-0434.2003.00699.x]

-
Frenkel O, Cadle-Davidson L, Wilcox WF, Milgroom MG, 2015. Mechanisms of resistance to an azole fungicide in the grapevine powdery mildew fungus, Erysiphe necator. Phytopathology 105(3):370-377.
[https://doi.org/10.1094/PHYTO-07-14-0202-R]

-
Gossen BD, Rimmer SR, Holley, JD, 2001. First report of resistance to benomyl fungicide in Sclerotinia sclerotiorum. Plant Dis. 85(11):1206.
[https://doi.org/10.1094/PDIS.2001.85.11.1206C]

-
Hur KH, Park SK, 2005. Sporulation and dissemination of pycnidiospores of Diaporthe citri in Yuzu tree (Cutrus junos Sieb) in Jeonnam Area. Res. Plant Dis. 11(1):16-20.
[https://doi.org/10.5423/RPD.2005.11.1.016]

-
Hyun JW, Yi PH, Hwang RY, Moon KH, 2013. Aspect of incidence of the major citrus diseases recently. Res. Plant Dis. 19(2):102-107. (In Korea)
[https://doi.org/10.5423/RPD.2013.19.2.102]

-
Ishii H, Fraaije BA, Sugiyama T, Noguchi K, Nishimura K, et al., 2001. Occurrence and molecular characterization of strobilurin resistance in cucumber powdery mildew and downy mildew. Phytopathology 91(12):1166-1171.
[https://doi.org/10.1094/PHYTO.2001.91.12.1166]

-
Karaoglanidisa GS, Ioannidisb PM, Thanassoulopoulos CC, 2000. Reduced sensitivity of Cercospora beticola isolates to sterol demethylation inhibiting fungicides. Plant Pathol. 49(5):567-572.
[https://doi.org/10.1046/j.1365-3059.2000.00488.x]

-
Kim S, Min J, Kim HT, 2019. Mycological characteristics and field fitness of Colletotrichum acutatum resistant to pyraclostrobin. Korean J. Pestic. Sci. 23(3):231-239. (In Korean)
[https://doi.org/10.7585/kjps.2019.23.3.231]

-
Kim JH, Min JY, Baek YS, Bae YS, Kim HT, 2007. Variation of the sensitivity of Botrytis cinerea causing ginseng grey mold to fungicides inhibiting β-tubulin assembly. Res. Plant Dis. 13(3):177-182. (In Korean)
[https://doi.org/10.5423/RPD.2007.13.3.177]

-
Kim YS, Dixon EW, Vincelli P, Farman ML, 2003. Field resistance to strobilurin (QoI) fungicides in Pyricularia grisea caused by mutations in the mitochondrial cyt b gene. Phytopathology 93(7):891-900.
[https://doi.org/10.1094/PHYTO.2003.93.7.891]

-
Koenraadt H, Somerville SC, Jones AL, 1992. Characterization of mutations in the beta-tubulin gene of benomyl-resistant field strains of Venturia inaequalis and other plant pathogenic fungi. Phytopathology. 82(11):1348-1354.
[https://doi.org/10.1094/Phyto-82-1348]

- Korean Society of Plant Pathology, 2024. https://genebank.rda.go.kr/plntDissInfoMain.do, (Accessed Dec. 01. 2024).
-
Kwon HM, Nam KW, Kim KS, Kim DH, Lee SC, et al., 2003. Characterization of the causal fungus of citrus melanose, Diaporthe citri isolated from blighted twigs of citrus in Jeju. Res. Plant Dis. 9(3):153-158. (In Korean)
[https://doi.org/10.5423/RPD.2003.9.3.153]

-
Lee KH, C hoi J, P ark S, K im HT, 2 019. Control effects of several fungicides on jujube anthracnose and fungicide resistance monitoring. Res. Plant Dis. 25(4):188-195. (In Korean)
[https://doi.org/10.5423/RPD.2019.25.4.188]

-
Ma Z, Felts D, Michailides TJ, 2003. Resistance to azoxystrobin in Alternaria isolates from pistachio in California. Pestic. Biochem. Physiol. 77(2):66-74.
[https://doi.org/10.1016/j.pestbp.2003.08.002]

-
Mao XW, Li JS, Chen YL, Song XS, Duan YB, et al., 2018. Resistance risk assessment for fluazinam in Sclerotinia sclerotiorum. Pestic Biochem Physiol. 144:27-35.
[https://doi.org/10.1016/j.pestbp.2017.10.010]

-
Moorman GW, Lease RJ, 1992. Benzimidazole and dicarboximide-resistant Botrytis cinerea from Pennsylvania greenhouses. Plant. Dis. 76(5):477-480.
[https://doi.org/10.1094/PD-76-0477]

- Park S, 2022. Characteristics of several fungicides against Colletotrichum acutatum resistant to pyraclostrobin and establishment of a fungicide spraying system for pepper anthracnose. MS Diss. Chungbuk National Univ., Cheongju, Chungbuk, Korea.
-
Park S, Kim HT, 2023. Evaluation of acitivity of QoI fungicide against Colletotrichum acutatum s. lat. causing pepper anthracnose using resazurin-based respiration assay. Res. Plant Dis. 29(1):11-22. (In Korean)
[https://doi.org/10.5423/RPD.2023.29.1.11]

-
Park SY, Jung OJ, Chung YR, Lee CW, 1997. Isolation and characterization of a benomyl-resistant form of β-tubulinen-coding gene from the phytopathogenic fungus Botryotinia fuckeliana. Mol. Cells 7(1):104-109.
[https://doi.org/10.1016/S1016-8478(23)13269-9]

-
Rogenberger DA, Wicklow DT, Korjagin VA, Rondinaro SM, 1991. Pathogenicity and benzimidazole resistance in Penicillium species recovered from flotation tanks in apple packinghouses. Plant. Dis. 75(7):712-715.
[https://doi.org/10.1094/PD-75-0712]

- Rural Development Administration, 2024. Pesticide Safety Information System. https://psis.rda.go.kr/psis/agc/res/agchmRegistStusLst.ps?menuId=PS00263, (Accessed Des. 01. 2024).
-
Ryu H, Lee JG, Kang EH, Hong SK, Cho HW, 2024. Analysis of beta-tubulin gene mutation in benomyl-resistant Fusarium fujikuroi isolated from the paddy fields in Korea. Korean J. Pestic. Sci. 28(1):95-102. (In Korean)
[https://doi.org/10.7585/kjps.2024.28.1.95]

-
Sauter H, Steglich W, Anke T, 1999. Strobilurins: Evaluation of a new class of active substances. Angew. Chem. Int. Ed. 38(10):1328-1349.
[https://doi.org/10.1002/(SICI)1521-3773(19990517)38:10<1328::AID-ANIE1328>3.3.CO;2-T]

-
Schepers HTAM, 1985. Fitness of isolates of Sphaerotheca fuliginea resistant or sensitive to fungicides which inhibit ergosterol biosynthesis. Neth. J. Pl. Path. 91(2):65-76.
[https://doi.org/10.1007/BF01974302]

-
Schepers HTAM, Kessel GJT, Lucca F, Förch MG, van den Bosch GBM, et al., 2018. Reduced efficacy of fluazinam against Phytophthora infestans in the Netherlands. Eur. J. Plant Pathol. 151:947-960.
[https://doi.org/10.1007/s10658-018-1430-y]

-
Sierotzki H, Parisi S, Steinfeld U, Tenzer I, Poirey S, et al., 2000. Mode of resistance to respiration inhibitors at the cyt bc1 complex of Mycosphaerella fijiensis. Pest Manag. Sci. 56(10):833-841.
[https://doi.org/10.1002/1526-4998(200010)56:10<833::AID-PS200>3.3.CO;2-H]

-
Sierotzki H, Wullschleger J, Gisi U, 2000. Point mutation in cyt b gene conferring resistance to strobilurin fungicides in Erysiphe graminis f. sp. tritici field isolates. Pestic. Biochem. Physiol. 68(2):107-112.
[https://doi.org/10.1006/pest.2000.2506]

-
Soe ZZ, Shin YH, Kang HS, Jeun YC, 2023. Chemical resistance of Diaporthe citri against systemic fungicides on citrus. Plant Pathol. J. 39(4):351-360.
[https://doi.org/10.5423/PPJ.OA.05.2023.0069]

-
Vitoratos AG, 2014. Mode of action and genetic analysis of resistance to fluazinam in Ustilago maydis. J. Phytopathol. 162(11):737-746.
[https://doi.org/10.1111/jph.12254]

- Whiteside JO, 2000. pp. 28-29 Melanose. In: Timmer LW, Garnsey SM, Graham JH (Eds) Compendium of citrus Diseases. 2nd ed. The American Phytopathological Society, St. Paul, MN, USA.
-
Yin Y, Miao J, Shao W, Liu X, Zhao Y, et al., 2023. Fungicide resistance: progress in understanding mechanism, monitoring, and management. Phytopathology 113(4):707-718.
[https://doi.org/10.1094/PHYTO-10-22-0370-KD]

- Ypema HL, Gold RE, 1999. Kresoxim-methyl: Modification of a naturally occurring compound to produce a new fungicide. Plant Dis. 83(1):4-19.
Ho Cheol Shin, Analysis Technology and Tomorrow Co., Ltd., Researcher, https://orcid.org/0009-0001-0607-1964 Experimental participation and writing original paper
Jae Ho Kim, Analysis Technology and Tomorrow Co., Ltd., Researcher, https://orcid.org/0009-0009-9208-6430 Experimental participation
Ho Jung Jang, Analysis Technology and Tomorrow Co., Ltd., Researcher, https://orcid.org/0000-0001-5622-8627 Experimental participation
Gun Sik Lee, Analysis Technology and Tomorrow Co., Ltd., Researcher, https://orcid.org/0009-0001-1164-8262 Establishment of experimental plan and methodology proposal
Tae Hwa Kim, Analysis Technology and Tomorrow Co., Ltd., CEO, https://orcid.org/0000-0003-2223-9891 Establishment of experimental plan
Heung Tae Kim, Department of Plant Medicine, College of Agriculture, Life and Environment Science, Chungbuk National University, Professor, https://orcid.org/0000-0001-7132-0587 Analysis of data, writing original paper and editing