
국내 사과원에서 분리된 Botryosphaeria spp.의 Fluazinam 살균제에 대한 감수성 기준 설정
 ; Jun-Woo Choi1 ; Hae-Dam Ki1 ; Young Ju Nam2 ; Ha-Kyoung Lee3 ; Seung-Yeol Lee1, 4, *
; Jun-Woo Choi1 ; Hae-Dam Ki1 ; Young Ju Nam2 ; Ha-Kyoung Lee3 ; Seung-Yeol Lee1, 4, * ; Hee-Young Jung1, 4
; Hee-Young Jung1, 4
초록
사과 겹무늬썩음병의 원인균인 Botryosphaeria spp.를 대상으로 2005년부터 2024년까지 분리된 총 324개의 균주에 대해 fluazinam의 감수성 정도를 조사하였다. 확보한 균주는 다중유전자 계통분석을 통해 동정한 결과, Botryosphaeria sinensis가 우점하고 있으며, Botryosphaeria kuwatsukai가 함께 확인되었다. 한천희석법을 사용하여 병원균의 균사생장 억제효과를 조사한 결과, 전체 균주의 EC50 값은 0.07~0.59 μg/mL (average. 0.09 ± 0.04 μg/mL)로 나타났다. 경시적인 감수성 변화를 관찰하기 위해 2005년부터 2019년까지 분리된 균주와 2022년부터 2024년까지 분리된 균주를 그룹으로 나눠 EC50 값의 평균과 분포를 비교한 결과, 유의한 차이가 나타나지 않았다. 추가적으로, 병원균의 종 혹은 분리한 지역에 따라 집단을 나누어 비교한 결과 역시 유의한 감수성의 차이는 확인되지 않았다. EC50 값에서 차이를 보인 10개 균주를 사과 과실에 접종한 후 권장 농도의 fluazinam을 처리하였을 때, 두 집단의 방제 효과에서 통계적으로 유의한 차이는 나타나지 않았다. 이러한 결과로 미루어 볼 때, 국내 다양한 지역에서 분리한 Botryosphaeria spp. 균주는 모두 fluazinam에 대해 감수성인 것으로 판단된다. 본 연구를 통해 확인된 fluazinam에 대한 감수성 기준은 차 후 국내 사과겹무늬썩음병균의 감수성 검정 및 지속적인 저항성 모니터링에 활용될 것으로 생각된다.
Abstract
From 2005 to 2024, a total of 324 Botryosphaeria spp. isolates were collected from apple orchards in various regions to investigate their sensitivity to fluazinam. Phylogenetic analyses revealed that Botryosphaeria sinensis to be dominant, with the Botryosphaeria kuwatsukai also identified. The EC50 values were calculated based on the mycelial inhibition rate on fluazinam amended media, showing a range of 0.06 to 0.59 μg/mL, with an average of 0.09 μg/mL for all strains. When comparing the mean and distribution of EC50 values for strains isolated from 2005 to 2019 with those isolated from 2022 to 2024, significant differences were not found. Furthermore, no significant differences in sensitivity were observed when comparing groups based on pathogen species or region of isolation. Additionally, the inoculation results on the fluazinam-treated apple fruits also showed no statistical differences in control efficacy between less sensitive and sensitive isolates. Based on these findings, all strains of Botryosphaeria spp. isolated from various regions were found to be sensitive to fluazinam. The baseline sensitivity of Botryosphaeria spp. to fluazinam established in this study will serve as a reference for future sensitivity evaluation and regular resistance monitoring in Korea.
Keywords:
Botryosphaeria spp., Fluazinam, White rot disease키워드:
플루아지남, 사과 겹무늬썩음병서 론
Botryosphaeria spp.에 의해 발생하는 사과 겹무늬썩음병은 국내외 사과 생산량에 영향을 끼치는 주요 병해 중 하나이다(Jurick et al., 2013; Lee et al., 2023; Xu et al., 2015). 특히 국내의 경우 사과 겹무늬썩음병에 감수성인 후지 품종의 재배 면적이 1980년대 이후 증가하였고(Kim, 2002), 2024년 현재 후지 품종의 재배 면적이 약 62%로 많은 재배면적을 차지하고 있어(Statistics Korea, 2024), Botryosphaeria spp.에 의한 겹무늬썩음병의 중요성은 더욱 높아지고 있다. 겹무늬썩음병은 과실과 가지를 모두 감염하는 특성을 가지는데, 과실에서 나타나는 주요한 병징은 과점을 중심으로 갈색의 반점이 나타나고, 병반이 진전됨에 따라 윤문형의 움푹 들어간 병징을 보인다(Cheon and Jeon, 2015; Zhang et al., 2012). 또한, 가지나 줄기에 감염할 경우 궤양, 변색, 사마귀 등의 증상을 나타내며 심한 경우 나무 전체가 고사될 수 있다(Lee et al., 2023; Song et al., 2018). 전 세계적으로 겹무늬썩음병의 방제를 위해 살균제가 널리 사용되고 있으며(Fan et al., 2019; Wang et al., 2022), 국내에서도 사과겹무늬썩음병균에 대해 ‘나1’군, ‘다3’군, ‘다5’군, ‘사1’군 등에 속하는 살균제가 등록되어 있다(Rural Development Administration, 2024). 이 중 ‘다5’군에 속하는 fluazinam은 Botrytis cinerea, Sclerotinia sclerotiorum, Alternaria spp., Colletotrichum spp. 등의 광범위한 병원균에 강한 활성을 보이는 효과적인 살균제이다(Liu et al., 2019; Myung et al., 2024). 현재까지 fluazinam에 대한 저항성 위험은 낮으며, 현장에서 저항성 균주의 출현 역시 보고되지 않았다(FRAC, 2024; Liu et al., 2019). 하지만, 살균제의 지속적인 사용은 식물병원균의 저항성 발달 가능성을 높이고 살균제의 효과를 감소시키기 때문에, fluazinam에 대한 저항성 발달 위험은 여전히 존재한다(Corkley et al., 2022). 또한, Botryosphaeria spp.에 대한 fluazinam의 감수성 검정은 국외에서 2018년에 수행된 이래로 현재까지 추가적인 연구는 보고되지 않았으며(Song et al., 2018), 국내에서는 관련된 연구가 이루어지지 않은 상태이다. 이에 따라 살균제의 기준 감수성 설정을 통해 국내 사과 겹무늬썩음병에 대한 효과적인 저항성 관리 및 지속적인 모니터링이 이루어져야 한다(Russell, 2002). 따라서, 본 연구에서는 사과 겹무늬썩음병을 일으키는 Botryosphaeria spp.를 대상으로 fluazinam에 대한 감수성 검정을 실시하였다. 이를 위해 2005년부터 2024년까지 국내 다양한 지역에서 분리한 균주들을 사용하여 다중유전자 계통분석을 실시하고, 연도별 감수성 변화를 조사하였다. 또한 병원균의 종과 분리 지역에 따른 감수성 정도를 비교하였으며, 과실 접종 실험을 통해 식물체상에서 fluazinam의 방제 효과를 조사하였다.
재료 및 방법
사과겹무늬썩음병균의 확보 및 배양 조건
이전 연구에서 사용한 Botryosphaeria spp. 균주를 포함하여(Lim et al., 2024), 2024년 경기도, 강원도, 경상도 및 충청도 소재 사과원에서 분리된 총 94개의 Botryosphaeria균주를 글로벌농업컨설팅으로부터 분양받아 총 324균주에 대해 실험을 수행하였다. 확보한 균주는 새로운 potato dextrose agar (Difco, Detroit, MI, USA) 배지에 옮겨 25oC항온기에서 5일간 배양한 뒤 실험에 사용하였고, 장기간 보관을 위해 -80oC 초저온냉동고에 glycerol stock으로 보관하였다.
사과겹무늬썩음병균의 분자생물학적 동정
확보된 균주의 total genomic DNA 확보를 위해, 병원균을 25oC 암조건에서 7일간 배양한 뒤 HiGene Genomic DNA prep kit (BIOFACT, Daejeon, Korea)를 이용하여 gDNA를 추출하였고, 이후 ITS1F/ITS4, EF1-688F/EF1-1251R, Bt2a/Bt2b 프라이머를 사용하여 각각의 유전자를 증폭하였다(Alves et al., 2008; Gardes and Bruns, 1993; Glass and Donaldson, 1995; White et al., 1990). 증폭된 PCR 산물은 ExoSAP-ITTM (Thermo Fisher Scientific, Waltham, MA, OSA)를 이용하여 정제한 뒤, macrogen (Daejeon, Korea)에 의뢰하여 균주별 염기서열을 확보하였다. 확보된 염기서열은 NCBI (National Center for Biotechnology Information)의 Basic Local Alignment Search Tool (BLAST, https://blast.ncbi.nlm.nih.gov/Blast.cgi)에서 유사도를 확인한 후 동정하였다. 이후 근연종들과의 계통학적 유연관계를 비교하기 위해 MEGA 11.0 프로그램에서 neighbor joining 방법을 사용하여 계통수를 작성하였다(Tamura et al., 2021).
사과겹무늬썩음병균에 대한 fluazinam의 효과 검정
확보한 사과겹무늬썩음병균 균주들의 fluazinam (active ingredient 50% SC, 다5)의 균사생장 억제효과는 한천희석법으로 조사하였다. 각 균주는 PDA 배지에서 7일간 배양한 뒤, 균총 선단에서 직경 4 mm의 균사조각을 cork borer로 떼어내어, 농도별로 약제를 첨가한 PDA 배지에 접종하였다. Fluazinam SC의 유효성분 함량을 고려하여, 최종 농도가 0.01, 0.1, 1, 10, 100 μg/mL 되도록 살균제 희석 PDA 배지를 제작하였다. 접종한 배지를 6일간 25oC에 배양한 후 처리구의 균총의 직경을 측정하였고, 이때 무처리구 균총의 직경과 비교하여 살균제의 균사 생장 억제율(%)을 계산하였다. 모든 실험은 각 균주에 대해 3반복으로 진행하였다. 산출된 억제율을 바탕으로 EC50 (Half maximal effective concentration) 값을 구하기 위해, 로지스틱 회귀분석(logistic regression)을 GraphPad Prism® software (version 10.2.3; Dotmatics, La Jolla, CA, USA)에서 실시하였다(Pugliese et al., 2018). 계산된 EC50 값을 기반으로 전체 균주의 살균제에 대한 감수성 정도를 확인하고, 실험에 사용한 병원균을 분리 연도, 병원균 종 및 분리 지역에 따라 EC50 값의 평균과 분포를 비교하였다. 이때 각 집단의 균주 개수에 차이가 있는 것을 감안하여 EC50 값 구간별 분포 비율(%)을 비교하였다. 또한, 상대적으로 EC50 값이 높았던 5개 균주와 낮았던 5개 균주를 각각 약제 감수성이 낮은 집단과 높은 집단으로 선발하여 실험에 사용하였다.
과실에서 사과겹무늬썩음병균에 대한 fluazinam의 방제효과 검정
EC50 값 계산 결과를 기반으로 선발한 10개 균주를 사과과실에 접종 후 살균제를 처리하여 병 억제 효과를 비교하였다. 표면을 소독한 사과 과실에 cork borer를 이용하여 과실 표면에 직경 4 mm의 상처를 내고, 25oC 암조건에서 7일간 배양한 사과겹무늬썩음병균의 균사 선단에서 떼어 낸 동일한 크기의 균사디스크를 접종하였다. 이때 모든 실험은 각 균주에 대해 3반복으로 진행하였다. 이 후 fluazinam의 권장사용 농도(200 μg/mL)를 멸균증류수 500 mL에 희석한 뒤, 접종한 과실을 30초간 침지하였다. 처리된 과실은 30분간 건조한 뒤, 습실 처리를 위해 밀폐된 플라스틱 용기에 넣어 25oC 암조건에서 7일간 보관하였다. 무처리구의 경우 균사디스크를 접종한 뒤 살균제를 처리하지 않고 동일한 조건에서 보관하였다. 접종 7일차에 약제 처리구와 무처리구의 과실에 형성된 병반의 직경을 측정하였으며, 병 방제 효과를 계산하였다.
결과 및 고찰
Botryosphaeria 균주의 동정 결과
본 연구에서 확보한 전체 324개의 사과겹무늬썩음병균 균주 중 277개 균주는 Botryosphaeria sinensis와 동일한 cluster를 형성하였으며, 나머지 47개 균주는 Botryosphaeria kuwatsukai와 동일한 cluster를 형성하였다(data not shown). 따라서, 국내 다양한 지역의 사과원에서 분리한 Botryosphaeria spp.는 B. dothidea 매우 근연한 것으로 보고된 B. sinensis가 약 85%로 우점하고 있는 것으로 확인되었으며(Zhang et al., 2021), 약 15%는 최근 국내에서 보고된 B. kuwatsukai로 동정되었다(Lim et al., 2023). 이때 B. kuwatsukai는 분리한 8개 지역에서 모두 동정되었으며(경북: 11균주, 경남 1균주, 충북 5균주, 충남: 2균주, 전북: 7균주, 전남: 3균주, 강원: 7균주, 경기: 11균주), 분리 지역에 따른 종의 차이는 확인할 수 없었다. 이러한 결과는 이전 연구에서 국내 다양한 지역에서 분리한 사과겹무늬썩음병균이 B. sinensis가 약 88%로 우점하고 있으며, 이외 12%가 B. kuwatsukai로 동정되었던 결과와 유사하였다(Lim et al., 2024).
분리 연도, 지역, 병원균 종에 따른 fluazinam에 대한 감수성 비교
Fluazinam에 대한 324개 Botryosphaeria 균주의 감수성 정도를 조사한 결과 대부분의 균주가 유사한 균사생장 억제효과를 나타내며 저항성과 감수성 균주로 확연히 구분되지 않았다(Fig. 1A). 전체 균주의 평균 EC50값은 0.09 μg/mL로 나타났으며, 최소 0.06 μg/mL에서 최대 0.59 μg/mL의 EC50 값 범위를 나타내었다(Fig. 1B). 이때 전체 균주의 약 97%에 해당하는 317개 균주의 EC50 값이 0.20 μg/mL 이하에 분포하는 것으로 나타났으며, 상대적으로 높은 EC50 값을 나타낸 나머지 7개 균주도 그 값이 최대 0.59 μg/mL 이하로 매우 낮았기 때문에 고저항성으로 판단되지 않았다. Fluazinam에 대한 Botryosphaeria spp.의 EC50 값을 연도별로 비교하였을 때, 평균 EC50 값은 2005~2019년 집단에서 0.07 μg/mL, 2022~2024년 집단에서 0.09 μg/mL로 큰 차이를 나타내지 않았고, 분포 그래프에서 나타난 최빈값 구간 역시 동일하게 0.06~0.08 μg/mL로 나타나 통계적으로 유의성 있는 변화가 관찰되지 않았다(Fig. 2A). 동정 결과를 기반으로 Botryosphaeria의 종에 따라 감수성을 비교하였을 때, 우점종인 B. sinensis 집단은 평균 0.09 μg/mL, B. kuwatsukai 집단은 평균 0.07 μg/mL의 EC50 값을 나타내었으며, 이들의 구간별 EC50 값 분포를 비교하였을 때도 통계적인 유의성은 없었다(Fig. 2B). 또한, 각 균주를 분리한 지역으로 나누어 감수성을 비교한 결과, 가장 낮은 감수성을 보인 지역(경북: 평균 EC50 값 0.10 μg/mL)과 가장 높은 감수성을 보인 지역(충북: 평균 EC50 값 0.07 μg/mL) 간에 현저한 감수성의 차이는 확인되지 않았으며, 모든 지역이 유사한 EC50 값 분포 범위를 나타내어 통계적인 유의차는 나타나지 않았다(Fig. 2C). 식물 병원균의 살균제에 대한 살균제 저항성은 크게 질적 저항성과 양적 저항성으로 구분할 수 있다(Brent and Hollomon, 2007). 질적 저항성을 보이는 benomyl(‘나1’군), pyraclostrobin(‘다3’군) 등의 살균제에 대한 EC50 값은 감수성과 저항성 균주간에 현저한 차이가 나타나며, 양적 저항성을 보이는 tebuconazole(‘사1’군) 등의 살균제의 경우에는 EC50 값이 연도별로 서서히 감소하는 특징을 가지고 있다(Brent and Hollomon, 2007; Myung et al., 2024). 하지만 fluazinam의 경우 현재까지 저항성 발생에 대한 보고가 없으며, 이에 대한 저항성 기작 역시 명확히 밝혀지지 않아 질적, 혹은 양적 저항성으로 구분되지 않았다(Schepers et al., 2018). 따라서 fluazinam에 대해 감수성을 보고한 이전 연구들의 경우, 대부분 균사생장 억제율을 통해 산출한 EC50 값을 근거로 B. cinerea, Fusarium spp., S. sclerotiorum, Bipolaris maydis 등의 다양한 식물 병원균에 대한 기준 감수성을 제시하였다(Chen et al., 2018; Liu et al., 2019; Shi et al., 2016, 2023). 이때 대부분의 균주가 fluazinam에 대해 평균 1.00 μg/mL 이하의 현저히 낮은 EC50 값을 나타내어 모두 감수성으로 보고되었다. 본 연구에서 324개 사과겹무늬썩음병균을 대상으로 산출한 EC50 값 또한 평균 0.09 μg/mL으로 낮았으며, 저항성과 감수성 균주로 확연히 구분되지 않았다. 추가적으로, 연도별, 지역별, 균주별 EC50 값 분포를 비교한 결과 통계적인 유의성을 나타내지 않아, 집단간에 명확한 감수성의 차이 역시 확인할 수 없었다. 이러한 결과는 이전 연구에서 162개 B. dothidea 균주가 fluazinam에 대한 EC50 값은 0.003~0.19 μg/mL (Avg. 0.04 μg/mL)으로 산출된 것을 바탕으로 모두 감수성인 결과로 보고한 것과 유사하였다(Song et al., 2018). 다만, 이전 연구결과에 비해 평균 및 최대 EC50 값이 다소 높은 것으로 나타났기 때문에 차후 국내 사과겹무늬썩음병균 개체군에 대한 fluazinam 저항성 모니터링이 주의깊게 이루어져야할 것으로 생각된다.
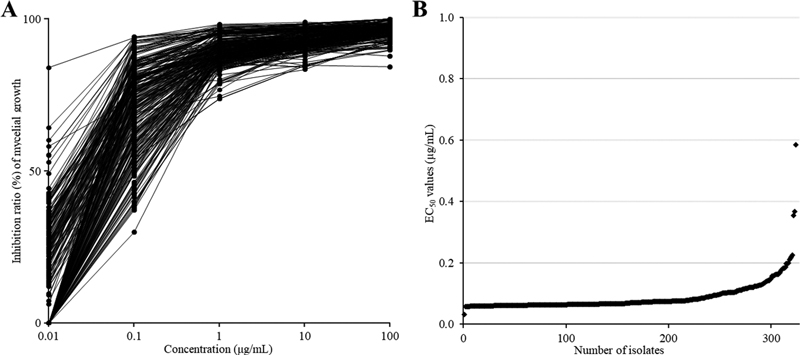
Mycelial inhibition ratio (%) of 324 Botryosphaeria spp. on the fluazinam-amended media (A) and distribution of calculated EC50 values across all strains (B).
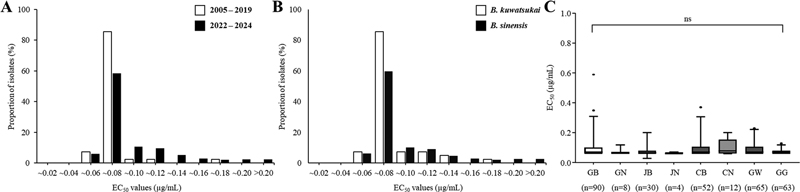
EC50 values distribution for Botryosphaeria populations according to various standards. The EC50 frequency distributions of populations collected during two periods, 2005 to 2019 and 2022 to 2024 (A). The EC50 frequency distributions of B. sinensis and B. kuwatsukai populations (B). A box and whisker plot of EC50 values by isolation region, including Gyeongbuk (GB), Gyeongnam (GN), Jeonbuk (JB), Jeonnam (JN), Chungbuk (CB), Chungnam (CN), Gwangwon (GW), and Gyeonggi (GG) are shown in (C). Black dots represent outliers, defined as EC50 values outside the 2.5~97.5 percentile range, while “NS” indicates no statistically significant differences between the compared groups.
사과겹무늬썩음병균에 대한 fluazinam의 병 방제 효과
Fluazinam의 권장 사용 농도인 200 μg/mL을 처리한 사과과실은 EC50 값의 차이에 관계없이 모두 무처리구에 비해 병반이 억제되었다(Fig. 3A). EC50 값이 낮았던 균주 5개의 방제 효율(%)은 45.4~71.0% (Avg. 60.9%)로 나타났고, EC50 값이 높았던 균주 5개의 방제 효율(%)은 56.3~91.7%(Avg. 71.0%)로 확인되었다(Fig. 3B). 산출된 방제 효율에 대해 정규성 검정을 실시한 결과 정규 분포를 따르는 것으로 확인되었기 때문에, t 검정을 통해 두 집단간의 차이를 확인한 결과 통계학적 유의성(p < 0.05)은 관찰되지 않았다(Fig. 3C). 추가적으로, 무처리구의 병반 면적 역시 EC50 값이 낮았던 균주와 높았던 균주 집단에서 각각 평균 47.3 mm 및 37.6 mm로 현저한 차이를 보이지 않았으며(Fig. 3D), 두 집단간의 통계적인 차이 또한 확인할 수 없었다(p = 0.0532). 따라서, EC50 값에 차이를 보인 두 균주 집단은 과실에서 나타나는 병원성과 fluazinam에 대한 방제효과가 모두 유사한 것으로 나타났다. 이는 fluazinam에 감수성인 B. dothidea 균주 집단을 사과 과실에 접종한 뒤 200 μg/mL의 약제를 처리하였을 때 약 6 5%의 방제 효율을 보인 이전 연구결과와 유사하였다(Song et al., 2018). 또한, pyraclostrobin에 대해 EC50 값이 높고 낮았던 B. dothidea 균주 집단이 무처리구에서 서로 유사한 병반 면적을 나타낸 결과 와도 일치하였다(Fan et al., 2019). 다만, fluazinam은 식물체 내로 흡수되지 않고 표면에 남아 병원균의 초기 발달을 저해하는 보호 살균제로 알려져 있다(Chen et al., 2018). 이로 인해 Coniella vitis, Bipolaris maydis, B. dothidea 등의 병원균을 접종한 뒤 fluazinam을 처리시, 약제 처리 후 병원균을 접종한 경우보다 비교적 낮은 방제 효과를 나타내는 것으로 보고되었다(Chen et al., 2018; Song et al., 2018; Wang et al., 2022). 따라서, 차후 연구를 통해 Botryosphaeria spp.에 대한 fluazinam의 보호 효과를 추가적인 검정하고, 현장에서 방제 효과를 함께 확인하여 식물체상에서 명확한 감수성 검정이 필요할 것으로 생각된다.
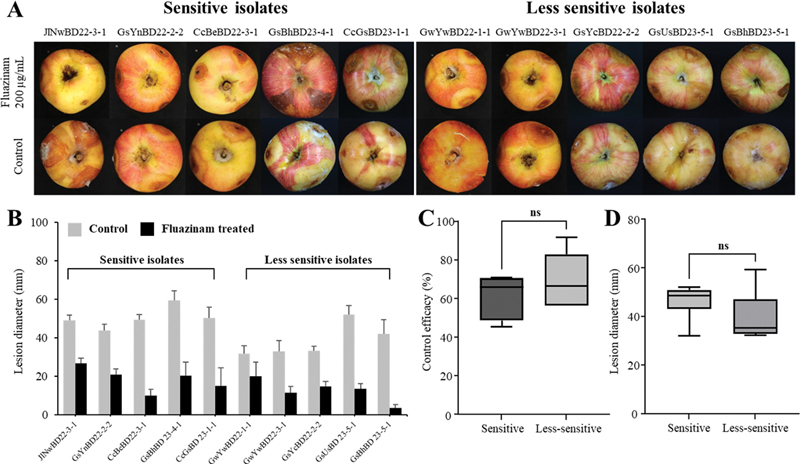
Control efficacy (%) of fluazinam against sensitive and less sensitive Botryosphaeria isolates on apples fruits (cv. ‘Picnic’). Pictures of apple fruits treated with fluazinam or ddH2O (control) after inoculation with Botryosphaeria (A). Mean lesion diameters of apple fruits treated with fluazinam or ddH2O (B). Statistical differences in control efficacy (C) and lesion diameter of control fruits (D) are shown as a box and whisker plot (“ns” indicates non-significant differences between groups according to the t-test results).
Fluazinam은 APT 합성효소에 여러 작용점을 가지는 페닐피리디나민계 살균제이며, 곰팡이의 생장과 발달에 필요한 에너지의 공급을 저해하여 살균 효과를 나타낸다(Liu et al., 2019; Vitoratos, 2014). Fluazinam에 대한 저항성 혹은 감수성의 감소는 현재까지 보고되지 않았으며, 작용 기작이 비특이적인 관계로 다른 질적, 혹은 양적 저항성을 나타내는 살균제들에 비해 저항성 발달 위험이 비교적 낮다(Mao et al., 2018; Tucker et al., 1994). 또한, 기준 감수성을 제시한 이전 연구들에서 S. sclerotiorum, B. cinerea, F. graminearum, Ustilago maydis 등의 다양한 식물병원성 곰팡이에 대해 매우 높은 활성을 나타낸 것으로 보고되었다(Liu et al., 2019; Vitoratos, 2014; Wang et al., 2016; Wu et al., 2022). 본 연구를 통해 Botryosphaeria spp.의 fluazinam에 대한 감수성평가를 진행한 결과 역시, 모든 균주가 현저히 낮은 EC50 값을 나타내었으며 연도별, 지역별, 균주별 감수성의 차이는 확인되지 않았다. 또한, 과실에 접종하였을 때도 높은 EC50 값을 보인 균주 집단과 낮은 EC50 값을 보인 균주 집단간에 유의미한 차이를 확인할 수 없었다. 따라서 fluazinam 살균제는 2005년부터 2024년까지 국내 다양한 지역의 사과원에서 채집한 모든 B. sinensis 및 B. kuwatsukai 균주들에 대해 높은 억제율을 보이며, 현재까지 고저항성을 획득한 균주는 확인되지 않은 것으로 판단된다. 하지만, 차후 fluazinam에 대한 저항성이 발달할 가능성은 여전히 존재한다. S. sclerotiorum, B. cinerea, C. vitis 등의 곰팡이에 대해 기내에서 반복적으로 fluazinam 배지에 접종한 결과, EC50 값이 최소 4배에서 최대 80배까지 증가하며 효과적으로 내성 균주가 유도되었다(Mao et al., 2018; Shao et al., 2015; Wang et al., 2022). 또한, 상대적으로 높은 EC50 값을 가진 Clarireedia jacksonii 균주나 높은 minimum inhibition concentration (MIC) 값을 가진 Phytophthora infestans 균주를 각각 잔디 혹은 감자 포장에 접종 후 fluazinam을 처리하였을 때, EC50 값이 낮았던 균주에 비해 낮은 병 방제효과를 보였다(Schepers et al., 2018; Shi et al., 2024). 따라서, 동일한 포장에서 지속적으로 fluazinam을 처리할 시 약제에 대한 감수성이 감소하고, 현장에서 방제 효과가 저해될 것으로 생각된다. 또한, 기후 변화는 병원균의 저항성 발달 가능성에 영향을 끼치며(Lurwanu et al., 2021), 동시에 수체의 수분 스트레스를 증가시키기 때문에 Botryosphaeria spp.에 의한 병 심각도가 높아질 것으로 예상된다(Dong et al., 2021; Garbelotto, 2024). 따라서, 국내 Botryosphaeria 개체군에 대한 주의깊은 감수성 모니터링을 통해 지속적인 저항성 관리가 필요하다. 본 연구 결과를 통해 확립한 fluazinam의 기준 감수성은 차 후 국내 사과겹무늬썩음병균 개체군에 대한 살균제 저항성 관리 및 연구 시 유용한 기초 자료로 활용될 것으로 기대된다.
Acknowledgments
본 연구는 농촌진흥청 농업과학기술 연구개발사업(과제번호: RS-2022-RD010350)의 지원에 의해 수행되었습니다.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
- Alves A, Crous PW, Correia A, Phillips AJL, 2008. Morphological and molecular data reveal cryptic speciation in Lasiodiplodia theobromae. Fungal Divers. 28:1-13.
- Brent KJ, Hollomon DW, 2007. Fungicide resistance in crop pathogens: How can it be managed? 2nd ed. 60 pp. FRAC a Technical Sub-group of Croplife International, Brussels, Belgium.
-
Chen YL, Mao, XW, Wang JX, Wu LY, Zhou MG, et al., 2018. Activity of the dinitroaniline fungicide fluazinam against Bipolaris maydis. Pestic. Biochem. Physiol. 148:8-15.
[https://doi.org/10.1016/j.pestbp.2018.03.005]

-
Cheon W, Jeon Y, 2015. Survey of major diseases occurred on apple in northern Gyeongbuk from 2013 to 2014. Res. Plant Dis. 21(4):261-267. (In Korean)
[https://doi.org/10.5423/RPD.2015.21.4.261]

-
Corkley I, Fraaije B, Hawkins N, 2022. Fungicide resistance management: Maximizing the effective life of plant protection products. Plant Pathol. 71(1):150-169.
[https://doi.org/10.1111/ppa.13467]

-
Dong X, Cheng Z, Leng W, Li B, Xu X, et al., 2021. Progression of symptoms caused by Botryosphaeria dothidea on apple branches. Phytopathology 111(9):1551-1559.
[https://doi.org/10.1094/PHYTO-12-20-0551-R]

-
Fan K, Wang J, Fu L, Zhang GF, Wu HB, et al., 2019. Baseline sensitivity and control efficacy of pyraclostrobin against Botryosphaeria dothidea isolates in China. Plant Dis. 103(7):1458-1463.
[https://doi.org/10.1094/PDIS-07-18-1214-RE]

- Fungicide Resistance Action Committee, 2024. FRAC code list 2024: fungal control agents sorted by cross-resistance pattern and mode of action (including coding for FRAC Groups on product labels) URL https://www.frac.info, [10 September 2024].
-
Garbelotto M, 2024. Drought heightens severity of diseases caused by Botryosphaeria dothidea and Cryptostroma corticale and needs to be factored in to properly assess pathogenicity or fulfill Koch’s postulates. J. Plant Pathol. 106:1823-1829.
[https://doi.org/10.1007/s42161-024-01702-3]

-
Gardes M, Bruns TD, 1993. ITS primers with enhanced specificity for basidiomycetes - application to the identification of mycorrhizae and rusts. Mol. Ecol. 2(2): 113-118.
[https://doi.org/10.1111/j.1365-294X.1993.tb00005.x]

-
Glass NL, Donaldson GC, 1995. Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes. Appl. Environ. Microbiol. 61(4):1323-1330.
[https://doi.org/10.1128/aem.61.4.1323-1330.1995]

-
Jurick WM, Vico I, Gaskins VL, Janisiewicz WJ, Peter KA, 2013. First report of Botryosphaeria dothidea causing white rot on apple fruit in Maryland. Plant Dis. 97(7):999.
[https://doi.org/10.1094/PDIS-01-13-0053-PDN]

-
Kim CH, 2002. Review of disease incidence of major crops in 2001. Res. Plant Dis. 8(1):1-10. (In Korean)
[https://doi.org/10.5423/RPD.2002.8.1.001]

-
Lee HK, Shin JH, Lee SC, Han YK, 2023. Biological control of white rot in apple using Bacillus spp. Res. Plant Dis. 29(4):390-398. (In Korean)
[https://doi.org/10.5423/RPD.2023.29.4.390]

-
Lim GJ, Choi JW, Lim GK, Nam YJ, Lee HK, et al., 2024. Sensitivity evaluation of Botryosphaeria spp. distributed in apple orchards to benomyl and tebuconazole fungicides in Korea. Res. Plant Dis. 30(4). [In press]
[https://doi.org/10.5423/RPD.2024.30.4.353]

- Lim GJ, Das K, Noh HJ, Lim SK, Cho YJ, et al., 2023. First report of an apple ring rot fungus Botryosphaeria kuwatsukai in Korea. Kor. J. Mycol. 51(2):111-120.
-
Liu S, Jiang J, Che Z, Tian Y, Chen, G, 2019. Baseline sensitivity and control efficacy of fluazinam against Sclerotinia sclerotiorum in Henan Province, China. J. Phytopathol. 167(2):75-81.
[https://doi.org/10.1111/jph.12774]

-
Lurwanu Y, Wang YP, Wu EJ, He DC, Waheed A, et al., 2021. Increasing temperature elevates the variation and spatial differentiation of pesticide tolerance in a plant pathogen. Evol. Appl. 14(5):1274-1285.
[https://doi.org/10.1111/eva.13197]

-
Mao XW, Li JS, Chen YL, Song XS, Duan YB, et al., 2018. Resistance risk assessment for fluazinam in Sclerotinia sclerotiorum. Pestic. Biochem. Physiol. 144:27-35.
[https://doi.org/10.1016/j.pestbp.2017.10.010]

-
Myung KS, Adbullahi A, Kim HT, 2024. Changes in susceptibility of pathogens isolated from Ginseng aerial parts to pyraclostrobin, fluazinam, and prochloraz. Korean J. Pestic. Sci. 28(3):280-290. (In Korean)
[https://doi.org/10.7585/kjps.2024.28.3.280]

-
Pugliese M, Matić S, Prethi S, Gisi U, Gullino ML, 2018. Molecular characterization and sensitivity to demethylation inhibitor fungicides of Aspergillus fumigatus from orange-based compost. PLoS One 13(7):e0200569.
[https://doi.org/10.1371/journal.pone.0200569]

- Rural Development Administration. 2024. Pesticide safety information system. URL https://psis.rda.go.kr/psis/agc/res/agchmRegistStusLst.ps?menuId=PS00263, [10 September 2024].
- Russell PE, 2002. Sensitivity baselines in fungicide resistance research and management. 60 pp. FRAC a Technical Sub-group of Croplife International, Brussels, Belgium.
-
Schepers HTAM, Kessel GJT, Lucca F, Förch MG, van den Bosch GBM, et al., 2018. Reduced efficacy of fluazinam against Phytophthora infestans in the Netherlands. Eur. J. Plant Pathol. 151(4):947-960.
[https://doi.org/10.1007/s10658-018-1430-y]

-
Shao W, Ren W, Zhang Y, Hou Y, Duan Y, et al., 2015. Baseline sensitivity of natural populations and characterization of resistant strains of Botrytis cinerea to fluazinam. Australas. Plant Pathol. 44:375-383.
[https://doi.org/10.1007/s13313-015-0358-3]

-
Shi D, Li X, Cao Y, Li Q, Wang J, et al., 2023. Characterization and fitness of Fusarium graminearum mutants resistant to fluazinam. Plant Pathol. 72(7):1314-1325.
[https://doi.org/10.1111/ppa.13739]

- Shi N, Du Y, Ruan H, Gan L, Yang X, et al., 2016. Baseline sensitivity of Botrytis cinerea to fluazinam and crossresistance to different fungicides in Fujian province. Chin. J. Pestic. Sci. 18(4):535-539.
-
Shi X, Min S, Jung G, 2024. Field evaluation of fluazinam fungicide in dollar spot populations confirmed in vitro insensitivity. Plant Dis. 108(11):3329-3335.
[https://doi.org/10.1094/PDIS-12-23-2639-RE]

-
Song Y, Li L, Li C, Lu Z, Men X, et al., 2018. Evaluating the sensitivity and efficacy of fungicides with different modes of action against Botryosphaeria dothidea. Plant Dis. 102(9):1785-1793.
[https://doi.org/10.1094/PDIS-01-18-0118-RE]

- Statistics Korea, 2024. Results of the 2024 survey on the cultivation area of wheat, potatoes, apples, and pears. URL https://kosis.kr/statHtml/statHtml.do?orgId=101&tblId=DT_1ET0025&connpath=I2&language=en, [10 September 2024].
-
Tamura K, Stecher G, Kumar S, 2021. MEGA11: Molecular evolutionary genetics analysis version 11. Mol. Biol. Evol. 38(7):3022-3027.
[https://doi.org/10.1093/molbev/msab120]

-
Vitoratos AG, 2014. Mode of action and genetic analysis of resistance to fluazinam in Ustilago maydis. J. Phytopathol. 162(11-12):737-746.
[https://doi.org/10.1111/jph.12254]

-
Wang L, Tu H, Hou H, Zhou Z, Yuan H, et al., 2022. Occurrence and detection of carbendazim resistance in Botryosphaeria dothidea from apple orchards in China. Plant Dis. 106(1): 207-214.
[https://doi.org/10.1094/PDIS-06-20-1204-RE]

-
Wang Y, Duan YB, Zhou MG, 2016. Baseline sensitivity and efficacy of fluazinam in controlling Sclerotinia stem rot of rapeseed. Eur. J. Plant Pathol. 144:337-343.
[https://doi.org/10.1007/s10658-015-0771-z]

-
White TJ, Bruns TD, Lee SB, Taylor JW, 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. pp. 315-322. In: eds. MA Innis MA, DH Gelfand DH, Sninsky JJ, White TJ (Eds.). PCR Protocols: a Guide to Methods and Applications. Academic Press, San Diego, USA.
[https://doi.org/10.1016/B978-0-12-372180-8.50042-1]

-
Wu L, Wu Z, Zhao F, Hahn M, Zhou M, et al., 2022. Activity and cell toxicology of fluazinam on Fusarium graminearum. Pestic. Biochem. Physiol. 188:105253.
[https://doi.org/10.1016/j.pestbp.2022.105253]

-
Xu C, Wang C, Ju L, Zhang R, Biggs AR, et al., 2015. Multiple locus genealogies and phenotypic characters reappraise the causal agents of apple ring rot in China. Fungal Divers. 71:215-231.
[https://doi.org/10.1007/s13225-014-0306-5]

- Zhang C, Zhang T, Lu X, Liu Z, Zhang Y, et al., 2012. Toxicity test of ten fungicides to Macrophoma kawatsukai and Colletotrichum gloeosporioides in laboratory. Chin. Agric. Sci. Bull. 28(27):236-240.
-
Zhang W, Groenewald JZ, Lombard L, Schumacher RK, Phillips AJL, et al., 2021. Evaluating species in Botryosphaeriales. Persoonia 46:63-115.
[https://doi.org/10.3767/persoonia.2021.46.03]

Gwang-Jae Lim, Department of Plant Medicine, Kyungpook National University, Master student, data analysis, and first draft preparation, https://orcid.org/0009-0006-6157-4333.
Jun-Woo Choi, Department of Plant Medicine, Kyungpook National University, Master student, Experimentation.
Young Ju Nam, Global Agro-Consulting Corporation, Researcher, Methodology.
Ha-Kyoung Lee, Horticultural and Herbal Crop Environment Division, National Institute of Horticultural & Herbal Science, Rural Development Administration, Researcher, Methodology.
Seung-Yeol Lee, Department of Plant Medicine, Kyungpook National University, Associate Professor, Supervision, draft review and editing, https://orcid.org/0000-0003-1676-0330.
Hee-Young Jung, Department of Plant Medicine, Kyungpook National University, Professor, Supervision.