열대거세미나방(Spodoptera frugiperda) 유충에 대한 살충제 플룩사마이드의 섭식독성과 접촉독성 효과
초록
열대거세미나방 (Spodoptera frugiperda)은 세계적으로 농업 생산성에 큰 피해를 주는 해충으로, 옥수수와 같은 기주식물에 심각한 영향을 미친다. 본 연구에서는 국내에 등록된 저독성 isoxazoline계 살충제인 플룩사메타마이드의 살충효과를 평가하기 위해 미국과 중국 집단의 열대거세미나방 유충을 대상으로 섭식독성과 접촉독성을 비교 분석하였다. 실험은 각각의 집단에서 2령과 6령 유충을 대상으로 수행되었으며, 반수치사농도(LD50)를 측정하여 감수성 차이를 확인하였다. 실험 결과, 두 집단 모두 6령 유충보다 2령 유충에서 높은 감수성이 관찰되어 플룩사메타마이드에 대해 농도 의존적인 살충효과를 보여주었다. 특히, 중국 집단이 미국 집단에 비해 더 높은 내성을 나타냈다. 그러나, 약제처리방법에 있어서 접촉독성이 섭식독성보다 살충력이 높은 것으로 조사되었다. 본 연구 결과는 야외포장에서 효과적인 열대거세미나방 방제를 위해 플룩사메타마이드의 사용 최적화에 대한 중요한 기초 자료를 제공할 것으로 기대된다.
Abstract
The fall armyworm (Spodoptera frugiperda) is a major pest that poses serious threat to global crop production, especially corn. The present study evaluated the effectiveness of fluxametamide, an isoxazoline insecticide with low toxicity and registered in Korea, by comparing its oral and contact toxicity to corn strain larvae between the US population (Sf-USA) and Chinese population (Sf-CHN). Bioassays were conducted on 6th and 6th instar larvae, and the median lethal concentration (LC50) was measured to assess the differences in susceptibility. The results showed that the 6th instar larvae were more susceptible, while the 6th instar larvae were less affected, indicating a dose-dependent response in both the populations. In the comparison of larval susceptibility between the two populations, the Sf-CHN displayed lower susceptibility than the Sf-USA. However, the insecticidal efficacy was higher for the contact toxicity than the oral toxicity. These findings provide an insightful direction to optimize the application of fluxametamide with a view to controlling S. frugiperda effectively in the field.
Keywords:
Fall armyworm, Fluxametamide, Insecticide, Sf-USA, Sf-CHN, Oral toxicity, Contact toxicity키워드:
열대거세미나방, 플룩사메타마이드, 살충제, 섭식독성, 접촉독성서 론
미주 대륙의 열대와 아열대 지역이 원산인 열대거세미나방 (fall armyworm, Spodoptera frugiperda (Smith))은 나비목 밤나방과에 속하는 해충이다(Spark, 1979; Vatanparst and Park, 2022). 이 해충은 광식성의 넓은 기주범위로 전세계적으로 농작물에 심각한 피해를 주며, 옥수수 등 화본과 작물을 주로 가해한다(CABI 2019; Gokulanathan et al., 2022). 열대 거세미나방은 형태적으로 유사하지만, 유전적으로는 C orn 계통(C-strain)과 Rice 계통(R-strain)으로 나눠지며 이들 계통간 교잡종인 Hybrid 계통이 존재한다(Pashley, 1986; Nagoshi and Meagher, 2022). 종 내의 계통구분은 종특이적인 다형현상 분석에 이용되고 있는 세포핵의 Z 염색체에 존재하는 triosephosphate isomerase (Tpi) 유전자에 의해 유전적으로 구분된다(Nagoshi and Meagher, 2022). 주로 옥수수, 목화, 사탕수수를 섭식하는 열대거세미나방은 C -strain이며, 이에 반해 주로 쌀과 다양한 목초를 섭식하는 열대거세미나방은 R-strain이다(Dumans et al., 2015).
열대거세미나방은 이동성이 강한 해충으로 하루 동안 100 km 이상을 비행할 수 있는 장거리 이주 해충으로 알려져 있다(Jonhson, 1987). 이 종의 비행능력은 봄에서 가을 동안 미국의 텍사스와 플로리다 지역에서 북쪽의 캐나다 온타리오와 퀘벡까지 1,700 km를 이동하는 것이 보고되었다 (Mitchell et al., 1991; Westbrook et al., 2016). 열대거세미 나방의 전 세계적인 확산은 2016년도에 원산지가 아닌 서아프리카의 나이지리아에서 발생이 확인된 후 사하라 이남지역의 아프리카 대부분의 국가에 걸쳐 발견되었다(Georgen et al., 2016; Nagoshi et al., 2018). 또한, 아프리카 지역에서 아시아 지역으로의 확산은 2018년 5월에 인도에서 첫 발생 후 같은 해에 미얀마와 태국 등 동남아시아 국가에서도 확인되었고 2019년 1월에는 중국 윈난성에서 침입 확인 후 5월에는 대부분의 중국 남부지역으로 확산이 보고되었다(Li et al., 2022).
열대거세미나방은 광식성과 장거리 비행능력으로 인해 확산속도가 매우 빠르며, 옥수수 및 다른 작물 생산에도 피해를 미칠 수 있어 식량안보에도 상당한 위협을 줄 수 있다 (Vatanparast and Park, 2022). 옥수수는 이 가운데 가장 많이 피해가 발생하는 작물이며, 이 외에도 경제적으로 중요한 벼, 사탕수수, 수수, 비트, 토마토, 감자, 면화, 목초 등 다양한 작물에 피해가 보고되었다(Day et al., 2017; Heo et al., 2021). 특히, 열대거세미나방에 의한 아메리카 대륙에서 옥수수의 손실은 온두라스와 아르헨티나에서는 각각 40%와 72%로 알려져 있으며(Wyckhuys and O’Neal, 2006; Murúa et al., 2006), 세계적인 피해는 최대 6,187.30 백만불로 추정되고 있다(Day et al., 2017). 이 외에도 미국에서 실시한 열대거세미나방에 의한 작물 손실 실태조사 결과, 수수에서 26% 쌀에서 약 5%의 손실이 확인되었다(Overton et al., 2021).
플룩사메타마이드(fluxametamide)는 diamides, avermectins, fiproles와 달리 차세대 저위험 isoxazoline계 살충제이며, 살충제 작용기작은 Insectcide Resistance Action Committee (IRAC)의 30번 그룹에 속한다(Roy et al., 2023; Spark et al., 2021). 특히, gamma-aminobutyric acid (GABA)와 glutamate에 의해 활성화된 chloride 채널을 새로운 표적으로 하고 있다 (Asahi et al., 2018; Umetsu et al., 2020). 플룩사메타마이드는 나비목, 총채벌레목, 딱정벌레목 및 파리목을 포함한 다양한 곤충 목에 대한 우수한 살충효과를 가지고 있으며, 비 표적 독성이 낮아서 천적과 화분매개곤충과 같은 유용곤충에도 유리한 장점을 가지고 있다(Roy et al., 2023; Asahi et al., 2018; Mita et al., 2021).
국내에서 열대거세미나방는 2019년 6월 13일 제주도의 옥수수 재배 농가에서 처음으로 발견이 보고된 후 같은 해 7월에 전라도와 경상남도 지역에서도 추가로 발견되었다 (Lee et al., 2020). 특히, 중국 남부에서 발생한 개체가 우리나라로 침입한 것으로 향후 지속적인 침입으로 옥수수와 다른 작물에도 피해가 예상되어 대비가 필요하다(Li et al., 2020; Jung et al., 2020). 특히, 2019년과 같이 열대거세미나방 성 충이 6월에 국내 침입 시, 4월 말에서 5월 중순 사이에 파종하는 국내 옥수수 포장에서 침입 성충의 다음 세대 유충에 의한 피해가 발생할 수 있어 효과적인 방제법 수립이 필요하다.
본 연구에서는 국내에 등록된 살충제 가운데 저독성 농약으로 알려진 플룩사메타마이드를 대상으로 미국과 중국 집단의 열대거세미나방 유충에 대한 섭식 및 접촉독성의 차이를 조사하였다. 또한, 화학적 방제의 효율을 증진하는 방안으로 각 집단의 발육태별 방제효과의 차이를 조사하였다.
재료 및 방법
열대거세미나방의 채집 및 실내 사육
시험곤충은 2020년 7월 중국에서 비래한 열대거세미나방 유충을 충남 서천 지역의 옥수수 포장 일대에서 채집하여 계대사육한 중국집단(Sf-CHN)과 미국의 Frontier Agricultural Sciences에서 구매 후 계대사육한 미국집단(Sf-USA)을 사용 하였다(Choi et al., 2023). 열대거세미나방 두 개 집단은 식물검역기술개발센터의 검역해충실험동에서 10세대 이상 인공사료(Frontier Agricultural Sciences, Newark, DE, USA)를 제공하며 분리 사육을 하였다. 유충은 직경 10cm의 사육 용기(SPL Life Sciences, Pocheon, Korea)를 사용하여 2령부터 개체로 사육하였다. 성충은 통풍이 되도록 제작된 뚜껑이 있는 플라스틱 사육상자(40 × 20 × 15 cm3)에서 10%의 설 탕물을 제공하며 사육하였다. 유충과 성충 모두 실험실 환경조건은 온도 26±1oC, 상대습도 70±5%, 및 광주기 14L:10D로 동일하게 유지하였다.
시험곤충의 형태 및 동정
채집한 열대거세미나방 5령 유충은 형태적인 특징과 DNA 바코드를 이용해 동정하였다. DNA 바코드 분석을 위해서 유충은 70% 에탄올로 표면소독 후 중장이 제거된 조직을 파쇄하였다. 이후 DNeasy® Blood & Tissue Kit (QIAGEN Inc., Dusseldorf, Germany)를 이용하여 genomic DNA를 추출하였다. 추출한 DNA를 주형으로 LCO1490 (5′-GGT CAA CAA ATC ATA AAG ATA TTG G-3′)과 HCO2198 (5′-TAA ACT TCA GGG TGA CCA AAA AAT CA-3′) 프라이머 세트(Folmer et al., 1994)를 이용하여 Lee 등(2020)이 보고한 PCR 조건으로 DNA를 증폭하였다. DNA 증폭산물은 1% agarose gel에서 단일 밴드로 분리하여 분석업체 (Macrogen Co., LTD, Daejeon, Korea)에서 양방향의 염기서열을 해독하였으며, NCBI의 nucleotide BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi)를 이용하여 유사도를 확인하였다.
시험약제
본 연구에 사용한 살충제는 열대거세미나방 방제에 상업적으로 등록되어 판매되고 있는 Isoxazolines계 단제인 플룩 사메타마이드 액상수화제(유효성분 7.0%, 경농)를 구매하여 사용하였다. 약제는 멸균 증류수를 이용하여 제품 추천농도인 35 ppm으로 준비한 후 이를 기준으로 1/2 농도씩 약제를 순차적으로 희석하여 시험에 사용하였다.
약제 감수성 평가
플룩사메타마이드 액상수화제에 대한 생물검정은 섭식독성 분석을 위한 사료 침지법과 접촉독성 분석을 위한 충체 분무법으로 진행하였다. 사료 침지법의 경우 열대거세미나방 인공사료를 일정한 크기(10 × 10 × 5 mm3)로 잘라 준비된 각 농도별 희석된 약제에 30초간 침지한 후, 9 cm의 원형 페트리접시(SPL Life Sciences, Pocheon, Korea)에 넣고 30분 동안 건조하였다. 충체 분무법의 경우 페트리접시에 유충을 처리한 후 각 농도별로 희석된 약제를 소형분무기 담아 충체에 직접 분무 살포하였다. 살포 후 새로운 페트리 접시에 유충을 옮겨주었으며, 인공사료를 제공하였다. 모든 생물검정에서 페트리접시에 1마리씩 유충을 담아주어 동종 포식을 방지하였으며, 각 처리당 10마리씩 3반복으로 진행 하였다. 미국 집단과 중국 집단의 각 령기별 감수성 조사에서는 2령과 6령 유충을 사용하였으며, 각 농도별 약제 처리 후 24시간 간격으로 3일 동안 죽은 유충 수를 조사하였다.
통계분석
유충 살충률은 arcsine 변환 후 SAS/STAT 통계프로그램 (SAS Institute Inc., 1989)의 PROC GLM을 이용하여 ANOVA 분석 후 평균간 비교를 실시하였다. 플룩사메타마이드 액상 수화제의 섭식독성과 접촉독성의 반수치사농도(Medial lethal concentration, LC50)값은 약제 처리 후 48시간 조사 결과를 사용하고, SAS/STAT의 probit 분석을 이용하여 계산하였다.
결 과
열대거세미나방 집단별 성충 형태 및 동정
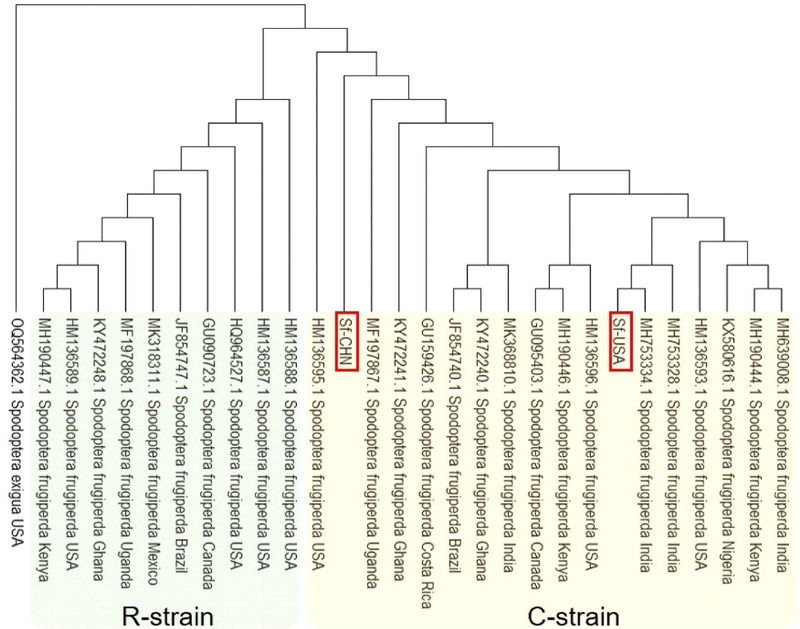
미국과 중국집단의 열대거세미나방 성충은 형태적으로 집단별 구분이 어려웠으나, mtDNA에 존재하는 COI 유전자의 DNA 바코딩 분석에 의해 유전적으로 두 집단은 동일한 C-strain으로 구분되었다(Fig. 1). 각 집단별 암컷과 수컷 성충의 외부 형태는 몸 크기와 색깔에 있어 모두 동일하였으며, DNA 바코딩 분석에서 두 집단 모두 NCBI GenBank에 등 록된 열대거세미나방 염기서열과 100%의 유사도를 확인할 수 있었다. 또한, 658bp의 염기서열을 바탕으로 계통수 분석을 하였을 때 기존에 C-strain으로 알려진 열대거세미나방 집단과 동일한 그룹으로 분류되었다(Fig. 1).
열대거세미나방 유충에 대한 섭식독성
플룩사메타마이드에 대한 중국과 미국의 열대거세미나방 유충의 약제 감수성을 알아보기 위해 섭식독성을 조사하였다. 기준농도인 35 ppm에서 노출된 두 집단의 유충은 처리 후 24시간에 100% 살충효과를 보였으나, 집단별 및 령기별로 약제에 대한 감수성이 다르게 조사되었다(Fig. 2). 약제 처리 후 24시간 령기별 살충율 비교에서 미국 집단 2령 유충 (dF = 4, 14; F = 322.0; P = 0.0001)의 경우 6령 유충(dF = 8, 23; F = 234.1; P = 0.0001)의 약제에 대한 감수성이 2령 유충보다 낮았다. 이러한 결과는 중국 집단의 2령 유충(dF = 4, 14; F = 123.4; P = 0.0001)과 6령 유충(dF = 8, 23; F = 283.8; P = 0.0001)의 비교에서도 유사하였다. 또한, 집단별 살충율 비교에서 6령 유충을 대상으로 2.2 ppm 농도로 약제 처리 후 24시간의 살충력을 비교하면 미국과 중국 집단은 각각 87.3%과 35.3%(dF = 1, 5; F = 40.0; P = 0.0031), 72시간에는 각 각 100%와 86.7%(dF = 1, 5; F = 25.0; P = 0.0075)으로 두 집단 간 약제에 대한 감수성 차이에 통계적인 유의차가 인정되었다. 어린 유충단계인 2령 유충을 대상으로 7.8 ppm 농도의 약제 처리 후 24시간에 미국과 중국 집단은 각각 73.3%과 63.3%의 살충효과를 나타내어 미국 집단의 감수성이 더 높았으며, 두 집단간 살충제 감수성의 차이가 통계적으로 인정되었다(dF = 1, 5; F = 18.0; P = 0.01). 섭식독성 결과를 바탕으로 열대거세미나방 유충의 령기가 진행될수록 약제에 대한 내성도 상대적으로 증가하는 것으로 추정되었다.
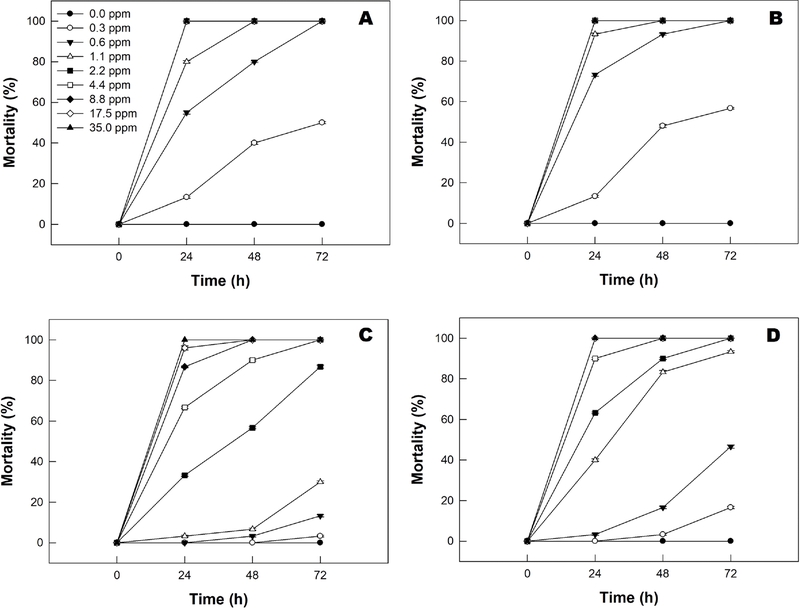
Oral toxicity of fluxametamide against the fall armyworm, Spodoptera frugiperda 2nd and 6th larval instar. Sf-CHN and Sf-USA mean China and USA population of S. frugiperda, respectively. The values are presented as the mean mortality ± SE. (A) Sf-CHN 2nd instar larvae, (B) Sf-USA 2nd instar larvae, (C) Sf-CHN 6th instar larvae, (D) Sf-USA 6th instar larvae.
열대거세미나방 유충에 대한 접촉독성
섭식독성에 이어 열대거세미나방 유충에 대한 접촉독성을 비교하였다(Fig. 3). 접촉독성에 있어서 약제 처리 후 24시간 살충율 비교에서 미국집단 2령 유충(dF = 4, 14; F = 298.7; P = 0.0001)과 6령 유충(dF = 5, 17; F = 1,316.2; P = 0.0001), 그리고 중국 집단 2령(dF = 4, 10; F = 61.0; P = 0.0001)과 6령 (dF = 8, 26; F = 600.8; P = 0.0001) 유충은 모두 섭식독성과 유사하게 농도에 의존한 살충효과로 통계적으로 유의한 차 이를 보였다. 2령의 경우 0.6ppm 농도의 약제 처리 후 24시간에 미국 집단 81.3%, 중국 집단 73.3%의 살충효과가 나타나 미국 집단이 중국 집단보다 플룩사메타마이드 약제에 대해 감수성이 높았다(dF = 1, 5; F = 50.0; P = 0.002). 1.10 ppm의 농도로 6령 유충에 각각 약제 처리 시 24시간 후 미국 집단은 34.3%, 중국 집단은 9.0%로 살충효과가 나타나 각 집단별 2령 유충에서 90% 이상의 살충효과가 확인되어 노숙 유충에서 내성이 높은 것으로 조사되었다(dF = 1, 5; F = 16.0; P = 0.01). 따라서, 접촉독성에서도 열대거세미나방 유충은 플룩사메타마이드 살충제에 대해 령기가 진행될수록 충체의 감수성이 상대적으로 높아지는 것으로 나타났다.
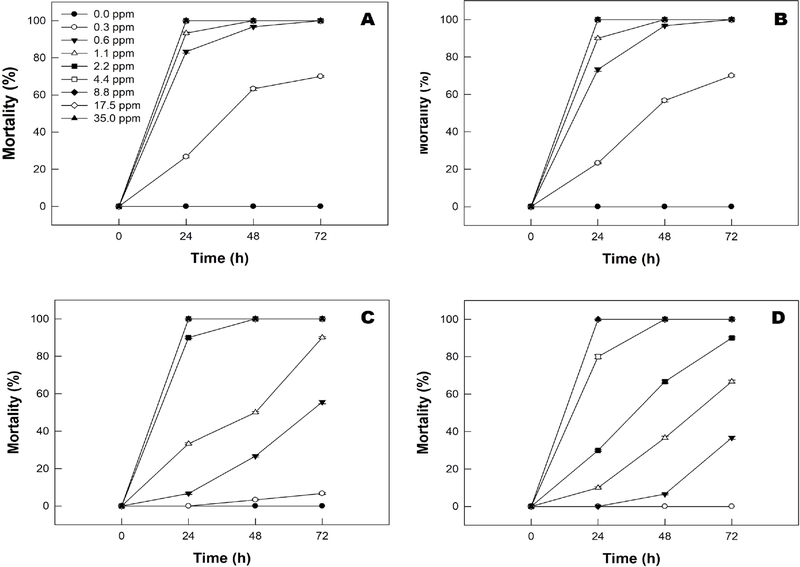
Contact toxicity of fluxametamide against the fall armyworm, Spodoptera frugiperda 2nd and 6th larval instar. Sf-CHN and Sf-USA mean China and USA population of S. frugiperda, respectively. The values are presented as the mean mortality ± SE. (A) Sf-CHN 2nd instar larvae, (B) Sf-USA 2nd instar larvae, (C) Sf-CHN 6th instar larvae, (D) Sf-USA 6th instar larvae.
섭식독성과 접촉독성에 대한 반수치사농도 조사
섭식독성 실험에서 미국과 중국 집단간의 LC50 농도는 2령 유충의 경우 각각 0.42 ppm과 0.54 ppm, 6령 유충의 경우 1.79 ppm과 3.54 ppm으로 조사되어 중국 집단이 미국 집단보다 더 낮은 감수성을 보였다(Table 1). 또한, 접촉독성 실험에는 미국과 중국 집단간의 LC50 농도는 2령 유충의 경우 각각 0.37 ppm과 0.44 ppm, 6령 유충의 경우 1.33 ppm과 2.74 ppm으로 조사되어 미국 집단이 중국 집단보다 더 낮은 감수성을 보였다(Table 1). 특히, 동일한 약제 농도에 대한 령기별 살충효과는 중국집단의 2령 유충을 대상으로 비교시 접촉독성이 섭식독성보다 높았으며, 통계적인 유의차가 인정되었다(dF = 4, 25; F = 476.30; P = 0.0001).

Oral toxicity of fluxametamide against two different populations of the fall armyworm, Spodoptera frugiperda larvae

Contact toxicity of fluxametamide against two different populations of the fall armyworm, Spodoptera frugiperda larvae
고 찰
열대거세미나방은 전 세계적으로 심각한 농업 해충으로 농업생산에 막대한 피해를 준다(Liu et al., 2024). 이러한 열대거세미나방을 효과하는 방제방법은 여전히 화학적 농약 또는 생물농약에 의존하고 있다(Kulye et al., 2021). 그러나 많은 살충제에 의존하는 방제법은 기존 살충제에 대해 다양한 수준의 약제 저항성을 발전시킨다. 미국의 플로리다에서는 유기염소계 살충제에 대해 열대거세미나방은 20-271배의 저항성을 보여주며(Yu et al., 1992), 푸에르토리코에서는 디아마이드계 살충제에 대해 160~500배의 저항성이 보고되었다(Gutiérrez-Moreno et al., 2019). 이처럼 다양한 살충제에 대한 열대거세미나방의 저항성은 나라별로 서로 상이할 수 있다. 특히, 국내에서 발견되는 열대거세미나방의 경우 중국에서 비래하기 때문에 국내 농업현장에서 사용되는 살충제보다는 중국에서 사용되는 약제에 주로 노출되어 이들 약제에 대한 저항성이 발달이 의심될 수 있다. 따라서 기존에 주로 사용되는 약제와 다른 작용기작을 가지고 있어 교차 저항성이 없는 신규 살충제의 적용이 국내에서 발견되는 열대거세미나방 방제에 필요하다. 플룩사메타마이드는 isoxazoline 계열의 신규 살충제로 GABA-gated chloride 채널 교란을 통하여 나비목, 총채벌레목, 딱정벌레목, 파리목 해충을 대상으로 높은 살충활성을 가지고 있다(Kagami et al., 2017).
본 연구에서 열대거세미나방 유충에 대한 생물검정을 통해 플룩사메타마이드 살충제가 높은 독성효과가 있음을 확인할 수 있었다. 특히, 미국 기원의 집단(Sf-USA)과 국내에서 채집한 중국 기원의 집단(Sf-CHN)의 mtDNA의 COI 유 전형 분석을 통해 두 집단 모두 옥수수를 주 기주로 하는 C-strain을 확인하였다(Fig. 1). 이는 이전연구에서 Tpi 유전자 분석을 통해 두 집단 모두 Exon-4의 183번째 loci에서 염기서열이 C로 확인되어 옥수수계통으로 확인되었으나 (Choi et al., 2023), 본 연구에서 수행한 COI 염기서열 분석 기반의 계통수 분석에서도 이와 동일한 결과가 나왔다.
Sf-USA와 Sf-CHN 집단별 살충효과를 비교하여 플룩사 메타마이드에 대한 감수성이 두 집단에서 서로 상이하다는 것을 확인할 수 있었다(Fig. 2 and 3). 그러나 아직까지 열대거세 미나방의 국가별 집단간 살충제 내성에 관한 직접적인 비교 연구는 이뤄지지 않았다. 다만, 국내에 침입한 열대거세미나방의 경우 각 지역 집단(경남 밀양, 강원 동해, 충남 태안)을 대상으로 시기별(2020년과 2021년)로 살충제에 대한 생물 검정을 수행하였으며, 이 집단들은 편서풍의 영향으로 중국 절강성에서 국내로 비래한 것으로 지역별 및 연도별 각 집단에 따라 살충제에 대한 살충효과가 약제에 따라 달랐다 (RDA, 2022). 따라서, 중국에서 비래한 집단 간에서도 살충제 저항성 차이가 확인되어 미국과 중국 집단간에도 플룩사 메타마이드에 대한 약제의 저항성 차이가 나타날 수 있을 것으로 판단된다. 이와 같은 저항성의 차이는 해충의 생물적 특성과 약제 살포 이력에 근거한 살충제에 대한 선택압(Cho et al., 2018)과 저항성 발달 수준의 차이(Sparks and Nauen, 2015)가 원인이 될 수 있다. 그러나 본 연구결과를 바탕으로 플룩사메타마이드에 대한 각 나라별 유래의 열대거세미나방에 대한 약제 감수성이 야외에서 발생하는 집단에 대해 동 일하다고 판단을 하기에는 어려우며, 추가로 미국과 중국의 다양한 지역 집단에 대한 생물검정이 필요하다.
플룩사메타마이드에 대한 열대거세미나방 유충 독성은 령기에 따라 다르게 나타났다. 이와 같은 현상은 대부분의 살충제 연구에서 어린 시기인 유충이나 약충이 살충제에 가장 민감하고 령기가 진행함에 따라 내성이 증가한다는 기존 보고(Ahdam and Forgashk, 1975; Prabhaker et al., 1989; Bouvier et al., 2002; Wang et al., 2003; Rodriguez-Saona et al., 2016; Jeong et al., 2023)와 동일하였다. 또한, esterase, cytochrome P450, glutathione S-transferases와 같은 주요 해독효소의 활성은 령기가 진행됨에 따라 높아진다(Jeong et al., 2023). 열대거세미나방 유충의 체내에서도 이처럼 해독과정에 작용하는 주요 해독 효소들의 활성이 발육단계가 진행됨에 따라 높아져서 령기별 살충제의 활성이 달라지는 것으로 판단된다. 중국집단의 2령 유충을 대상으로 플룩사메타마이드의 약제처리 방법에 따른 살충효과의 차이가 있었다. 이는 약제 살포 시 높은 지용성으로 인해 곤충의 체벽을 직접 통과하여 신경계 교란과 같은 독장용을 나타낼 수 있기 때문인 것으로 보이며, 섭식독성이 접촉독성보다 상대적으로 효과가 낮은 이유는 생물검정 방법에서 있어서 독먹이 제조 과정에서 살충제가 사료에 포함된 incorporate assay가 아닌 침지법으로 수행한 결과로 판단된다.
국내 옥수수 재배지에 지속적으로 유입되는 중국비래의 열대거세미나방의 효과적인 방제를 위해서는 국내 옥수수의 주요 피해해충인 조명나방의 방제전략을 참고할 필요가 있다. 옥수수 재배지에서 발생하는 조명나방의 피해를 줄이기 위하여 국내 농가들은 화학살충제의 의존도가 높으며, 방제 약제로는 델타메트린 유제와 카보퓨란 입제 등 21개 품목이 등록되어 있다(Jung et al., 2021). 특히, Jung 등(2021)의 보고에서 조명나방의 효과적인 최적 방제시기를 결정하기 위해 살충제 처리시기, 성충 최대 밀도 형성기, 성충 밀도 누적 50% 시기를 기준으로 예측 모델을 제시하기도 한 점에서 플룩사메타마이드 살충제를 이용한 열대거세미나방의 방제 전략 수립 시 주목할 필요가 있다. 아직까지 국내에서 발견 되는 열대거세미나방에 대한 약제저항성 발달 여부는 보고 되지 않았지만, 본 연구에서 사용한 중국집단의 생물검정 결과를 바탕으로 약제 방제 효율의 증대와 저항성 관리를 위해 단제 보다는 합제의 사용이나 작용기작이 서로 다른 약제를 교호살포하는 것이 바람직할 것으로 판단된다.
Acknowledgments
이 연구는 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원(과제번호: RS-2024-00357273)을 받아 수행되었다.
이해상충관계
본 원고의 저자는 이해상충관계가 없음을 선언합니다.
REFERENCES
-
Ahmad S, Forgash AJ, 1975. Toxicity of Carbaryl and Diazinon to gypsy moth larvae: changes in relation to larval growth. J. Econ. Entomol. 68(6):803-806.
[https://doi.org/10.1093/jee/68.6.803]

-
Asahi M, Kobayashi M, Kagami T, Nakahira K, Furukawa Y, et al., 2018. Fluxametamide: A novel isoxazoline insecticide that acts via distinctive antagonism of insect ligand-gated chloride channels. Pestic. Biochem. Physiol. 151:67-72.
[https://doi.org/10.1016/j.pestbp.2018.02.002]

-
Bouvier JC, Boivin T, Beslay D, Sauphanor B, 2002. Age dependent response to insecticides and enzymatic variation in susceptible and resistant codling moth larvae. Arch. Insect Biochem. Physiol. 51(2):55-66.
[https://doi.org/10.1002/arch.10052]

- CABI, 2019. Datasheet. Spodoptera frugiperda (fall armyworm). Invasive Species Compendium. https://www.cabi.org/isc/datasheet/29810, (accessed on February 10, 2025).
- Cho SR, Kyung Y, Shin S, Kang WJ, Jung DH, et al., 2018. Susceptibility of Field Populations of Plutella xylostella and Spodoptera exigua to Four Diamide Insecticides. Korean J. Appl. Entomol. 57(1):43-50. (In Korean)
-
Choi DY, Mo H, Park Y, 2023. Different development and fecundity between Spodoptera frugiperda USA and China population, influenced by ecdysone-related genes. Arch. Insect Biochem. Physiol. 115:e22074.
[https://doi.org/10.1002/arch.22074]

-
Day R, Abrahams P, Bateman M, Beale T, Clottey V, et al., 2017. Fall armyworm: impacts and implications for Africa. Outlooks on Pest Manag. 28(5):196-201.
[https://doi.org/10.1564/v28_oct_02]

-
Dumas P, Legeai F, Lemaitre C, Scaon E, Orsucci M, et al., 2015. Spodoptera frugiperda (Lepidoptera: Noctuidae) host-plant variants: two host strains or two distinct species? Genetica 143(3):305-316.
[https://doi.org/10.1007/s10709-015-9829-2]

- Folmer O, Black M, Hoeh W, Lutz R, Vrijenhoek R, 1994. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates. Mol. Mar. Biol. Biotechnol. 3(5):294-299.
-
Goergen G, Kumar PL, Sankung SB, Togola A, Tamò M, 2016. First report of outbreaks of the fall armyworm Spodoptera frugiperda (J E Smith) (Lepidoptera, Noctuidae), a new alien invasive pest in West and Central Africa. PLoS ONE 11:e0165632.
[https://doi.org/10.1371/journal.pone.0165632]

-
Gokulanathan A, Mo H, Park Y, 2024. Glucose influence cold tolerance in the fall armyworm, Spodoptera frugiperda via trehalase gene expression. Sci. Rep. 14:27334.
[https://doi.org/10.1038/s41598-024-79082-y]

-
Gutiérrez-Moreno R, Mota-Sanchez D, Blanco CA, Whalon ME, Terán-Santofimio H, et al. 2019. Field-evolved resistance of the fall armyworm (Lepidoptera: Noctuidae) to synthetic insecticides in Puerto Rico and Mexico. J. Econ. Entomol. 112(2):792-802.
[https://doi.org/10.1093/jee/toy372]

- Heo J, Kim S, Kim DS, 2021. Migratory and subsequent generation-related damage patterns of Spodoptera frugiperda in corn plants in Jeju, South Korea. Korean J. Appl. Entomol. 60(2):221-228. (In Korean)
-
Jeong IH, Kim L, Kim SH, Lee JH, Yoon KA, et al., 2023. Insecticidal response of 14 insecticides against Korean Bemisia tabaci local populations. Korean J. Environ. Biol. 41(4):627-636. (In Korean)
[https://doi.org/10.11626/KJEB.2023.41.4.627]

- Jung JK, Seo BY, Jeong IH, Kim EY, Lee SW, 2021. Application timings of insecticides to control the first generation of the Asian corn borer, Ostrinia furnacalis in waxy maize field. Korean J. Appl. Entomol. 60(4):431-448. (In Korean)
- Jung JK, Kim EY, Kim IH, Seo BY, 2020. Species identification of Noctuid potential pests of soybean and maize, and estimation of their annual adult emergence in Suwon, Korea. Korea J. Appl. Entomol. 59(2):93-107. (In Korean)
-
Johnson SJ, 1987. Migration and the life history strategy of the fall armyworm, Spodoptera frugiperda in the Western Hemisphere. Int. J. Trop. Insect Sci. 8(4-6):543-549.
[https://doi.org/10.1017/S1742758400022591]

- Kagami T, Hori M, Haruyama H, 2017. Studies on a novel insecticide, fluxametamide (Part 2) biological activity. Abstr. Annu. Meeting Pestic. Sci. Soc. Jpn. 83:35.
-
Kulye M, Mehlhorn S, Boaventura D, Godley N, Venkatesh SK, et al. 2021. Baseline susceptibility of Spodoptera frugiperda populations collected in India towards different chemical classes of insecticides. Insects 12(8):758.
[https://doi.org/10.3390/insects12080758]

- Lee GS, Seo BY, Lee J, Kim H, Song JH, et al. 2020. First report of the fall armyworm, Spodoptera frugiperda (Smith, 1979) (Lepidoptera, Noctuidae), a new migratory pest in Korea. Korean J. Appl. Entomol. 59(1):73-78.
-
Li C, Liao J, Ya Y, Liu J, Li J, et al., 2022. Analysis of potential distribution of Spodoptera frugiperda in western China. J. Asia Pac. Entomol. 25(4):101985.
[https://doi.org/10.1016/j.aspen.2022.101985]

-
Li XJ, Wu MF, Ma J, Gao BY, Wu QL, et al. 2020. Prediction of migratory routes of the invasive fall armyworm in eastern China using a trajectory analytical approach. Pest Manag. Sci. 76(2):454-463.
[https://doi.org/10.1002/ps.5530]

-
Liu X, Liy F, Tang T, Wang J, Wang Y, et al., 2024. Comparative insecticidal activity and mechanism of isocycloseram versus other GABAergic insecticides against the fall armyworm. J. Agric. Food Chem. 72(34):18816-18823.
[https://doi.org/10.1021/acs.jafc.4c02866]

-
Mita T, Furukawa Y, Iwasa M, Kikuchi T, Komoda M, 2021. Studies on a novel insecticide, fluxametamide. In Recent Highlights in the Discovery and Optimization of Crop Protection Products; Maienfisch, P., Mangelinckx, S., Eds.; Academic Press Publishers: Cambridge, MA, USA, pp. 157- 163.
[https://doi.org/10.1016/B978-0-12-821035-2.00007-3]

-
Mitchell ER, McNeil JN, Westbrook JK, Silvain JF, Lalanne- Cassou B, et al., 1991. Seasonal periodicity of fall armyworm, (Lepidoptera: Noctuidae) in the Caribbean Basin and northward to Canada. J. Entomol. Sci. 26(1):39-50.
[https://doi.org/10.18474/0749-8004-26.1.39]

-
Murúa G, Molina-Ochoa J, Coviella C, 2006. Population dynamics of the fall armyworm, Spodoptera frugiperda (Lepidoptera: Noctuidae) and its parasitoids in northwestern Argentina. Fl. Entomol. 89(2):175-182.
[https://doi.org/10.1653/0015-4040(2006)89[175:PDOTFA]2.0.CO;2]

-
Naghoshi RN, Meagher RL, 2022. The Spodoptera frugiperda host strains: what they are and why they matter for understanding and controlling this global agricultural pest. J. Eco. Entomol. 115(6):1729-1743.
[https://doi.org/10.1093/jee/toac050]

-
Nagoshi RN, Goergen G, Tounou KA, Agboka K, Koffi D, et al., 2018. Analysis of strain distribution, migratory potential, and invasion history of fall armyworm populations in northern Sub-Saharan Africa. Sci. Rep. 8:3710.
[https://doi.org/10.1038/s41598-018-21954-1]

-
Overton K, Manio JL, Day R, Umina PA, Bett B, et al. 2021. Global crop impacts, yield losses andaction thresholds for fall armyworm (Spodoptera frugiperda): a review. Crop. Prot. 145:105641.
[https://doi.org/10.1016/j.cropro.2021.105641]

-
Pashley DP, 1986. Host-associated genetic differentiation in fall armyworm (Lepidoptera: Noctuidae): a sibling species complex?. Entomol. Soc. Am. 79(6):898-904.
[https://doi.org/10.1093/aesa/79.6.898]

-
Prabhaker N, Toscano NC, Coudriet DL, 1989. Susceptibility of the immature and adult stages of the sweet potato whitefly (Homoptera: Aleyrodidae) to selected insecticides. J. Econ. Entomol. 82(4):953-958.
[https://doi.org/10.1093/jee/82.4.953]

-
Rodriguez-Saona C, Wanumen AC, Salamanca J, Holdcraft R, Kyryczenko-Roth V, 2016. Toxicity of insecticides on various life stages of two tortricid pests of cranberries and on a nontarget predator. Insects 7(2):15-34.
[https://doi.org/10.3390/insects7020015]

- RDA, 2022. Studies on occurrence, monitoring and control techniques of Spodoptera frugiperda. R&D research final report. Jeonju. Korea. (In Korean)
-
Roy D, Biswas S, Sarkar S, Adhikary S, Chakaborty G, et al. 2023. Risk assessment of fluxametamide resistance and fitness costs in fall armyworm (Spodoptera frugiperda). Toxics 11(4):307.
[https://doi.org/10.3390/toxics11040307]

- SAS Institute Inc. 1989. SAS/STAT User’s guide. Cary, NC.
-
Sparks AN, 1986. Fall armyworm (Lepidoptera: Noctuidae): Potential for area-wide management. Fla. Entomol. 69(3): 603-614.
[https://doi.org/10.2307/3495397]

-
Sparks TC, Storer N, Porter A, Slater R, Nauen R, 2021. Insecticide resistance management and industry: The origins and evolution of the Insecticide Resistance Action Committee (IRAC) and the mode of action classification scheme. Pest Manag. Sci. 77(6):2609-2619.
[https://doi.org/10.1002/ps.6254]

-
Sparks TC, Nauen R, 2015. IRAC: Mode of action classification and insecticide resistance management. Pest. Biochem. Physiol. 121:122-128.
[https://doi.org/10.1016/j.pestbp.2014.11.014]

-
Umetsu N, Shirai Y, 2020. Development of the novel pesticides in the 21st century. J. Pestic. Sci. 45(2):54-74.
[https://doi.org/10.1584/jpestics.D20-201]

-
Vatanparast M, Park Y, 2022. Differential transcriptome analysis reveals genes related to low- and high-temperature stress in the Fall armyworm, Spodoptera frugiperda. Front. Physiol. 12:827077.
[https://doi.org/10.3389/fphys.2021.827077]

-
Wang KY, Kong XB, Jiang XY, Yi MQ, Liu TX, 2003. Susceptibility of immature and adult stages of Trialeurodes vaporariorum (Hom., Aleyrodidae) to selected insecticides. J. Appl. Entomol. 127(9-10):527-553.
[https://doi.org/10.1111/j.1439-0418.2003.00778.x]

-
Westbrook JK, Nagoshi RN, Meagher RL, Fleischer SJ, Jairam S, 2016. Modeling seasonal migration of fall armyworm moths. Int. J. Biometeorol. 60:255-267.
[https://doi.org/10.1007/s00484-015-1022-x]

-
Wyckhuys KAG, O’Neil RJ, 2006. Population dynamics of Spodoptera frugiperda Smith (Lepidoptera: Noctuidae) and associated arthropod natural enemies in Honduran subsistence maize. Crop Prot. 25(11):1180-1190.
[https://doi.org/10.1016/j.cropro.2006.03.003]

-
Yu SJ, 1992. Detection and biochemical characterization of insecticide resistance in fall armyworm (Lepidoptera: Noctuidae). J. Econ. Entomol. 85(3):675-682.
[https://doi.org/10.1093/jee/85.3.675]

Hyemi Park, Plant Quarantine Technology Center, Animal and Plant Quarantine Agency, Researcher, Methodology, Data analysis & Original draft writing.
Hyoung-ho Mo, Plant Quarantine Technology Center, Animal and Plant Quarantine Agency, Research Scientist, Data analysis & Writing manuscript.
Youngjin Park, Department of Plant Medicals, Andong National University, Professor, https://orcid.org/0000-0002-4526-0805, Research Design, Investigation & Writing manuscript.