사과 흰비단병 방제를 위한 살균제 선발 및 살포 체계 개발
 ; Jun-Woo Choi1 ; Seong-Keun Lim1 ; Hae-Dam Kim1 ; Seo-Ryeong Lee1 ; In-Kyu Kang2 ; Seung-Yeol Lee1, 3, *
; Jun-Woo Choi1 ; Seong-Keun Lim1 ; Hae-Dam Kim1 ; Seo-Ryeong Lee1 ; In-Kyu Kang2 ; Seung-Yeol Lee1, 3, * ; Hee-Young Jung1, 3
; Hee-Young Jung1, 3
초록
2023년 8월 경상북도 영천시 소재 사과 묘목장에서 Agroathelia rolfsii에 의한 사과 흰비단병이 관찰되었다. 현재까지 국내 사과에는 흰비단병 방제용 살균제가 등록되지 않았으므로, 살균제 희석배지를 이용하여 사과에 등록 된 20개의 살균제를 대상으로 사과흰비단병균의 균사 생장 및 균핵 발아를 효과적으로 억제할 수 있는 약제를 선발 하였다. 그 결과, fluxapyroxad SC, pyraziflumid SC, fluazinam WP, difenoconazole WG, metconazole SC, myclobutanil WP, tebuconazole SC, prochloraz manganese WP, 및 mancozeb WP에서 90% 이상의 높은 균사 및 균핵 생장 억제율이 확인되었다. 최종적으로 선발된 약제를 증상이 나타난 사과 묘목장에 관주 처리하여 현장에서 방제 효과를 확인하였다. 그 결과, 5월 중순부터 8월 하순까지 살균제를 8회 관주 처리하였을 때 무처리구의 발병주율은 49%인 반면, 처리구에서는 14%로 조사되었다. 본 연구에서 개발한 살균제 및 방제체계를 활용하여 사과 묘목장에서 발생하는 흰비단병을 억제할 수 있을 것으로 사료된다.
Abstract
In August 2023, apple southern blight caused by Agroathelia rolfsii were observed on the apple rootstocks (Malling 9) in apple nursery tree fields located in Yeongcheon-si, Gyeongbuk province in Korea. Since no fungicides have been registered in Korea for controlling the A. rolfsii on apples, we evaluated the efficacy of 20 fungicides which registered on apple using fungicide-amended media to find efficacy for inhibiting mycelial growth and sclerotial germination. As a result, fluxapyroxad SC, pyraziflumid SC, fluazinam WP, difenoconazole WG, metconazole SC, myclobutanil WP, tebuconazole SC, prochloraz manganese WP and mancozeb WP exhibited over 90% efficacy in inhibiting mycelial growth and sclerotial germination. The selected fungicides were then applied to the affected apple nursery via soil drench treatment to evaluate their efficacy under field conditions. As a result, after eight applications from mid-May to late August, disease incidence rate was 49% in the untreated control group, whereas it was reduced to 14% in the treated group. It is assumed that developed fungicide program can be expected to control the occurrence of southern blight in apple nurseries.
Keywords:
Agroathelia rolfsii, Apple rootstock, Southern blight, Fungicides키워드:
흰비단병, 살균제, 사과 묘목서 론
사과(Malus × domestica Borkh.)는 33,313 ha의 재배 면적과 460,088 ton의 생산량을 차지하며, 국내에서 경제적으로 매우 중요한 과수 중 하나이다(KOSIS, 2025). 국내에서는 1990년 이후 왜성 대목이 도입됨에 따라 밀식 재배가 이루어졌으며, 이를 통해 노동효율, 과실의 품질 및 생산성이 향상됨과 동시에 병해충 관리 또한 용이하게 되었다(Choi et al., 2023; Park, 2024). 국외에서는 Cornell-Geneva, Geneva 및 Malling-Merton 시리즈를 포함한 다양한 종류의 사과 대목이 사용되고 있으나, 국내에서는 Malling 9 (M.9) 대목과 Malling 26 (M.26) 대목이 널리 이용되고 있다(Wang et al., 2019; Jeon et al., 2024). 또한 왜성 대목의 사용으로 인해 토양전염성 병원균인 Agroathelia rolfsii에 의한 흰비단병의 피해가 심각해지고 있다(Dong et al., 2022). A. rolfsii는 전 세계적으로 땅콩, 감자, 토마토 등 500종 이상의 식물에 발 생한다고 알려져 있으며, 사과나무에 발생할 경우 가장 먼저 뿌리에서 시작하여 줄기가 부패하고 잎이 시들어 결국 고사하게 된다(Kator et al., 2015; Nandi et al., 2017). 또한, 발병 시 묘목의 고사율이 최대 20%까지 증가하며, 줄기가 얇은 묘목 및 1년생에서 3년생까지의 어린 나무가 취약한 것으로 알려져 있다(Dong et al., 2022). 특히 A. rolfsii는 인접한 나무로 쉽게 전염되며, 이때 토양 내에서 균핵 상태로 장기간 생존하거나 토양이나 흐르는 물을 통해 쉽게 이동하는 특성이 보고된 바 있다(Billah et al., 2017; Dong et al., 2022). 국내에서는 왜성 대목을 이용한 밀식 재배로 인해 재식 거리가 짧아 이 병원균에 의한 피해가 더욱 심각한 문제로 대두되고 있다(Choi et al., 2021; Choi et al., 2023). 이러한 A. rolfsii에 의한 피해를 방지하기 위해 국외에서는 다양한 화학적방제에 대한 연구가 진행되고 있으며, 국내에서 ‘다2’군, ‘다3’군, ‘사1’군 등에 속하는 살균제를 고추, 감자, 딸기 등 다양한 기주의 흰비단병 방제를 시도하고 있다(Patra et al., 2023; Rural Development Administration, 2025). 하지만 국내에서는 사과 흰비단병에 등록된 살균제나 방제 체계가 없어, 농가 및 묘목장에서는 해당 병해를 방제하기 위한 대책이 부족한 실정이다. 따라서, 본 연구에서는 경상북도 영천시 소재의 사과 묘 목장에서 발생하는 병원균을 분리 및 동정하고, 분리된 병원균을 대상으로 20종의 살균제에 대한 감수성 검정을 진행하여 균사 생장 및 균핵 발아 억제에 효과적인 약제를 선발하였다. 또한, 선발된 약제를 사과 묘목장에 처리하여 현장에서의 방제 효과를 조사하였다.
재료 및 방법
병원균 분리 및 동정
병원균의 분리를 위해 이병 묘목에서 관찰된 흰색 균사를 감자한천배지(potato dextrose agar, PDA, Difco, Detroit, MI)에 치상한 후 25°C 항온기에서 3일간 배양하였다. 이 후, 형성된 단일 균총을 새로운 배지에 옮겨 4일간 25°C 항온기에서 배양하였으며, 분리된 균주를 KNUF-YCA01로 명명하고 해당 균주의 배양학적 및 형태학적 특징을 조사하였다. 추가적으로, KNUF-YCA01 균주의 분자생물학적 동정을 위하여 HiGene Genomic DNA prep kit (BIOFACT, Daejeon, Korea)를 사용하여 t otal genomic DNA를 추출하였고, ITS1F/ ITS4B 프라이머를 이용하여 ITS 영역을 증폭하였다(Gardes and Bruns, 1993). 증폭된 PCR 산물은 ExoSAP-ITTM (Thermo Fisher Scientific, Waltham, MA)를 이용하여 정제한 뒤, Macrogen (Daejeon, Korea)에 의뢰하여 염기서열을 확보하였다. 확보된 염기서열은 National Center for Biotechnology Information (NCBI)의 Basic Local Alignment Search Tool (BLAST)를 통해 유사도를 확인한 후 동정하였다.
흰비단병균 생육 억제에 적합한 살균제 선발
국내 사과에 등록된 살균제를 기준으로 20종의 단제를 선정하여 실험을 진행하였다(Table 1). 선발한 살균제에 설정된 사용 권장 농도를 기반으로 약제 희석 배지를 제작하였으며, 이때 살균제별로 최종 농도가 정량(recommended dose) 및 반량(half of the recommended dose)이 되도록 PDA 배지에 희석하였다(Table 1). 확보한 병원균은 25°C에서 4일간 배양한 뒤, cork borer로 균총 선단에서 직경 4 mm의 균사 조각을 떼어내어 접종원으로 사용하였으며, 균핵 발아 억제 효과를 확인하기 위해 2주간 배양한 병원균의 균핵을 이용하여 접종원으로 사용하였다. 균사 조각과 균핵을 접종한 살균제 희석 배지는 4일간 25℃에 배양한 뒤 버니어 캘리퍼스를 사용하여 균총의 직경을 측정하고, 무처리구 대비 균사 생장 억제율을 산출하였으며, 모든 실험은 KNUF-YCA01 균주를 이용하여 각 약제에 대해 3반복으로 진행하였다.
살균제 프로그램의 포장 내 흰비단병 억제 효과 검정
한천희석법을 활용해 균사 생장 억제율이 높은 살균제 8종을 대상으로 사과 묘목장에서 약제별 방제 효과 검정을 수행하였다. 약제 처리 시기는 5월 중순부터 8월 하순까지로 설정하고, 14일 간격으로 토양 내 관주 처리하였다(Table 2). 살포 체계는 동일한 작용기작을 연속으로 살포하지 않도록 mancozeb WP, difenoconazole WG, fluxapyroxad SC, prochloraz manganese WP, fluazinam WP, tebuconazole SC, pyraziflumid SC, metconazole SC 순으로 진행하였다. 마지막 약제 처리 30일 후, 처리구와 대조구의 건전 묘목과 이병 묘목을 조사한 뒤, 전체 재식 주수 대비 비율로 발병주율을 산정하였다.
결과 및 고찰
사과흰비단병균의 분리 및 동정
2023년 8월 경상북도 영천시에 위치한 사과 묘목장에서 다수의 묘목이 고사하는 증상을 관찰하였으며(Fig. 1A and B), 고사한 묘목의 뿌리 및 지제부에서 흰색 균사와 밝은 갈색에서진한 갈색의 균핵이 다량 관찰되었다(Fig. 1C). 분리된 균주 KNUF-YCA01을 PDA 배지에 배양한 결과, 배양 4일차에 흰색 균총이 관찰되었고(Fig. 1D), 14일 후 1 – 3 mm 크기의 구형 또는 불규칙한 타원형의 갈색 균핵이 확인되었으며 광학 현미경을 통해 균사의 격벽과 clamp connection이 관찰되었다(Fig. 1E-H). 이러한 특징은 이전에 보고된 흰비단병균 (Agroathelia rolfsii)과 동일하였다(Mordue, 1974). 또한 획득된 ITS 영역의 염기서열을 BLAST 분석을 수행한 결과 GenBank에 기 등록된 Agroathelia rolfsii (accession no. KX643349) 균주의 염기서열과 100%의 상동성이 확인되었다.

Southern blight disease symptoms and fungal isolates from infected apple rootstocks. Wilt and death of apple rootstocks in field condition (A, B). Occurrence of white mycelia and sclerotia on apple rootstock root (C). Colonies grown on PDA after 4 days (D). Brown sclerotia on PDA (F). Micrographs of septate (G) and clamp connection (H). Black scale bar: 1000 μL; white scale bars: 10 μL.
흰비단병균 생육 억제에 적합한 살균제 선발
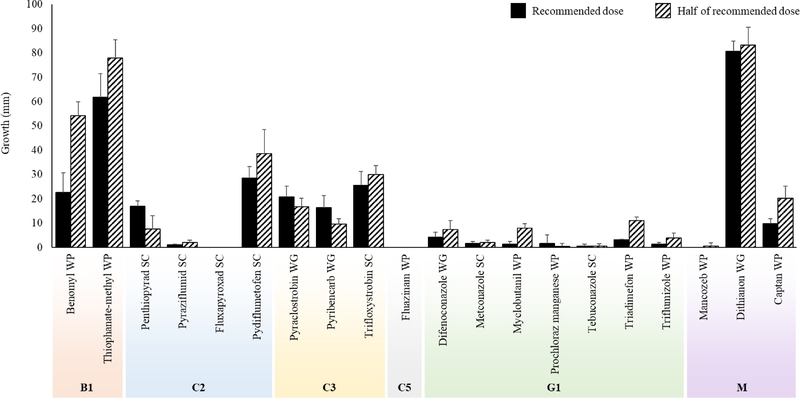
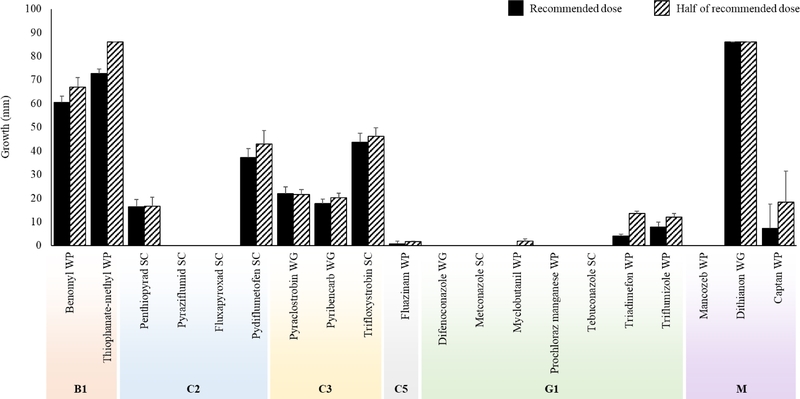
다양한 작용기작의 20종의 약제를 이용해 정량 및 반량 농도의 살균제 희석 PDA 배지를 제작하고 A. rolsii KNUFYCA01의균사 조각을 접종하여 각 약제의 균사 생장 억제 효과를 확인하였다(Fig. 2). 이중 다2 계통에 속하는 pyraziflumid SC와 fluxapyroxad SC, 사1 계통에 속하는 difenoconazole WG, metconazole SC, prochloraz manganese WP, tebuconazole SC, 그리고 카 계통에 속하는 mancozeb WP의 경우 정량 및 반량 모두 100%의 높은 생장 억제율을 보였다. 다5 계통에 속하는 fluazinam WP의 경우 정량과 반량에서 각각 99.1 및 98.0%의 생장 억제율을 나타내었으며, myclobutanil WP의 경우 100과 97.7%의 억제율을 보였다. 반면에 나1 계통에 속하 는 b enomyl WP의 경우 정량에서 29.7%, 반량에서 22.1%의 억제율을 나타내었으며, thiophanate-methyl WP는 정량과 반량에서 각각 15.5% 및 0%의 낮은 억제율을 보였다. 특히카 계통에 속하는 dithianon WG의 경우 정량 및 반량 모두에서 0%의 매우 낮은 균사 생장 억제율이 확인되었다. 또한, 제작된 살균제 희석배지에 균핵을 치상하여 약제별 균핵 발아 억제 효과를 확인한 결과 정량 및 반량 농도에서 균사 조각을 치상한 결과와 유사한 결과가 관찰되었다(Fig. 3). 따라서, 균사 생장 및 균핵 발아 억제 효과가 높았던 약제 중 8종(difenoconazole WG, fluazinam WP, fluxapyroxad SC, mancozeb WP, metconazole SC, prochloraz manganese WP, pyraziflumid SC, tebuconazole SC)의 약제를 선발하여 포장 내 방제 시험에 활용하였다.
Mycelial growth of Agroathelia rolfsii on agar plates amended with 20 different fungicides at the recommended dose and half of recommended dose. Error bars indicate standard deviation.
흰비단병 발생 포장 내 살균제 프로그램의 병 억제 효과 검정
실내 검정을 통해 균사 억제 효과가 높은 8종의 약제를 선발하여 증상이 나타난 사과 묘목장에 2주 간격으로 관주 처리하였다. 최종 약제 처리 30일 후 무처리구와 처리구의 발병주율을 비교한 결과, 무처리구에서는 총 3,711개의 묘목 중 1,828개의 발병주가 관찰되어 약 49%의 발병주율이 확인되었고, 처리구에서는 총 5,258개의 묘목 중 758개의 묘목에서 흰비단병이 발병되어 14%의 발병주율이 확인되어, 무처리구 대비 발병억제율은 약 70%로 효과적으로 흰비단병의 발생을 억제 시킨것으로 확인되었다(Fig. 4).
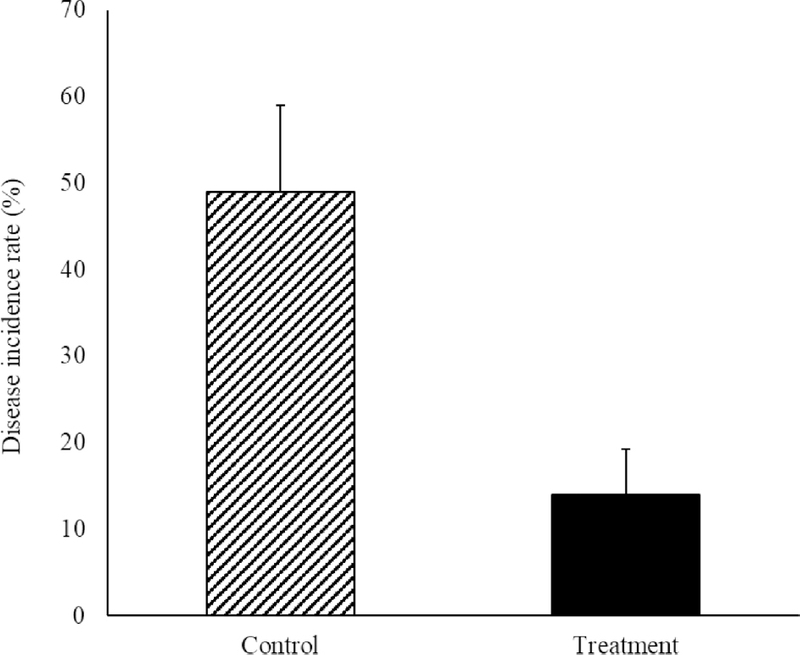
Disease incidence rate of southern blight caused by Agroathelia rolfsii on apple rootstocks. Error bars indicate standard deviation.
A. rolfsii는 심각한 토양전염성 병원균이며, 국내에서 감자, 강낭콩, 고추, 딸기, 사과나무 등 다양한 작물에서 발생 한다(Dwivedi and Prasad, 2016; KSPP, 2025). A. rolfsii의 균사는 7 – 40oC의 온도 범위에서 생장이 가능하며, 균핵은 15 – 36oC에서 발아 가능한 것으로 알려져있다(Dong et al., 2022). 최근 기후변화로 인해 기온이 따뜻해지면서 흰비단병의 발생 지역이 확대될 것으로 예상되며, 기주 범위 역시 확대되며 심각성이 증가할 것으로 예측된다(Jeon et al., 2020). 또한, 국내 사과 재배지에서 주요하게 사용되고 있는 M.9 및 M.26 대목은 A. rolfsii에 의한 흰비단병에 높은 감수성을 보이며, 감염 시 묘목의 고사율이 높은 것으로 나타났다 (Choi et al., 2021) 특히, 국내에서 가장 많이 사용되는 M.9 대목은 M.26보다 더 높은 묘목 고사율을 보였다(Choi et al., 2021). 국내에서는 고구마, 고추, 땅콩을 포함한 16개 작물에서 발생하는 흰비단병을 방제하기 위해 ‘다2’군, ‘사1’군 등에 속하는 약제가 등록되어 있다(Rural Development Administration, 2025). 그러나 사과 묘목에서 발생하는 흰비단병을 방제하기 위한 약제는 현재까지 등록되지 않았다. 또한, A. rolfsii에 의해 형성된 균핵은 월동을 하는데 중요한 역할을 하는 것으로 알려져 있어 균핵의 생육 억제 효과에 대한 검정 역시 필수적이다(Ayed et al., 2018). 본 연구에서는 다양한 작용 기작의 약제를 이용하여 A. rolfsii의 균사 생장 및 균핵발아 억제 효과를 확인하였으며, 향 후 사과 묘목에서 발생하는 흰비단병의 효율적인 방제 체계를 구축할 수 있는 기초 자료가 될 것으로 기대된다. 다만 본 연구에서는 사과에 등록된 약제를 대상으로 실험을 수행하였으나, 차 후 사과 흰비단병에 대한 살균제 등록을 통해 정확한 처리방법 및 시기 등에 대한 연구가 필요할 것으로 판단된다.
Acknowledgments
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
REFERENCES
-
Ayed F, Jabnoun-Khiareddine H, Aydi Ben Abdallah R, Daami- Remadi M, 2018. Effect of temperatures and culture media on Sclerotium rolfsii mycelial growth, sclerotial formation and germination. J. Plant Pathol. Microbiol. 9:8.
[https://doi.org/10.4172/2157-7471.1000446]

- Billah KMM, Hossain MB, Prince MH, Sumon MMP, 2017. Pathogenicity of Sclerotium rolfsii on different host, and its over wintering survival; a mini review. Int. J. Adv. Agric. Sci. 2(7):1-6.
-
Choi BH, Kim CS, Jeong YJ, Jeon JH, Shin BY, et al., 2023. Configuration of the tree shape in a bi-axis apple orchard using ‘Fuji’/M.9 grafted plants – tree growth and productivity during early years according to the planting distance. Hortic. Sci. Technol. 41(5):560-570. (In Korean)
[https://doi.org/10.7235/HORT.20230048]

-
Choi BH, Kim CS, Jeong YJ, Park IH, Han SG, et al., 2021. Resistance evaluation of G, CG, or M series apple rootstocks to soil-borne disease (phytophthora root rot, root rot, white root rot, and southern blight) and woolly apple aphid. Hortic. Sci. Technol. 39(2):167-174.
[https://doi.org/10.7235/HORT.20210015]

-
Dong X, Gao C, Li P, Lian S, Zhou S, et al., 2022. Effects of temperature, moisture, substrates and soil coverage on sclerotium germination and hyphal growth of southern blight of apple in China. Eur. J. Plant Pathol. 162:477-487.
[https://doi.org/10.1007/s10658-021-02418-1]

- Dwivedi SK, Prasad G, 2016. Integrated management of Sclerotium rolfsii: an overview. Eur. J. Biomed. Pharm. Sci. 3(11):137-146.
-
Gardes M, Bruns TD, 1993. ITS primers with enhanced specificity for basidiomycetes-application to the identification of mycorrhizae and rusts. Mol. Ecol. 2(2):113-118.
[https://doi.org/10.1111/j.1365-294X.1993.tb00005.x]

-
Jeon CW, Kim DR, Kwak YS, 2020. First report of southern blight caused by Sclerotium rolfsii on Amaranthus mangostanus and fungicides selection. Korean J. Pestic. Sci. 24(1):1-6. (In Korean)
[https://doi.org/10.7585/kjps.2020.24.1.1]

-
Jeon JH, Yoon TM, Ban S, 2024. Survey on cultivation practices and pest management in Korean apple orchards. Korean J. Pestic. Sci. 28(3):227-240. (In Korean)
[https://doi.org/10.7585/kjps.2024.28.3.227]

- Kator L, Hosea ZY, Oche OD, 2015. Sclerotium rolfsii; causative organism of southern blight, stem rot, white mould and sclerotia rot disease. Ann. Biol. Res. 6(11):78-89.
- KOSIS (Korean Statistical Information Service), 2025. Fruits production. http://www.kosis.kr, (Accessed Feb. 10. 2025).
- KSPP (The Korean Society of Plant Pathology), 2025. List of plant disease in Korea. https://genebank.rda.go.kr, (Accessed Feb. 10. 2025).
- Mordue JEM, 1974. CMI descriptions of pathogenic fungi and bacteria. No. 410. CAB International, Wallingford, UK.
-
Nandi S, Hembaram S, Adhikari A, Tiwari BK, Dutta S, 2017. Host infection beyond the traditional range of Sclerotium (Athelia) rolfsii with Physalis minima. Bioinformation 13(10): 333-338.
[https://doi.org/10.6026/97320630013333]

-
Park IH, Han SG, Kim CS, Jeong YJ, Jeon JH, et al., 2024. Early performance of multi-leader apple training systems in Korea. Hortic. Sci. Technol. 42(1):104-116. (In Korean)
[https://doi.org/10.7235/HORT.20240009]

-
Patra GK, Acharya GK, Panigrahi J, Mukherjee AK, Rout GR, 2023. The soil-borne fungal pathogen Athelia rolfsii: past, present, and future concern in legumes. Folia Microbiol. 68:677-690.
[https://doi.org/10.1007/s12223-023-01086-4]

- Rural Development Administration, 2025. Pesticide safety information system. https://psis.rda.go.kr, (Accessed Feb. 10. 2025).
-
Wang Y, Li W, Xu X, Qiu C, Wu T, et al., 2019. Progress of apple rootstock breeding and its use. Hortic. Plant J. 5(5):183-191.
[https://doi.org/10.1016/j.hpj.2019.06.001]

Jin-Sil Choi, Department of Plant Medicine, Kyungpook National University, Master course student, data analysis, and first draft preparation, https://orcid.org/0009-0002-8605-1804.
Jun-Woo Choi, Department of Plant Medicine, Kyungpook National University, Master course student, Experimentation.
Seong-Keun Lim, Department of Plant Medicine, Kyungpook National University, Ph.D course student, Fungal isolation and support classification.
Hae-Dam Kim, Department of Plant Medicine, Kyungpook National University, Master course student, Support data analysis.
Seo-Ryeong Lee, Department of Plant Medicine, Kyungpook National University, Master course student, Support data analysis.
In-Kyu Kang, Department of Horticultural Science, Kyungpook National University, Professor, Methodology.
Seung-Yeol Lee, Department of Plant Medicine, Kyungpook National University, Associate Professor, Supervision, manuscript review and editing, https://orcid.org/0000-0003-1676-0330.
Hee-Young Jung, Department of Plant Medicine, Kyungpook National University, Professor, Manuscript review and editing. https://orcid.org/0000-0002-4254-3367.