농작업자의 Kresoxim-methyl과 fenthion에 대한 호흡노출량 측정을 위한 IOM 채집기의 효율성 평가
초록
본 연구는 농작업자의 호흡노출 측정에 사용되어오던 고체흡착제 외에 최근에 사용되는 유리섬유여과지가 장착된 IOM 채집기에 대해서, 고체 제제인 kresoxim-methyl 입상수화제와 액상 제제인 fenthion 유제를 이용하여 포집효율과 파과율을 측정하여 효율성을 검증하고자 하였다. LC-MS/MS 기기상 최소검출량은 12.5 pg, 분석법상 검출한계는 5.0 ng/mL이었고, 각 노출 시료의 matrix matched standard의 직선성은 R2 값이 0.999 이상이었다. 사용된 유리섬유여과지와 고체흡착제에서의 두 가지 농약의 회수율은 유리섬유여과지는 kresoxim-methyl 102-109%, fenthion 97-104%, XAD-2 resin 고체흡착제는 각각 94-98%, 93-100%이었다. 포집효율은 IOM 채집기(유리섬유여과지 장착)와 고체흡착제(XAD-2 resin)를 연결한 후 개인용 공기펌프에 연결하여 측정하였다. 고체 및 액상 2가지 제제를 표준 배율로 희석하여 IOM 채집기에 분무하여 포집효율을 본 결과 두 제제 모두 유리섬유여과지에 포집되었고 고체흡착제로 통과되지 않았다. 파과시험은 IOM 채집기의 유리섬유여과지에 농약 표준 용액을 가하고 고체흡착제를 연결한 후 개인용 공기펌프에 연결하여 측정하였다. 파과시험 결과, kresoxim-methyl은 87-101%, fenthion은 96-105%가 첫 번째 유리섬유여과지에 흡착/보유되어 있었고 두 번째 유리섬유여과지나 고체흡착제로 파과되지 않았다. 따라서 유리섬유여과지가 장착된 IOM 채집기는 고체 제제나 액상 제제나 상관없이 포집효율과 흡착/보유 능력이 뛰어난 것으로 검증되어 농약 호흡노출 연구에 적극 활용될 것으로 판단한다.
Abstract
An IOM sampler equipped with glass fiber filter has been recently utilized instead of solid adsorbent, which was used to measure the inhalation exposure of agricultural operator to pesticides. The aim of this study is to validate the efficacy of an IOM sampler by measuring the trapping efficiency and breakthrough using kresoxim-methyl water-dispersible granule and fenthion emulsifiable concentrate. On LC-MS/MS, minimum detection level was 12.5 pg and method limit of detection was 5.0 ng/mL. Good linearity (R2 > 0.999) for matrix matched standards was obtained. Recoveries of pesticides from glass fiber filter were 102-109% (kresoxim-methyl) and 97-104% (fenthion) while those from XAD-2 resin were 94-98% (kresoxim methyl) and 93-100% (fenthion). Trapping efficiency test was performed with personal air pumps and IOM sampler (glass fiber filter) connected with solid adsorbent (XAD-2 resin) with two types of formulation (solid and liquid) which were diluted by standard rate and sprayed to IOM sampler. Those pesticides were trapped only in glass fiber filter without any breakthrough to solid adsorbent. After spiking of pesticides to glass fiber filter, breakthrough test was carried out with IOM sampler (glass fiber filter) which was connected with solid adsorbent. As a results, 87-101% of kresoxim-methyl and 96-105% of fenthion remained in spiked glass fiber filter, however, no pesticides were detected in second glass fiber filter and solid adsorbent. In conclusion, IOM sampler which equipped with glass fiber filter can be applied widely for pesticide inhalation exposure study since it has good trapping efficiency and adsorption capacity, regardless of the solid or liquid formulation.
Keywords:
kresoxim-methyl, fenthion, inhalation exposure, IOM sampler, glass fiber filter키워드:
호흡노출, IOM 채집기, 유리섬유여과지서 론
농작업자의 영농 활동 중 농약의 조제, 살포, 수확 등의 여러 작업 상황에서 신체부위를 통한 농약의 접촉을 농약노출(pesticide exposure)이라 한다(Crosby, 1998; Ramwell et al., 2006; Ramos et al., 2010, Kim et al., 2011). 농약과 농작업자의 직접적인 접촉은 농작업자의 건강 위해성을 초래할 수 있고, 이러한 위해성은 농약의 독성과 노출량에 따라 달라진다(Turnbull, 1985). 농약의 독성 정도는 화합물 자체의 고유특성으로 국제적으로 표준화된 시험법을 통해 결과를 얻고 그 독성치는 자료화 되어서 많은 출처에서 찾아서 이용할 수 있지만 농약 노출량은 해당 국가, 지역, 환경 및 기후 조건에 적합한 영농 활동시의 상황(작업의 종류, 작업 시간 등)에 따라 다르기 때문에(Turnbull, 1985; Fenske and Day JR, 2005; Hughes et al., 2008; Grobkopf et al., 2013) 실제 그 장소에서 해당 포장 상황에서의 노출량을 측정해서 위해평가에 이용해야 한다. 따라서 해당 영농 활동 시정확한 노출량 측정은 합리적 위해 평가의 매우 중요한 요소이다.
농작업자의 농약 사용 시 노출의 주요 경로는 피부노출과 호흡노출이다(Fenske and Day JR, 2005; Hughes et al., 2008; Chester, 2010; Behroozy, 2013). 피부노출 측정은 주로 패치법(patch)을 사용해 왔으며(Chester, 1993; Fenske, 1993; Soutar et al., 2000; Chester, 2010; Farahat et al., 2010; Wassie et al., 2012; Behroozy, 2013; Abukari, 2015; An et al., 2015; Zhao et al., 2015) 대부분의 국내 노출 연구 또한 패치법을 주로 이용하였다(Liu, 2003; Kang et al., 2004; Choi et al., 2006; Kim et al., 2011aKim et al., 2012a,bChoi and Moon, 2013; Kim et al., 2013; Moon et al., 2013; Choi, 2014). 패치법은 사용하기 편리하고 경제적이지만 작은 면적의 패치를 실제 체표면적으로 외삽하는 과정에서 과대, 과소평가되는 경향이 있고, 실제 작업복과 재질 차이로 인하여 농약의 흡착 정도가 달라 정확한 노출량을 측정하기 어려운 단점이 있다(Franklin et al., 1981; Fenske, 1990; Niven et al., 1993; Tannahill et al., 1996; Cao et al., 2015). 이를 보완하기 위하여 전신복장노출법(Whole Body Dosimetry; WBD)을 사용하여 피부노출량을 측정하는데, 이 방법은 전신작업복을 입고 작업을 수행한 후, 작업복 전체를 추출, 분석하기 때문에 전신작업복의 사용, 비교적 장시간의 노출 시료 채취 과정, 분석시 용매의 다량 소비 등 패치법과 비교하여 상대적으로 불편하고 비경제적이지만, 노출량의 외삽 과정 없이 실제 피부노출량을 현실적으로 측정할 수 있다(Chester 1993; Fenske, 1993; OECD, 1997; Castro Cano et al., 2000; Machera et al., 2003; Hughes et al., 2006; Hughes et al., 2008; Lesmes-Fabian et al., 2012; Gao et al., 2013; Grobkopf et al., 2013; An et al., 2014; Abukari, 2015; Cao et al., 2015). 최근, 국내에서도 전신복장노출법을 이용하여 수박 시설재배시 농작업자의 피부노출량을 측정한 논문이 보고되었으며(Kim et al., 2014), 전신작업복 속에 내복을 입고 내복의 농약 오염량까지 측정한 연구도 보고되었다(Grobkopf et al., 2013; An et al., 2014; Kim et al., 2014).
호흡노출은 피부노출에 비해 대개 0.0-9.1% 이하로 그 양이 적지만(Culver et al., 1956; Miller et al., 1980; WHO, 1982; Wojeck et al., 1983; USEPA, 1996; Capri et al., 1999; Oliveira and Machado-Neto, 2003; Choi et al., 2006; Kim et al., 2011a,bKim et al., 2012a,bChoi and Moon, 2013; Moon et al., 2013; Kim et al., 2014), 노출량 100%가 몸에 흡수되는 것으로 가정하기 때문에(Fenske and Day JR, 2005; Franklin and Worgan, 2005, Kim et al., 2011a, Choi and Moon, 2013; Moon et al., 2013; Kim et al., 2014) 위해평가 과정에서 기여도가 높으며, 특히 시설 재배와 실내와 같은 밀폐된 공간에서의 농약 살포 시 호흡노출은 매우 중요하다(Castro Cano et al., 2000; Machera et al., 2003; Byoun et al., 2005; Ramos et al., 2010; Choi and Moon, 2013; Kim et al., 2014; An et al., 2015).
농작업자의 호흡노출량 측정은 일반적으로 XAD-2 등의 고체흡착제를 개인용 공기펌프에 연결하거나(Farewell et al., 1977; Johnson et al., 1977; Lewis and Jackson, 1982; Billing and Bidleman, 1983; Williams et al., 1986; Leidy and Wright, 1991; Wright et al., 1993; Lu and Fenske, 1998; Machera et al., 2003; Byoun et al., 2005; Choi et al., 2006; Farahat et al., 2010; Kim et al., 2011a,b, 2012; Dalvie et al., 2014; An et al., 2014; Cao et al., 2015), 고체흡착제 앞에 유리섬유여과지를 연결하여 사용하였다(Kim et al., 2011a,b, Kim et al., 2012a,b, 2013; Choi and Moon., 2013; Moon et al., 2013; Zhao et al., 2015). 그러나 위와 같은 방법은 과정이 복잡하고, 흡착제 유리관을 절단하고 연결하는 과정에서 손을 다치거나, 유리파편이 튀거나, 내부의 resin이 손실되는 등 불편함이 있었다. 따라서 최근에는 내부에 유리섬유여과지를 장착하는 IOM(The Insitute of Occupational Medicine) 채집기가 호흡노출의 포집과 사용법이 용이해서 호흡노출 측정에 사용되고 있다(Katinka et al., 2004; Grobkopf et al., 2013; Kim et al., 2014)(Fig. 1).

Solid adsorbent (XAD-2 resin) glass tubes (A), IOM sampler with glass fiber filter (B), Attachment of IOM sampler on work clothing (C).
따라서, 본 연구는 농작업자의 농약 호흡노출 측정에 있어서 기존에 사용하였던 고체흡착제 사용을 탈피하고, 호흡노출 평가에서 국제적 추세에 맞추고자 IOM 채집기에 대한 호흡노출 측정 방법의 유효성을 검증하였다. 시험은 분무 입자별 특성을 고려하여, 고체 제제인 kresoxim-methyl 입상수화제와 액상 제제인 fenthion 유제를 이용한 모의 살포 후 IOM 채집기(유리섬유여과지)의 포집효율을 측정하였고 두 약제의 표준 용액을 유리섬유여과지에 처리하여 파과 여부를 측정함으로써 농작업자 호흡노출량 측정에서 IOM 채집기의 활용가능성을 확인하였다.
재료 및 방법
재료 및 시약
Kresoxim-methyl 표준품(99.9%)과 fenthion 표준품(99.2%)은 Sigma-Aldrich, Fluka, Chem service (USA)에서 구입하였고, 유기용매는 HPLC급으로 acetonitrile과 methanol (Fisher Scientific, USA)을 사용하였다. Kresoxim-methyl 50% 입상수화제(해비치, 성보화학)와 fenthion 50% 유제(리바이짓드, 동부한농)는 시중 농약상에서 구입하였다. 호흡노출 측정용으로 IOM 채집기에 장착하는 유리섬유여과지(지름 25 mm)는 SKC사(Eighty Four, PA, USA)제품을, XAD-2 resin 고체흡착제(ORBOTM-609, 400/200 mg, 20051)는 SUPELCO사(USA)제품을 사용하였다. 유리섬유여과지 및 고체흡착제 추출용으로 Sarstedt사(Germany)의 15 mL tube를 사용하였고 syringe filter (PTFE 0.2 μm, 17844K)는 Sartorius사(Germany)제품을 사용하였다.
기구 및 기기
개인용 공기펌프는 Gilian사(Sensidyne, USA)의 Gilair-3을, IOM 채집기는 SKC사(Eighty Four, PA, USA)의 모델 225.70A를 사용하였다.
분석기기 및 분석조건
대상 농약은 Nexera LC-30AD UHPLC가 장착된 Shimadzu LCMS 8040 (Shimadzu Corporation, Kyoto, Japan)을 이용하여 SRM (Selected reaction monitoring) mode를 이용하였다(Table 1-3).
용매표준용액의 조제
Kresoxim-methyl (99.9%) 및 fenthion 표준품(99.2%)을 칭량하여 1,000,000 ng/mL이 되도록 acetonitrile에 용해 후 stock solution을 조제하였다. 이 stock solution 1 mL를 acetonitrile로 희석하여 100,000 ng/mL 농도의 working solution을 조제한 다음 단계적으로 acetonitrile을 이용하여 희석하여 2.0, 5.0, 10.0, 20.0, 50.0, 100.0, 200.0, 500.0 및 1,000.0 ng/mL의 표준용액을 조제하였다.
Matrix matched standard의 조제
유리섬유여과지 및 고체흡착제를 acetonitrile 10 mL로 1시간 진탕 추출한 다음 PTFE 재질의 filter (0.2 μm)로 이물질을 걸러내고 추출액 500 μL와 각 농약의 용매표준용액 500 μL를 혼합하여 농도가 각각 1.0, 2.5, 5.0, 10.0, 25.0 및 50.0 ng/mL이 되도록 matrix matched standard를 조제하였다.
검출한계 및 검량선의 직선성 측정
분석기기의 최소검출량 및 분석법의 검출한계는 matrix matched standard (1.0, 2.5, 5.0, 10.0, 25.0, 50.0 ng/mL)를 5.0 μL씩 LC-MS/MS에 주입하여 피크의 S/N 및 감도를 고려하여 결정하였다.
농도가 각각 1.0, 2.5, 5.0, 10.0, 25.0 및 50.0 ng/mL로 되도록 조제한 matrix matched standard 5.0 μL를 LC-MS/MS에 주입, 분석하여 각 농약별 검량선의 직선성을 측정하였다.
유리섬유여과지와 고체흡착제의 농약 회수율 측정
유리섬유여과지와 고체흡착제(XAD-resin)에 kresoximmethyl, fenthion 표준용액을 250 pg이 되도록 처리하고 용기에 담아 acetonitrile 10 mL로 1시간 진탕 추출한 다음 PTFE 재질의 filter로 이물질을 여과한 후, 추출액 500 μL와 acetonitrile 500 μL를 혼합하여 이 중, 5.0 μL를 LC-MS/MS에 주입, 분석하여 용매에 의한 각 농약별 회수율을 측정하였다.
유리섬유여과지의 농약 포집효율(Trapping efficiency) 시험
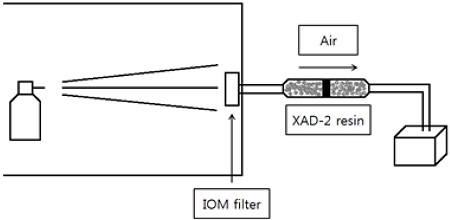
IOM 채집기 뒤에 고체흡착제(XAD-2 resin)를 장착하고 공기 유량을 2 L/min로 흡입하면서, 입상수화제(Kresoximmethyl 50%)와 유제(fenthion 50%)를 한국작물보호협회 작물보호제 지침서의 표준희석배수(Korea Crop Protection Association, 2014)에 따라 물 1 L에 희석하여 소형 분무기(20 mL)에 담아 IOM 채집기에서 30 cm 떨어진 위치에서 약액이 소진될 때까지 분사하였다(Fig. 2). 살포/포집 시간은 약 2-3분 걸렸으며 10반복씩 수행하였다. 분사가 종료된 후 유리섬유여과지와 고체흡착제를 각각 acetonitrile 10 mL를 이용하여 추출한 다음 PTFE 재질의 filter로 여과하고, 추출액 500 μL와 acetonitrile 500 μL를 혼합하여 LC-MS/MS에 5.0 μL를 주입하여 분석하였다.
유리섬유여과지의 농약 파과(Breakthrough)율 측정
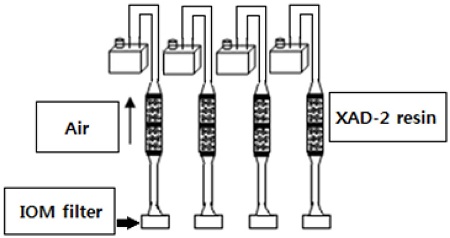
IOM sampler에 사용하는 유리섬유여과지에 250 pg가 되도록 kresoxim-methyl과 fenthion 표준용액을 각각 처리하고 cassette 뒷면에 glass fiber filter를 한 장 더 부착하고 IOM 채집기에 장착하였다. 또한 IOM 채집기에 고체흡착제(XAD-2 resin)를 추가로 연결한 다음 2 L/min (USEPA, 1996)으로 4시간동안 작동시킨 후(Fig. 3) 고체흡착제와 유리섬유여과지(2장)를 수거하여 포집효율 시험의 분석 과정과 동일하게 추출 분석하였다(3반복).
결과 및 고찰
IOM 채집기와 유리섬유여과지
IOM 채집기(Fig. 4)는 소형의 유리섬유여과지를 cassette에 끼우고 장착해서 사용하는데 공기를 흡입/통과시키면서 물질을 포집한다. IOM 채집기는 일반적으로 대기 중 먼지 등을 포집 후 중량법으로 측정하는데(Niven et al., 1993; Liden et al., 2000; Liden and Bergman, 2001; Harper et al., 2004; Skaugset et al., 2013) 사용의 편이성, 우수한 포집능력 때문에 농약 살포시 호흡노출 측정에도 이용되고 있다(Grobkopf et al., 2013; Kim et al., 2014). 하지만 포집효율에 대한 체계적이고 구체적인 자료는 부족한 실정이다. 따라서, 고상과 액상 제제 각각에 대한 효율성 측정 방법 설정과 효율성 평가는 정확한 호흡노출량 기초 자료 확보를 통한 인체 위해성 평가를 위해 그 의의가 매우 크다.
검량선의 작성과 검출한계 결정
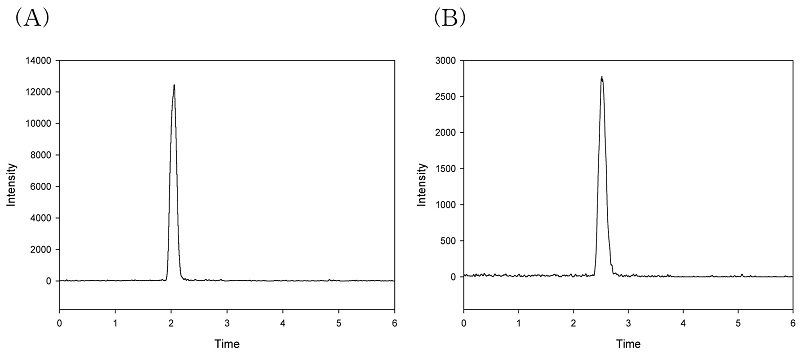
기기의 최소검출량은 농약을 신뢰성 있게 정량할 수 있는 크로마토그램 상 최소량 또는 그 이상을 의미하며, 6가지 농도(1.0, 2.5, 5.0, 10.0, 25.0, 50.0 ng/mL)의 matrix matched standard를 분석하여 12.5 pg을 기기상 최소검출량으로 설정하였으며 분석 과정 중 시료를 ACN과 1:1 비율로 혼합/희석 하고, 5.0 uL를 주입하기 때문에 전체 분석 과정에 대한 분석법의 검출한계는 5.0 ng/mL로서 충분히 좋은 감도로 판단되었다(Fig. 5). 각 노출 시료별 matrix matched standard 검량선의 직선성은 R2> 0.999으로 정량성이 보장된 정밀한 분석을 수행할 수 있음을 증명하였다(Table 4).
회수율
회수율 측정은 농약을 포집하는 시료에 흡착된 농약이 해당 추출 용매에 의해 제대로 추출되는지를 확인하는 시험으로서, 유리섬유여과지와 고체흡착제에 kresoxim-methyl과 fenthion 표준용액을 각각 처리하고 추출해서 회수율을 측정하였다. 유리섬유여과지의 kresoxim-methyl, fenthion에 대한 회수율은 각각 102.8-108.6%, 97.1-103.4%, C.V.는 2.8%, 3.2% 이하, 고체흡착제(XAD-2 resin)에 대한 회수율은 각각 94.4-97.5%, 93.1-99.3%, C.V.는 1.7%, 3.6% 이하로 유리섬유여과지와 고체흡착제 모두 호흡노출 측정 사용에 문제가 없음을 확인하였다(Table 5).
유리섬유여과지의 포집효율
미국 환경청은 호흡노출 측정을 위한 포집/흡착제의 장단점 등을 기술하며, 적절한 시험법 선택의 중요성을 관련 보고서와 가이드라인을 통해 제시하고 있다(USEPA, 1987; USEPA, 1996). 그 중 펌프로 공기를 흡입할 때 미세 먼지 입자에 의한 공기유속의 제한 등이 발생하므로, 작업자의 호흡기 순환 정도를 예측할 필요가 있으며, 흡착제에 부착된 농약의 화학적 전환이나 분해 등도 중요한 요소가 될 수 있다고 보고되어 있다. 따라서 시험 물질과 시험 방법의 선택, 그리고 효율성 평가는 관련 연구를 통한 인체 노출평가시험의 적절성과 정확성에 매우 중요한 인자라 할 수 있다. 최근까지도 효율성 평가를 위해서 일정량의 농약을 U자 형태의 유리관에 넣고 휘발시켜 흡착제에 흡착된 농약의 양과 유리관에 남아있는 잔류량을 합산하여 시험하였는데(Byoun et al., 2005; Choi et al., 2006; Kim et al., 2011a,bKim et al., 2012a,bChoi and Moon, 2013; Moon et al., 2013; Choi, 2014) 실제 포장 상태에서는 농약 자체가 포집되기보다는 현탁액, 수화액 등 물에 희석된 분무 입자형태로 살포 후 포집되기 때문에 실제 상황과 유사한 시험법의 개발 역시 필요하다고 판단된다. 따라서 본 연구에서는 실제 분사될 때의 상황을 모방, 재현하여 농약 제제를 한국작물보호협회 작물보호제 지침서의 표준희석배수에 따라, 물 1 L에 희석하여 공기를 흡입기가 부착된 IOM 채집기에 분사하였다. 특히, 농약의 유리섬유여과지 통과 가능성도 염두하여, IOM 채집기 뒤에 고체흡착제를 추가로 장착하여 각각 분석함으로써 효율성 평가에 활용하였다.
분사가 종료된 후, 유리섬유여과지와 고체흡착제에 포집된 농약을 추출, 분석한 결과 kresoxim-methyl 입상수화제의 포집량은 0.08-0.42 μg, fenthion 유제의 포집량은 0.11-0.77 μg이었다(Table 6). 두 농약의 경우 넓은 농도 범위에서 포집이 되어서 다양한 포장 상황을 가정할 수 있었다. 이 결과는 사과 과수원에서 고체흡착제를 이용하여 호흡노출을 측정한 기존 연구(Kim et al., 2012b)에서 보고된 수준(0.2-0.6 μg)과 비슷한 수준이었다. 또한 뒤에 장착된 고체흡착제에서는 모든 경우에 농약이 검출되지 않아서 고체 제제나 액상 제제에 상관없이 포집의 효율성이 입증되었다 .
유리섬유여과지에서 농약의 파과
호흡노출 측정에 사용되는 포집/흡착제는 농약이 포집된 후 공기 흡입에 의한 파과율을 검증해야 한다(USEPA, 1987; USEPA, 1996). 기존에 사용되어 온 고체흡착제는 유리관속에 1차 흡착제와 2차 흡착제로 나누어져 있는데, 1차 흡착제에 과량 흡착되어 2차 흡착제로 파과되어 흡착된 농약 양이 1차 흡착제에 흡착된 양의 20%를 초과하면 고체흡착제의 신뢰성을 인정하지 않는다(ACGIH, 1983; NIOSH, 1980). 이러한 이유로 고체흡착제(XAD-2 resin)를 사용한 연구들은 파과율 측정을 수행하였고(Liu, 2003; Kang et al., 2004; Choi et al., 2006; Kim et al., 2011bKim et al., 2012a,bChoi and Moon, 2013; Kim et al., 2013; Moon et al., 2013; Choi, 2014), 본 시험에 사용된 IOM 채집기는 고체흡착제가 아닌 유리섬유여과지를 사용하기 때문에 이에 대한 파과율을 측정하였다. 유리섬유여과지에 kresoximmethyl과 fenthion 표준용액을 각각 처리하고 농약이 파과 또는 cassette 뒷면을 오염시킬 경우를 대비하여 뒷면에 유리섬유여과지를 한 장 더 부착하고 IOM 채집기에 장착하였다. 또한 IOM 채집기에 고체흡착제(XAD-2 resin)를 추가로 연결하여 4시간동안 공기를 통과시켰다. 유리섬유여과지(2장) 및 고체흡착제의 농약을 추출, 측정한 결과 농약을 처리한 유리섬유여과지에서 86-105%의 회수율을 보였고, 뒷면에 넣은 유리섬유여과지와 고체흡착제에서는 농약이 검출되지 않아 유리섬유여과지의 농약 흡착/보유능력이 우수한 것을 알 수 있었다. Kim 등(Kim et al., 2011b)이 호흡노출 측정에 있어서 fenthion의 파과 및 포집효율 측정하였는데, 이와 비교하여 유사한 결과를 얻었기 때문에 농약의 호흡노출 측정에 있어서 유리섬유여과지가 장착된 IOM 채집기의 효율성을 확인하였다(Table 7).
결 론
농작업자의 농약 살포 시 호흡노출량 측정 방법 개발의 일환으로, 고체 제제 kresoxim-methyl 입상수화제와 액상제제 fenthion 유제를 대상으로 모의 살포를 이용하여 IOM 채집기(유리섬유여과지)의 포집효율을 측정하고 각 약제의 표준 용액을 유리섬유여과지에 직접 처리하여 파과 여부를 측정하였다. 그 결과, 유리섬유여과지만으로도 두 약제에 대한 포집이 가능함이 확인되었고, 파과실험을 통해서도 유리섬유여과지에만 흡착되어 IOM 채집기의 효율성을 뒷받침하였다. 이를 통해, 유리섬유여과지를 장착한 IOM 채집기는 시험에 사용한 두 약제와 물리화학적 특성 및 제형, 살포방식이 유사한 약제에 한해 농작업자 호흡노출량 측정에 적용가능하리라 판단된다.
Acknowledgments
본 연구는 농촌진흥청 공동연구사업(과제번호:PJ009948)의 지원에 의해 이루어진 것이며, 이에 감사드립니다. 또한 기술적 자문과 후원에 대해서 Bayer CropScience의 Occupational and Residential Exposure (ORE) Team과 Human Safety Team 및 Crop Life Asia에 감사드립니다.
Literature Cited
- Abukari, W., (2015), Pesticides applicator exposure assessment: A comparison between modeling and actual measurement, J. Environ. Earth Sci, 5(11), p101-115.
- ACGIH, (1983), Air sampling instruments 6th edition American Conference of Governmental Industrial Hygienists, Cincinnati, OH. P. A-7.
-
An, X., X. Ji, M. Wu, X. Hu, R. Yu, X. Zhao, and L. Cai, (2014), Risk assessment of applicators to chlorpyrifos through dermal contact and inhalation at different maize plant heights in China, J. Agric. Food Chem, 62, p7072-7077.
[https://doi.org/10.1021/jf501027s]

-
An, X., X. Ji, J. Jiang, Y. Wang, C. Wu, and X. Zhao, (2015), Potential dermal exposure and risk assessment for applicators of chlorothalonil and chlorpyrifos in cucumber greenhouses in China, Hum. Ecol. Risk Assess, 21(4), p972-985.
[https://doi.org/10.1080/10807039.2014.949165]

- Behroozy, A., (2013), On dermal exposure assessment, Int. J. Occup. Environ. Med, 4, p113-127.
-
Billings, W. N., and T. F. Bidleman, (1983), High volume collection of chlorinated hydrocarbons in urban air using three solid adsorbents, Atmos. Environ, 17(2), p383-391.
[https://doi.org/10.1016/0004-6981(83)90055-0]

- Byoun, J. Y., H. Choi, J. K. Moon, H. W. Park, K. H. Liu, Y. B. Ihm, B. S. Park, and J. H. Kim, (2005), Risk assessment of human exposure to methidathion during harvest of cucumber in green House, Toxicol Res, 21, p297-301.
-
Cao, L., B. Chen, L. Zheng, D. Wang, F. Liu, and Q. Huang, (2015), Assessment of potential dermal and ingalation exposure of workers to the insecticide imidacloprid using whole-body dosimetry in China, J. Environ. Sci, 27, p139-146.
[https://doi.org/10.1016/j.jes.2014.07.018]

-
Capri, E., R. Alberici, C. R. Glass, G. Minuto, and M. Trevisan, (1999), Potential operator exposure to Procymidone in greenhouses, J. Agric Food Chem, 47(10), p4443-4449.
[https://doi.org/10.1021/jf990175w]

-
Castro Cano, M. L., J. L. Martinez Vidal, F. J. Egea Gonzalez, M. Martinez Galera, and M. Cruz Marquez, (2000), Gas chromatographic method and whole body dosimetry for assessing dermal exposure of greenhouse applicators to chlorpyrifos-methyl and fenitrothion, Analytica. Chim. Acta, 423, p127-36.
[https://doi.org/10.1016/S0003-2670(00)01084-9]

-
Chester, G., (1993), Evaluation of Agricultural Worker Exposure to, and Absorption of, Pesticides, Ann. Occup. Hyg, 37, p509-523.
[https://doi.org/10.1093/annhyg/37.5.509]

-
Chester, G., (2010), Worker Exposure: Methods and Techniques, In: Hayes' Handbook of Pesticide Toxicology, edited by W.J. Hayes, p1127-1137, Elsevier.
[https://doi.org/10.1016/B978-0-12-374367-1.00052-5]

-
Choi, H., J. K. Moon, K. H. Liu, H. W. Park, Y. B. Ihm, B. S. Park, and J. H. Kim, (2006), Risk assessment of human exposure to cypermethrin during treatment of mandarin fields, Arch. Environ. Contam. Toxicol, 50(3), p437-442.
[https://doi.org/10.1007/s00244-005-1050-3]

-
Choi, H., J.-K. Moon, and J.-H. Kim, (2013), Assessment of the exposure of workers to the insecticide imidacloprid during application on various field crops by a hand-held Power Sprayer, J. Agric. Food Chem, 61, p10642-10648.
[https://doi.org/10.1021/jf403169t]

-
Choi, H., and J.-H. Kim, (2014), Risk assessment of agricultural worker's exposure to fungicide thiophanate-methyl during treatment in green pepper, cucumber and apple fields, J. Appl. Biol. Chem, 57(1), p73-81.
[https://doi.org/10.3839/jabc.2014.012]

- Crosby, D. G., (1998), Exposure and risk, in environmental toxicology and chemistry, edited, p185-204, Oxford University Press, Inc.
- Culver, D., P. Caplan, and G. S. Batchelor, (1956), Studies of human exposure during aerosol application of malathion and chlorthion, A.M.A Arch. Ind. Health, 13(1), p37-50.
-
Dalvie, M. A., M. B. Sosan, A. Africa, E. Cairncorss, and L. London, (2014), Environmental monitoring of pesticide residues from farms at a neighbouring primary and preschool in the Western Cape in South Africa, Sci. Total Environ, 466-467, p1078-1084.
[https://doi.org/10.1016/j.scitotenv.2013.07.099]

-
Farahat, F. M., R. A. Fenske, J. R. Olson, K. Galvin, M. R. Bonner, D. S. Tohlman, T. M. Farahat, P. J. Lein, and W. K. Anger, (2010), Chlorpyrifos exposures in Egyptian cotton field workers, Neurotoxicology, 31(3), p297-304.
[https://doi.org/10.1016/j.neuro.2010.02.005]

-
Farewell, S. O., F. W. Bowes, and D. F. Adams, (1977), Evaluation of XAD-2 as a collection medium for 2,4-D herbicides in air, J. Environ. Health, B12, p71-83.
[https://doi.org/10.1080/03601237709372053]

-
Fenske, R. A., (1990), Nonuniform dermal deposition patterns during occupational exposure to pesticides, Arch. Environ. Contam. Toxicol, 19(3), p332-337.
[https://doi.org/10.1007/BF01054974]

-
Fenske, R. A., (1993), Dermal exposure assessment techniques, Ann. Occup. Hyg, 37(6), p687-706.
[https://doi.org/10.1093/annhyg/37.6.687]

- Fenske, R. A., and E. W. Day JR, (2005), Assessment of exposure for pesticide handlers in agricultural, residential and institutional environments, Occupational and residential exposure assessment for pesticides, edited John Wiley & Sons. Ltd, p11-43.
-
Franklin, C. A., R. A. Fenske, R. Greenhalgh, L. Mathieu, H. V. Denley, J. T. Leffingwell, and R. C. Spear, (1981), Correlation of urinary pesticide metabolite excretion with estimated dermal contact in the course of occupational exposure to guthion, J. Toxicol. Environ. Health, 7(5), p715-731.
[https://doi.org/10.1080/15287398109530014]

-
Franklin, C. A., and J. P. Worgan, (2005), Occupational and residential exposure assessment for pesticides, Wiley.
[https://doi.org/10.1002/0470012218]

-
Gao, B. B., C. J. Tao, J. M. Ye, J. Ning, X. D. Mei, Z. F. Jiang, S. Chen, and D. M. She, (2013), Measurement of operator exposure to chlorpyrifos, Pest. Manag. Sci, 70(4), p636-641.
[https://doi.org/10.1002/ps.3601]

-
Grobkopf, C., H. Mielke, D. Westphal, M. E.-. Vourliotis, P. Hamey, F. Bouneb, D. Rautmann, F. Stauber, H. Wiche, W. Maasfeld, J. D. Salazar, G. Chester, and S. Martin, (2013), A new model for the prediction of agricultural operator exposure during professional application of plant protention products in outdoor crops, J. Verbr. Lebensm, 8, p143-153.
[https://doi.org/10.1007/s00003-013-0836-x]

-
Harper, M., M. Z. Akbar, and M. E. Andrew, (2004), Comparison of wood-dust aerosol size-distributions collected by air samplers, J. Environ. Monit, 6, p18-22.
[https://doi.org/10.1039/b312883k]

-
Hughes, E. A., A. Zalts, J. J. Ojeda, A. P. Flores, R. C. Glass, and J. M. Montserrat, (2006), Analytical method for assessing potential dermal exposure to captan, using whole body dosimetry, in small vegetable production units in Argentina, Pest. Manag. Sci, 62, p811-8.
[https://doi.org/10.1002/ps.1232]

-
Hughes, E.A., A. P. Flores, L. M. Ramos, A. Zalts, C. R. Glass, and J. M. Montserrat, (2008), Potential dermal exposure to deltamethrin and risk assessment for manual sprayers: Influence of crop type, Sci. Total Environ, 391, p34-40.
[https://doi.org/10.1016/j.scitotenv.2007.09.034]

-
Johnson, E. R., T. C. Yu, and M. L. Montgomery, (1977), Trapping and analysis of atmospheric residues of 2,4-D, Bull. Environ. Contam. Toxicol, 17(3), p369-372.
[https://doi.org/10.1007/BF01686092]

- Kang, T.-S., G.-J. Kim, I.-J. Choi, Y.-J. Kwon, K. R. Kim, and K.-S. Lee, (2004), Exposure assessment of Korean farmers While applying chlorpyrifos, and chlorothalonil on pear and red pepper, J. Agric. Med. Community Health, 29(2), p249-263.
-
Katinka, V. D. J., E. Tielemans, I. Links, D. Brouwer, and J. V. Hemmen, (2004), Effectiveness of personal protective equipment: Relevance of dermal and inhalation exposure to chlorpyrifos among pest control operators, J. Occup. Environ. Hyg, 1, p355-362.
[https://doi.org/10.1080/15459620490449710]

- Kim, E. H., H. R. Lee, H. Choi, J. K. Moon, S. S. Hong, M. H. Jeong, K.-H. Park, H. M. Lee, and J.-H. Kim, (2011a), Methodology for quantitative monitoring of agricultural worker exposure to pesticides, Kor. J. Pestic. Sci, 15(4), p507-528.
- Kim, E. H., H. R. Lee, H. Choi, J. K. Moon, S. S. Hong, M. H. Jeong, K.-H. Park, H. M. Lee, and J.-H. Kim, (2011b), Method validation for monitoring of agricultural worker exposure to insecticide fenthion, Kor. J. Pestic. Sci, 15(4), p357-365.
-
Kim, E. H., Y. J. Hwang, S. H. Kim, H. R. Lee, S. S. Hong, K. H. Park, and J.-H. Kim, (2012a), Operator exposure to indoxacarb wettable powder and water dispersible granule during mixing/loading and risk assessment, Kor. J. Pestic. Sci, 16, p343-349.
[https://doi.org/10.7585/kjps.2012.16.4.343]

- Kim, E. H., J.-K. Moon, H. Choi, S.-M. Hong, D.-H. Lee, H. M. Lee, and J.-H. Kim, (2012b), Exposure and risk assessment of insecticide methomyl for applicator during treatment on apple orchard, J Korean Soc. Appl. Biol. Chem, 55, p95-100.
-
Kim, E. H., J.-K. Moon, S. H. Kim, Y.-J. Hwang, B.-J. Kim, J. B. Lee, D.-H. Lee, and J.-H. Kim, (2013), Exposure and risk assessment of operators to inseticide acetamiprid during treatment on apple orchard, Korean J. Hortic. Sci. Technol, 31(2), p239-245.
[https://doi.org/10.7235/hort.2013.12201]

-
Kim, E. H., J. H. Lee, J. H. Sung, J. H. Lee, Y. H. Shin, and J.- H. Kim, (2014), Exposure and risk assessment of operator exposure to insecticide acetamiprid during water melon cultivation in greenhouse using whole body dosimetry, Kor. J. Pestic. Sci, 18, p247-257.
[https://doi.org/10.7585/kjps.2014.18.4.247]

- Korea Crop Protection Association, (2014), Agrochemicals use guide book, 254-255, 726.
-
Leidy, R. B., and C. G. Wright, (1991), Trapping efficiency of selected adsorbents for various airborne pesticides, J. Environ. Sci. Health B, 26(4), p367-382.
[https://doi.org/10.1080/03601239109372743]

-
Lesme-Fabian, C., G. Garcia-Santos, F. Leuenberger, D. Nuyttens, and C. R. Binder, (2012), Dermal exposure assessment of pesticide use: The case of sprayers in potato farms in the Colombian highlands, Sci. Total Environ, 430, p202-208.
[https://doi.org/10.1016/j.scitotenv.2012.04.019]

-
Lewis, R. G., and M. D. Jackson, (1982), Modification and evaluation of a high volume air sampler for pesticides and semivolatile industrial organic chemicals, Analytical Chem, 54(3), p592-594.
[https://doi.org/10.1021/ac00240a058]

-
Liu, K. H., C. S. Kim, and J.-K. Kim, (2003), Human exposure assessment to mancozeb during treatment of mandarin fields, Bull. Environ. Contam. Toxicol, 70, p336-342.
[https://doi.org/10.1007/s00128-002-0196-1]

-
Liden, G., B. Melin, A. Lidblom, K. Lindberg, and J.-O. Noren, (2000), Personal sampling in parallel with Open-Face filter cassettes and IOM samplers for inhalable Dust-Implications for occupational exposure limits, Appl. Occup. Environ. Hyg, 15(3), p263-276.
[https://doi.org/10.1080/104732200301584]

-
Liden, G., and G. Bergman, (2001), Weighing imprecision and handleability of the sampling cassettes of the IOM sampler for inhalable Dust, Ann. Occup. Hyg, 45(3), p241-252.
[https://doi.org/10.1093/annhyg/45.3.241]

-
Lu, C., and R. A. Fenske, (1998), Air and surface chlorpyrifos residues following residential broadcast and aerosol pesticide applications, Environ. Sci. Technol, 32(10), p1386-1390.
[https://doi.org/10.1021/es9706716]

-
Machera, K., M. Goumenou, E. Kapetanakis, A. Kalamarakis, and C. R. Glass, (2003), Determination of potential dermal and inhalation operator exposure to malathion in greenhouses with the whole body dosimetry method, Ann. Occup. Hyg, 47, p61-70.
[https://doi.org/10.1093/annhyg/mef097]

-
Miller, C. S., W. L. Hoover, and W. H. Culver, (1980), Exposure of pesticide applicators to arsenic Acid, Arch. Environ. Contam. Toxicol, 9(3), p281-288.
[https://doi.org/10.1007/BF01057408]

-
Moon, J. K., S. E. Park, E. H. Kim, H. R. Lee, and J.-H. Kim, (2013), Risk Assessment of the exposure of insecticide operators to fenvalerate during treatment in apple orchards, J. Agric. Food Chem, 61(2), p307-311.
[https://doi.org/10.1021/jf3043083]

- NIOSH, (1980), Development and validation of methods for sampling and analysis of workplace toxic substances, Research Report, U. S. Department of Health and Human Services. Publ, p80-133.
- Niven, K. J. M., A. J. Scott, S. Hagen, E. R. Waclawski, M. Lovett, B. Cherrie, P. L. Bodsworth, A. Rovertson, A. Elder, J. Cocker, B. Nutley, and M. Roff, (1993), Occupational hygiene assessment of sheep dipping practices and processes, IOM report TM/93/03, Institute of Occupational Medicine, Edinburgh.
- OECD, (1997), Guidance document for the conduct of studies of occupational exposure to pesticides during agricultural application, OECD environmental gealth and safety publications. Series on Testing and Assessment, Paris, Environmental Directorate, OECD/GD(97).
-
Oliveira, M. L., and J. G. Machado-Neto, (2003), Use of manganese as tracer in the determination of respiratory exposure and relative importance of exposure routes in the safety of pesticide applicators in citrus orchards, Bull. Environ. Contam. Toxicol, 70(3), p415-421.
[https://doi.org/10.1007/s00128-003-0002-8]

-
Ramos, L. M., G. A. Querejeta, A. P. Flores, E. A. Hughes, A. Zalts, and J. M. Montserrat, (2010), Potential dermal exposure in greenhouses for manual sprayers: Analysis of the mix/load, application and re-entry stages, Sci. Total. Environ, 408, p4062-4068.
[https://doi.org/10.1016/j.scitotenv.2010.05.020]

-
Ramwell, C. T., P. D. Johnson, A. B. A. Boxall, and D. A. Rimmer, (2005), Pesticide residues on the external surfaces of field crop sprayers: occupational exposure, Ann. Occup. Hyg, 49(4), p345-350.
[https://doi.org/10.1093/annhyg/meh101]

-
Skaugset, N. P., D. G. Ellingsen, H. Notø, L. Jordbekken, and Y. Thomassen, (2013), Intersampler field comparison of Respicon, IOM, and Closed-Face 25-mm personal aerosol samplers during primary production of aluminium, Ann. Occup. Hyg, 57(8), p1054-1064.
[https://doi.org/10.1093/annhyg/met025]

-
Soutar, A., S. Semple, R. J. Aitken, and A. Robertson, (2000), Use of patches and whole body sampling for the assessment of dermal exposure, Ann. Occup. Hyg, 44(7), p511-518.
[https://doi.org/10.1093/annhyg/44.7.511]

- Tannahill, S. N., A. Rovertson, B. Cherrie, P. Donnan, E. L. A. MacConnell, and G. J. MacLeod, (1996), A comparison of two different methods for assessment of dermal exposure to non-agricultural pesticides in three sectors, IOM report TM/96/07, Institute of Occupational Medicine, Edinburgh.
- Turnbull, G. J., (1985), Current trends and future needs in Occupational hazards of pesticide use edited, p99-116, Taylor and Francis. Ltd.
- U.S. Environmental Protection Agency, (1987), Pesticide assessment guidelines, subdivision U, Applicator exposure monitoring, report No. 540/9-87-127, Office of prevention, pesticides and toxic substances, Washington, DC, USA.
- U.S. Environmental Protection Agency, (1996), "Occupational and residential exposure test guidelines, OPPTS 875.1000, EPA 712-C-96-261,", U.S. EPA, Washington, DC, USA.
-
Wassie, F., P. Spanoghe, D. A. Tessema, and W. Steurbaut, (2012), Exposure and health risk assessment of applicators to DDT during indoor residual spraying in malaria vector control program, J. Expo. Sci. Env. Epid, 22, p549-558.
[https://doi.org/10.1038/jes.2012.45]

-
Williams, D. T., C. Shewchuck, G. L. Lebel, and N. Muir, (1986), Diazinon levels in indoor air after periodic application for insect control, American Industrial Hygiene Association, Fairfax, VA, ETATS-UNIS.
[https://doi.org/10.1080/15298668791385561]

-
Wojeck, G. A., J. F. Price, H. N. Nigg, and J. H. Stamper, (1983), Worker exposure to paraquat and diquat, Arch. Environ. Contam. Toxicol, 12(1), p65-70.
[https://doi.org/10.1007/BF01055003]

- World Health Organization, (1982), Field surveys of exposure to pesticides, Standard Protocol, VBC/82.1, WHO, Geneva.
-
Wright, C. G., R. B. Leidy, and H. E. Dupree Jr, (1993), Cypermethrin in the ambient air and on surfaces of rooms treated for cockroaches, Bull. Environ. Contam. Toxicol, 51(3), p356-360.
[https://doi.org/10.1007/BF00201752]

-
Zhao, M.-A., A. Yu, Y.-Z. Zhu, and J.-H. Kim, (2015), Potential dermal exposure to flonicamid and risk assessment of applicators during treatment in apple orchards, J. Occup. Environ. Hyg, 12, pD147-D152.
[https://doi.org/10.1080/15459624.2015.1009984]