LC-Tandem Mass Spectrometry를 활용한 농업용수 중 Perfluorochemicals 분석시료 전처리법
초록
잔류성 유기오염물질인 과불화합물 중 perfluorooctanesufonic acid (PFOS)와 perfluorooctanoic acid (PFOA)의 잔류분석은 환경부 “잔류성 유기오염물질 공정시험기준”에 따라 hydrophilic-lipophilic balance (HLB) solid phase extraction (SPE) 전처리 후 LC-MSn를 이용해 정량 분석하고 있다. 본 연구에서는 환경부 설정 공정시험법에 따라 농업용수 전처리 후, 시험법에서 제거하지 못한 미지의 불순물을 Envi-CarbTM을 통해 회수율에 영향을 주지 않고 손쉽게 제거하였다. 또한, 과불화합물 분석에 사용되는 LC-MSn 중 quadrupole-time-of-flight mass spectrometry (qTOFMS)에서 측정된 PFCs의 정량한계를 평가한 결과, 시험에 사용된 장비간 정량한계 편차가 크게 관찰되었으나, 시험대상 장비 모두 농업용수 중 ng/L 수준으로 잔류하는 과불화합물의 정밀 잔류분석에 사용가능 한 것으로 확인되었다.
Abstract
The current official perfluorochemicals (PFCs) analysis method is established with hydrophilic-lipophilic balance (HLB) solid phase extraction (SPE) clean-up method with LC-tandem mass spectrometry (MSn). Herein the HLB clean-up method from the official method by Korean government was modified with Envi-CarbTM to improve the clean-up efficiency for agricultural water and the unexpected UV disturbance in the water was effectively removed by the adsorbent treatment without a significant disturbance of quantitation. And quadrupole time of flight mass spectrometry (qTOFMS) was suggested to the available MSn instruments for the residue analysis of PFCs based on the ng/L of quantitation limits in water as well.
Keywords:
perfluorochemical, perfluorooctanesulfonic acid (PFOS), perfluorooctanoic acid (PFOA), agricultural water, quantitation키워드:
과불화합물, 농업용수, 시료전처리, 탄소계흡착제서론
잔류성 유기오염물질(POPs)은 난분해성이며 생물농축성이 높은 유기화학물질들 중 환경 및 인체 위해성이 높은 성분을 스톡홀름 협약을 통해 지정하고 있고, 협약에서 지정된 화학물질은 협약대상국에서의 생산 및 사용금지, 배출규제 등 법적규제 대상이 된다(Choi et al., 2011). 과불화합물중 perfluorooctansulfonic acid (PFOS)는 신규 POPs 물질로 2009년도에 지정되어 사용이 금지 되었으나, 대체 화학물질이 개발될 때까지 특수 산업목적에 제한적으로 사용이 허가된 화학물질이다(Lee et al. 2010). 과불화합물의 위해성은 2000년대에 들어 알려지기 시작하여, 독일과 미국 등과 같이 오염사고가 있었던 국가를 중심으로 음용수 및 지표수 등에 대한 잔류 허용기준을 part-per-trillion (ppt) 수준에서 설정하여 관리하고 있다(Lechner and Knapp, 2011). USEPA는 음용수 안전관리 가이드라인을 PFOS 0.2 μg/L와 perfluorooctanoic acid (PFOA) 0.4 μg/L로 설정하였고, North Carolina 주는 음용수 외 지표수 기준도(PFOA 2 μg/L, interim maximum allowable concentration) 설정하고 있다(USEPA 2014). 우리나라를 포함한 대부분의 국가에서 인위적 사용물질인 과불화합물에 관한 모니터링은 배출원을 중심으로한 하천 수계 및 생활 환경 내 잔류조사를 중심으로 진행되고 있으나, 과불화합물 배출원이 없는 농업환경에 대한 잔류조사는 2006년 이전까지 수행된 기록이 거의 없다. 하지만, 2006년 독일 Arnsberg지역에서 발생한 농경지 오염 및 지하수 오염 사고(Wilhelm et al., 2009) 이후 농업환경에 대한 과불화합물 잔류모니터링 연구 필요성이 증가하고 있다. 우리나라는 환경부에서 설정한 “잔류성 유기오염물질 공정시험기준”에 따라 하천수 및 하수에 대한 잔류조사가 진행 중에 있으나, 본 시험법이 농업용수에 적합한지 검토된 바가 없고, 또한 공정분석시험에 사용된 정량분석 장비인 LC-triple quadrupole mass spectrometry (TQMS)와 함께 최근 정량분석 분야에 새롭게 사용되기 시작한 LC-quadrupole time of flight mass spectrometry (qTOFMS)의 과불화합물 정량 분석 가능성에 대한 기술적 검토가 부족하였다. 이에 본 연구에서는 농업환경 매체에 최적화 된 시료전처리 기술 및 qTOFMS 사용가능성을 평가하여 농업용수를 중심으로 현행 공정 시험법을 보완하고자 하였다.
농업용수 시료 전처리법 개선
본 시험은 국내 환경부에서 고시한 “잔류성 유기오염물질 공정시험기준”을 기준 시험법으로 정하고 농업용수 시료에 적용하여 고시 시험법의 개선사항에 대해 검토하였다. 시험에 사용된 농업용수는 경기도 화성시와 의왕시 9 지점을 선정하여 농업용 수로에서 폴리프로필렌 재질의 채수병에 채취하였고, 대조구 시료는 연구실에 공급된 상수를 사용하였다. 채집된 시료는 폴리머 계열의 500 mg/6 mL hydrophilic-lipophilic balance (HLB) 카트리지(Silicycle Co., Toronto, Canada)와 LC-TQMS (3200QTrap, AB Sciex Co, USA)를 사용하여 고시 시험법에 따라 PFOA와 PFOS에 대한 정량 분석능을 평가하였다. 회수율과 분석 정밀성은 13C4-labelled PFOA와 13C4-labelled PFOS (Wellington Co. ON, Canada)를 사용하여 평가하였고, 13C8-PFOA와 13C8-PFOS (Wellington Co. ON, Canada)를 injection standard로 사용하여 matrix matched calibration법을 사용하였다. 직선성과 정량한계 (signal/noise=10/1)는 native PFOA와 native PFOS (Wellington Co. ON, Canada)를 사용하여 평가하였다. 고시 시험법에 따라 PFOA와 PFOS를 각각 0.010 μg/L와 0.100 μg/L 두 수준으로 spike한 농용수와 상수 시료를 준비한 후 9회 반복 시험하였다. 500 mL의 시료를 1.3-1.6 mL/min의 유속으로 HLB 카트리지에 주입하고, 30% MeOH 수용액으로 카트리지를 씻어준 후 MeOH로 용출시킨 용액을 질소 농축 후 기기분석용 시료액으로 사용하였다. 분석 결과 회수율은 65.7-82.4%로 확인되었으며, 분석 정밀성은 6.7-9.5%로 확인되어 모두 양호한 정량분석 값을 나타내었다. 그러나, 일부 농업용수 시료의 경우 공정시험법인 HLB 정제 후에도 육안으로 확인되는 유색물질이 잔류함을 확인하였고(Fig. 1), 이들이 정량 간섭물질로 작용할 가능성이 있어, 농업용수중 과불화합물 정밀분석을 위한 정도관리 기술로서 시료 전처리법을 개선하고자 하였다.

HLB clean-up samples of agricultural water for PFCs analysis after Envi-CarbTM treatment (right) and untreatment (left).
Envi-CarbTM (Supelco Co., PA, USA)은 탄소계 흡착제로 식품 시료 중 과불화합물 분석시 cholic acid등과 같은 정량 간섭물질을 제거할 목적으로 시료정제 마지막 단계에서 사용되고 있다 (Ballesteros-Gomez et al., 2010). 본 시험에서는 고시 시험법에 따른 HLB 시료 정제 후 Envi-CarbTM 처리단계를 보완하여, 색소 등 미지의 간섭물질 제거여부와 회수율 변화 등을 관찰 하였다. 개선된 시험법은 고시 시험법에 따른 HLB 시료정제 후 MeOH 용출액에 Envi-CarbTM 20 mg을 처리하고 원심분리 후 상등액 0.5 mL를 취하여 정량 분석능을 평가하였다. 시험결과 개선된 시험법은 유색물질을 효율적으로 제거하였고, 0.010 μg/L와 0.100 μg/L로 각각 spike된 PFOS와 PFOA에 대한 회수율은 67.4-78.2%로 확인되었으며, 두 성분에 대한 분석 정밀성은 최대 8.7%로 확인되었다. 따라서, 회수율 및 분석 정밀성 등 정량분석 유효성에 있어서 고시 시험법과 개선된 시험법간의 유의적 차이는 확인되지 않았다. 이에 따라, 환경부 고시 시험법의 시료 정제 마지막 단계에 Envi-CarbTM 처리를 추가하는 것이 시료에 의한 분석기기 오염예방 및 기기에 의한 분석오차를 줄이고, 정량 간섭물질에 의한 분석결과값의 과대평가를 예방하는데 기여할 것으로 판단된다.
LC-tandem MS 중 TQMS와 qTOFMS 분석 정밀도 비교
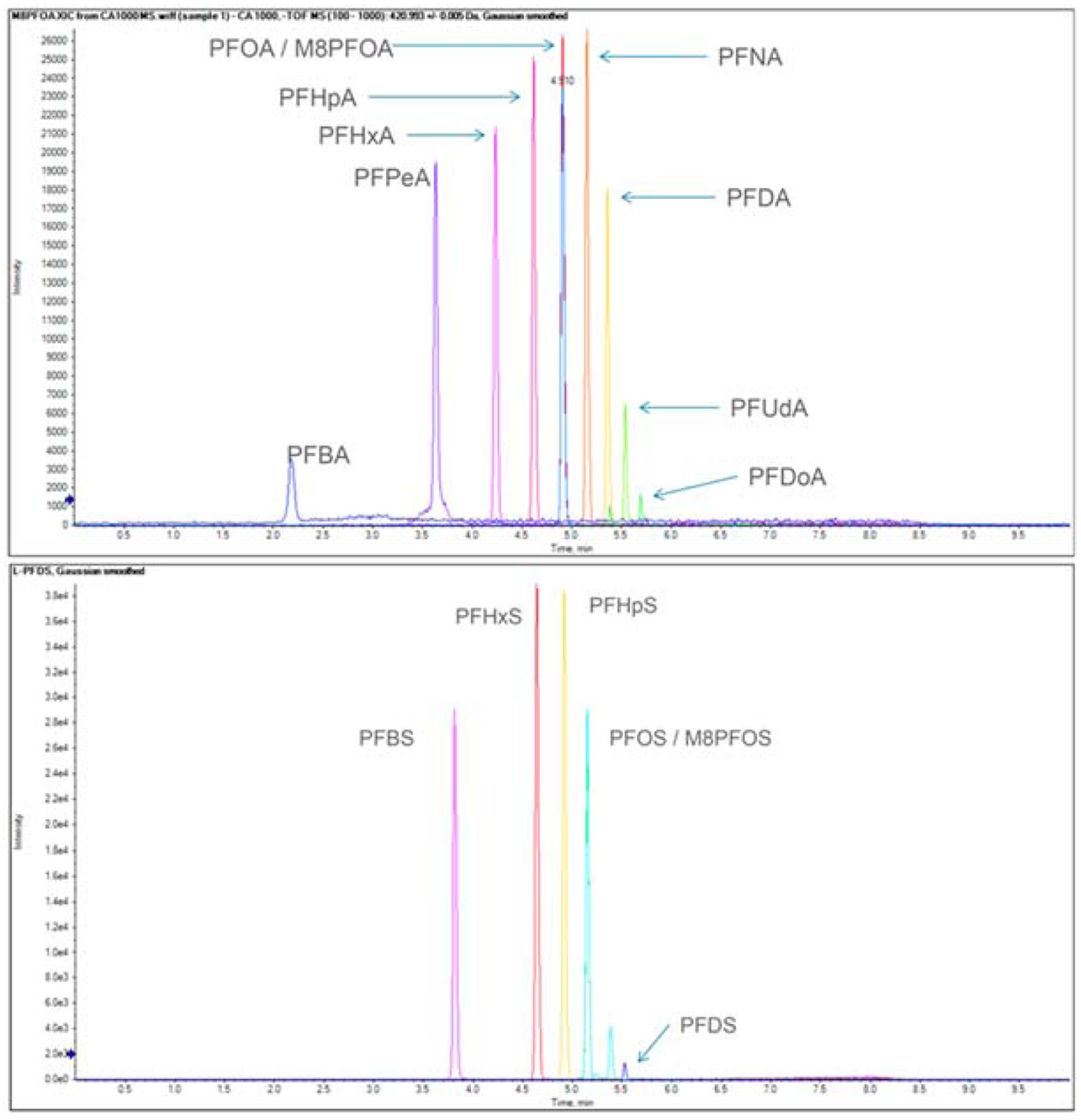
qTOFMS는 고분해능과 TOFMS 기능을 사용하여 TQMS에 비해 우수한 분석 정밀성과 정확성을 강점으로 최근 다성분 동시분석 연구에 보급되기 시작하였으나, 정량한계 수준이 높지 않다는 평가를 받고 있다. 이에 따라, 본 연구에서는 ng/L 이하의 높은 수준의 정량한계를 요구하는 물 시료 중 PFCs 잔류분석에 qTOFMS 활용 가능성을 검증하고자 하였다. TQMS와 qTOFMS에 대한 비교평가는 과불화합물의 정량한계를 기준으로 수행하였다. 본 시험에 사용된 qTOFMS는 Xevo-G2 (Waters Co., USA)와 TripleTOF 4600(AB Sciex Co. USA), Compact (Bruker Co. German)이며, 해당장비의 운용 소프트웨어를 이용해 최적화된 기기분석조건을 사용하였다(Table 1). qTOFMS는 TOFMS-high resolution (HR) mode와 multiple reaction monitoring-high resolution (MRM-HR) mode에서 각각 진행하였고, 분해능은 30,000 full width at half maximum (FWHM) 이상을 유지하였다. 비교연구 기준장비인 LC-TQMS (API3200QTRAP, AB SCIEX Co., USA)는 MRM mode에서 PFOA와 PFOS의 정량한계를 측정한 결과 각각 10과 5 ng/L로 확인되었다. 이와 달리, 3종의 qTOFMS 장비에서 TOFMS-HR mode로 측정한 정량한계는 PFOA 5-250 ng/L, PFOS 5-100 ng/L으로 측정되었으며, 사용기기에 따른 정량한계 차이가 크게 나타났다. 그리고, qTOFMS의 이온화 및 분석방식이 TQMS와 달라 MRM-HR mode에서 측정한 정량한계가 TOFMSHR mode의 값과 큰 차이를 나타내지는 않았다. 따라서, 일부 qTOFMS장비의 정량한계가 최대 250 ng/L로 확인됨에 따라 이들 장비를 이용하기 위해서는 전처리시 시료 농축배수를 일부 조정하여야 ppt 수준의 정량분석이 가능할 것으로 판단되었다. 또한, PFDA등 일부 long-chain PFCs 유도체의 ion density가 LC-TQMS와 qTOFMS에서 모두 낮았으며(Fig. 2), 이들의 정량한계 개선을 위한 연구가 보완되어야 할 것으로 판단된다. qTOFMS는 TQMS보다 다성분 분석 시, PFCs 유도체 등을 동시 검출할 수 있는 장점을 갖고 있어, Martin 등(2004) 일부 연구자들은 qTOFMS 장비를 활용하여 현재 PFCs 분석연구를 수행하고 있고(Valsecchi et al., 2013), 앞으로 환경 잔류물질 분석분야에 다양하게 활용 될 수 있을 것으로 기대되었다.
Acknowledgments
This study was carried out with the support of “Research Program for Agricultural Science & Technology Development (PJ009301)”, Rural Development Administration, Republic of Korea.
Literature Cited
-
Ballesteros-Gomez, A., S. Rubio, and S. van Leeuwen, (2010), Tetrahydrofuran-water extraction, in-line clean-up and selective liquid chromatography/tandem mass spectrometry for the quantitation of perfluorinated compounds in food at the low picogram per gram level, J. Chromatogr. A, 1217:, p5913-5921.
[https://doi.org/10.1016/j.chroma.2010.07.032]

- Choi, G. H., M. Park, J. M. Park, S. M. Hong, O. K. Kwon, Y. K. Park, and J. H. Kim, (2011), Quantitative analysis of residual 24 organochlorine POPs in sundried salts, Kor. J. Pestic. Sci, 15, p502-506, (in Korean).
-
Lee, W. W., W. H. Chang, H. Pyo, T. S. Kang, and J. Hong, (2010), Analytical trend of perfluorinated compounds in environmental and biota samples, Anal. Sci. Technol, 23, p331-346, (in Korean).
[https://doi.org/10.5806/AST.2010.23.4.331]

-
Lechner, M., and H. Knapp, (2011), Carryover of Perfluorooctanoic Acid (PFOA) and Perfluorooctane Sulfonate (PFOS) from Soil to Plant and Distribution to the Different Plant Compartments Studied in Cultures of Carrots (Daucus carota ssp Sativus), Potatoes (Solanum tuberosum), and Cucumbers (Cucumis Sativus), J. Agric. Food. Chem, 59(20), p11011-11018.
[https://doi.org/10.1021/jf201355y]

-
Martin, J. W., M. M. Smithwick, B. M. Braune, P. F. Hoekstra, D. C. G. Muir, and S. A. Mabury, (2004), Identification of long-chain perfluorinated acids in biota from the Canadian arctic, Environ. Sci. Technol, 38, p373-380.
[https://doi.org/10.1021/es034727+]

- USEPA, (2014), Emerging contaminants-Perfluorooctane sulfonate (PFOS) and perfluorooctanoic acid (PFOA). United States Environmental Protection Agency, EPA 505-F-14-001, March 2014, Available at http://www2.epa.gov/sites/production/files/2014-04/documents/factsheet_contaminant_pfos_pfoa_march2014.pdf.
-
Valsecchi, S., M. Rusconi, and S. Polesello, (2013), Determination of perfluorinated compounds in aquatic organisms: a review, Anal. Bioanal. Chem, 405, p143-57.
[https://doi.org/10.1007/s00216-012-6492-7]

-
Wilhelm, M., J. Angerer, H. Fromme, and J. Holzer, (2009), Contribution to the evaluation of reference values for PFOA and PFOS in plasma of children and adults from Germany, Int. J. Hygiene Environ. Health, 212, p56-60.
[https://doi.org/10.1016/j.ijheh.2007.11.002]