Mepanipyrim에 대한 잿빛곰팡이병균의 저항성 검정
초록
병든 토마토, 딸기, 오이 등의 열매에서 분리한 86개의 Botrytis cinerea의 균주를 가지고 한천희석법을 통하여 mepanipyrim의 균사생장 억제효과를 조사하였으며, EC50값을 계산하여 저항성 모니터링을 실시하였다. 병원균의 저항성 모니터링을 PDA 배지에서 실시할 경우 mepanipyrim의 균사생장 억제효과를 정확하게 검정할 수 없었으나, FGA 배지를 사용하였을 때에는 감수성과 저항성 반응을 뚜렷하게 구분할 수 있었다. 실험에 사용한 B. cinerea의 86개 균주를 1.0 μg mL−1의 EC50값을 가지고 감수성과 저항성을 구분하였으며, 전체 균주 중에서 20개인 23.3%가 저항성균으로 분류되었다. 지역에 따라서 저항성균의 분리비에는 차이가 있었는데, 경기, 경남/부산, 그리고 충남에서 각각 분리한 균주 중에서 저항성균의 비율은 28.6, 33.3, 12.8%로, 경남/부산 지역에서 가장 높았다. Mepanipyrim에 대한 저항성균은 pyrimethanil에 대해서도 교차저항성을 보였으며, 오이 자엽에 대한 병원성을 감수성 균주와 비교해 보아도 전혀 떨어지지 않았다. 따라서 포장에서 anilinopyrimidine계 살균제를 효과적으로 사용하기 위해서 적극적인 관리가 필요한 상태이다.
Abstract
With 86 isolates of Botrytis cinerea obtained from diseased fruits of tomato, strawberry and cucumber, it was conducted to detect the fungicide resistance of B. cinerea against mepanipyrim through an agar dilution method. FGA medium was used for monitoring the resistance. Among 86 isolates of B. cinerea, resistant isolates were composed by 23.3%, which was different according to regions isolating the pathogen. In accordance with isolation region, the isolation frequency of resistant isolates was as follows; that of Gyeonggi, Gyeongnam/Pusan and chungnam was 28.6%, 33.3% and 12.8%, respectively. The resistant isolates of B. cinerea showed the cross resistance between mepanipyrim and pyrimethanil. Also the pathogenicity of B. cinerea resistant to mepanipyrim was high as like that of sensitive isolates. Because of them, it should be necessary to manage the spraying system of mepanipyrim and the monitoring for the fungicide resistance.
Keywords:
Botrytis cinerea, fungicide resistance, mepanipyrim, cross resistance키워드:
살균제 저항성, 교차 저항성서 언
Botrytis cinerea는 150여종의 작물을 기주로 가지는 대표적인 다범성 식물병원균으로 알려져 있다(Agrios, 2005). 잿빛곰팡이병균은 시설 원예작물, 화훼, 과수 및 저장과 수송 중에도 병을 일으켜 큰 손실을 초래한다. 부생성이 강하여 노화된 식물체나 죽은 식물체 잔재물 등에서 균사조각, 균핵, 분생포자 또는 자낭포자의 형태로 월동을 하며, 다습하고 서늘한 환경조건에서 많이 발생한다. 이런 잿빛곰팡이병은 생물적 방제 또는 다양한 경종적 방법 등을 통해서 관리가 가능하지만, 가장 신속하고 효과적인 방법은 살균제를 사용하는 화학적 방법이다(Kim et al., 2007). 화학적 방법에서 사용하는 살균제는 작물을 건전하게 재배, 관리하여 생산성을 높일 수 있을 뿐만 아니라, 질적으로도 우수한 품질의 농산물을 얻기 위해 필요한 주요 농자재이다. 그러나 작물을 재배하는 현장에서 살균제의 남용과 오용 등으로 인하여 저항성을 보이는 병원균이 출현하는 문제가 야기되고 있다(Hwang et al., 2010; Kim et al., 2014). 이미 잿빛곰팡이병균에 대해서 benzimidazole계 살균제 또는 dicarboximide계 살균제에 대한 저항성균이 발현되었다는 많은 보고가 있다(Lee et al., 2007). 다양한 살균제에 대한 저항성균이 발생하고 있기 때문에 효과적인 병방제를 위해서는 기존의 살균제와는 다른 작용기작을 갖는 새로운 살균제가 개발되어야 한다. 그 중에서 anilinopyrimidine계에 속하는 mepanipyrim은 발아관 신장을 억제하고, 병원균으로부터 식물세포벽 분해효소의 분비를 억제하는 새롭고 특이한 작용기작을 가지고 있지만(Miura et al., 1994), 다주기성 식물병원균인 B. cinerea는 다량의 분생포자를 만들고, 다양한 전반 방법과 넓은 기주 범위를 갖는 특징이 있어서 살균제에 대한 저한 것처럼 특이적인 작용점을 지닌 anilinopyrimidine계 살균제는 이미 전세계적으로 저항성 발현이 보고되었다(Myresiotis et al., 2008; Panebianco et al., 2015). 따라서 살균제를 사용하여 잿빛곰팡이병을 지속적이고 효과적으로 방제하기 위해서는 우리나라 재배지에서 분리한 병원균의 살균제에 저항성 정도를 파악함과 동시에 저항성 집단의 변화를 조사할 필요가 있다.
본 실험에서는 국내의 주요 채소 재배지에서 분리한 잿빛곰팡이병균을 대상으로 mepanipyrim에 대한 저항성 발현 정도를 조사하고 anilinopyrimidine계에 속하는 다른 살균제와의 교차 저항성 여부, 저항성 균주의 포장 적응력 등을 조사하여, 살균제 사용을 효율적으로 관리 할 수 있는 기초 자료로 획득하고자 하였다.
재료 및 방법
병원균의 분리 및 보관
병원균은 2011년 경기, 경남/부산, 그리고 충남의 토마토, 딸기, 오이 재배지역에서 잿빛곰팡이병균인 B. cinerea에 감염되어 표면에 병원균의 포자가 형성된 열매를 채집하여 병원균을 분리하였다. 병원균을 단포자 분리하기 위하여, 병든 열매 표면에 형성된 B. cinerea의 분생포자를 살균증류수에 현탁시킨 후에 현탁액의 포자 밀도를 1 × 103개 ml−1로 조절하였다. 병원균의 포자 현탁액을 Petri 접시(직경; 9 cm)에 분주한 PDA배지(DifcoTM 제품, Becton, Dickinson and Company, MD 21152 USA)에 0.1 mL씩 고르게 접종하고, 20°C의 암상태에서 2일간 배양한 후, 형성된 균총을 떼어내어 실험에 사용하였다.
분리한 균주들은 20°C의 PDA에서 4일간 배양한 후, 균총의 선단부에서 직경 5 mm의 균사 조각을 떼어내어 CryotubeTM (지름; 12 mm, 높이; 48 mm, Nunc Co. Ltd)에 5조각씩 넣고 5 mL의 멸균수를 넣어 상온에서 장기간 보관하였다. 또한 PDA 사면배지에 지름 5 mm의 균사조각을 접종하여 배양한 후, 4°C에서 보관하며 실험에 사용하였다.
살균제 저항성 모니터링
분리한 잿빛곰팡이병균의 살균제에 대한 감수성 정도를 조사하기 위해 anilinopyrimidine계 살균제에 속하는 mepanipyrim(a.i. 40%, SC)을 사용하였다. 병원균에 대한 mepanipyrim의 균사생장 억제효과는 PDA배지와 FGA배지(fructose, 10 g; gelatin, 2 g; KH2PO4, 1 g; MgSO4·7H2O, 0.5 g; NaNO3, 2 g; agar, 15 g; 증류수, 1 L)에서 조사하였다. Mepanipyrim을 살균증류수에 용해시켜 각각의 배지에 첨가하였으며, 배지에서 살균제의 최종농도는 0.003, 0.03, 0.3, 3.0, 100 μg mL−1가 되도록 조절하였다. 배지에서 세균 오염을 방지하기 위해서 streptomycin을 300 μg mL−1가 되도록 첨가하였다. PDA 배지에 접종한 병원균은 20°C에서 4일간 배양한 병원균의 균총 선단 부위에서 직경 3 mm의 균사조각을 떼어내어 살균제가 농도별로 첨가된 새로운 배지의 중앙부위에 접종하였다. 살균제 배지에 병원균을 접종하고 20°C에서 4일간 배양한 후, 균총의 직경을 측정하였다. 살균제의 효과는 살균제를 첨가하지 않은 배지에서 균총의 직경과 살균제를 첨가한 배지에서 균총 직경을 비교하여 균사생장 억제율(%)을 계산하여 비교하였다.
살균제에 대한 병원균의 감수성 정도는 균사생장을 50% 억제하는 살균제의 농도(EC50; effective concentration inhibiting mycelial growth by 50%)를 구하여 비교하였으며, 포장에서 분리한 병원균 집단의 감수성과 저항성을 구분하고자 하였다.
교차 저항성 조사
Anilinopyrimidine계에 속하는 pyrimethanil과 mepanipyrim 간에 교차 저항성이 있는 지의 여부를 조사하였다. Pyrimethanil(a.i. 30%, WP)에 대한 B. cinerea의 저항성 정도는 위에서 설명한 한천희석법을 사용하여 균사생장 억제효과를 조사한 후, 각 균주의 EC50값을 구하여 mepanipyrim의 EC50값과 비교하였다.
오이 자엽을 이용한 mepanipyrim 효과 검정 및 병원균의 병원성 조사
오이(품종; 백다다기) 종자를, 부농상토를 담은 포트에 파종하고, 자엽이 완전히 전개할 때까지 온실에서 재배하였다. 병원균의 접종원을 준비하기 위해서 B. cinerea를 PDA 배지에 접종하고 20°C의 암상태에서 5일간 배양한 후 12시간 간격으로 광을 조사하는 조건으로 옮겨서 7일간 더 배양하면서 분생포자의 형성을 유도하였다. 형성된 B. cinerea의 분생포자는 멸균증류수를 사용하여 수확하고, 4겹의 거즈에 여과하여 균사조각을 제거하였다. 병원균의 포자 현탁액 밀도를 1 × 105개 mL−1로 맞추고, 살균제를 처리한 또는 증류수만을 처리한 자엽에 10 μL씩 점적하여 접종하였다. 접종한 오이 자엽은 습실처리한 플라스틱 상자에 넣어 20°C에서 3일간 보관하면서 발병을 유도하였으며, 자엽에 형성된 수침상 병반의 직경을 측정하였다. 병원균의 병원성은 포자뿐만 아니라 균사를 접종원으로 사용해서도 조사하였다. 병원균을 20°C의 PDA 배지에서 4일간 배양한 다음 균총 선단부에서 떼어낸 3 mm의 균사조각을 접종원으로 사용하였는데, 균사 생장면이 오이 자엽과 접촉할 수 있도록 올려놓아 접종하였다. 균사조각을 접종한 오이 자엽은 포자로 접종하였을 때와 동일하게 습실처리한 20°C의 플라스틱 상자에서 보관하며 발병을 유도하였으며, 병원균을 접종하고 3일 후에 형성된 병반의 길이를 측정하였다. 모든 실험은 3반복 실시하였다.
결과 및 고찰
배지 종류에 따른 mepanipyrim의 균사생장 억제효과
Takagaki 등(2004)은 PDA배지를 사용하여 한천희석법으로 딸기 잿빛곰팡이병균의 저항성 모니터링을 실시하였으나 300 μg mL−1의 mepanipyrim 첨가 배지에서도 병원균이 생장하여 정확한 모니터링을 실시할 수 없었다. 결국 병원균의 효소 분비를 저해하며 포자의 발아관 신장 억제효과를 가지는 mepanipyrim의 기작을 이용하여 완전배지 대신에 FGA 배지를 사용함으로써 딸기 잿빛곰팡이병균의 저항성 모니터링을 실시하였다. 본 실험에서도 Fig. 1A에서 보는 것과 같이 PDA 배지에서는 실험에 사용한 6개의 균주의 살균제에 대한 반응을 감수성과 저항성 반응으로 뚜렷하게 나눌 수가 없었지만, FGA 배지에서 mepanipyrim의 균사생장 억제효과를 조사하였을 때에는 Fig. 1B에서 보는 것과 같이 6개 균주 중에서 11-1, 11-4, 11-26은 저항성 균주로, 11-35. 11-94, 11-108은 감수성 균주로 뚜렷하게 나누어졌다. 잿빛곰팡이병을 일으키는 B. cinerea는 세포벽을 분해하는 효소를 분비하여 기주식물의 세포벽을 쉽게 침입한다(Edlich et al., 1989; Staples and Mayer, 1995). PDA 배지에서는 병원균이 효소를 분비하지 않고서도 배지에 함유되어 있는 영양분을 흡수할 수 있기 때문에 균사생장에 대해서 살균제의 억제효과가 뚜렷하게 나타나지 않았던 반면에, fructose와 gelatin 등과 같이 다당류와 단백질을 함유한 배지에서는 mepanipyrim에 의해서 병원균의 효소 분비가 억제되면 배지 상에 있는 다당류와 단백질을 생장에 필요한 영양분의 형태로 분해하여 흡수할 수 없기 때문에 균사생장에 대한 억제효과가 뚜렷하게 나타났다(Leroux, 1994). 따라서 mepanipyrim에 대한 B. cinerea의 균사생장 억제효과를 한천희석법으로 조사하는 저항성 모니터링에는 FGA 배지와 같이 다당류와 단백질을 함유하고 있는 배지를 사용하여야 할 것이다.
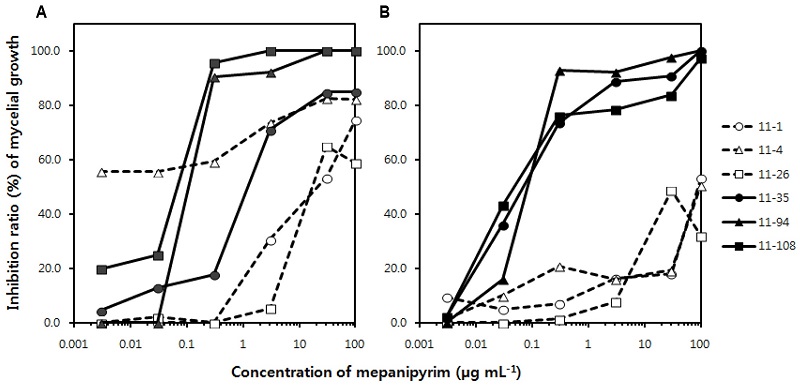
Inhibitory effect of mycelial growth of Botrytis cinerea causing gray mould onto PDA medium (A) and FGA medium (B). All isolates of B. cinerea were incubated at 20°C under the dark condition for 4 days following the inoculation with them on indicated medium. FGA medium was composed as follows; fructose, 10 g; gelatin, 2 g; KH2PO4, 1 g; MgSO4·7H2O, 0.5 g; NaNO3, 2 g; agar, 15 g; and distilled water, 1 L.
Mepanipyrim에 대한 B. cinerea의 감수성 기준 설정과 저항성 모니터링
FGA 배지에서 실시한 mepanipyrim에 대한 B. cinerea의 저항성 모니터링 결과, 병원균은 감수성과 저항성 그룹으로 나눌 수 있었다(Fig. 2). Takagaki 등(2004)은 FAG 배지에서 paper disc법을 사용하여 mepanipyrim에 대한 딸기 잿빛곰팡이병균의 MIC (minimum inhibitory concentration)값을 조사하여 저항성 발현을 모니터링하였으며, 3.0 μg mL−1을 감수성 기준으로 결정하였나, 본 실험에서는 각 균주의 mepanipyrim에 대한 EC50값을 구하여 비교하였다. 총 균주 중에서 23.3%에 해당하는 20개 균주는 저항성 균주로 평균 EC50값이 1.0 μg mL−1보다 높게 나타난 반면에, 나머지 균주들은 평균 EC50값이 0.190 μg mL−1인 감수성 균주로 나타났다. 감수성 균주 집단에 속하는 B. cinerea 균주들의 최저와 최고 EC50값은 각각 0.006 μg mL−1와 1.097 μg mL−1이었다. 이 결과를 바탕으로 저항성과 감수성 균주를 구분하는 기준이 되는 EC50값은 1.0 μg mL−1로 결정하였다.
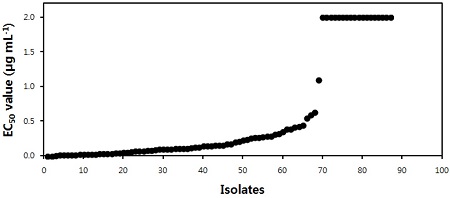
Distribution of EC50 values of Botrytis cinerea isolates. The response of Botrytis cinerea was investigated on FGA medium amended with mepanipyrim to the each indicated concentration.
2002년 칠레에서는 포도(Vitis vinifera)의 잿빛곰팡이병을 방제하기 위해서 mepanipyrim과 동일한 anilinopyrimidine계에 속하는 cyprodinil을 작기 중 4회씩 두 번의 작기에 사용한 후에 38.5%의 저항성균이 발현되었다(Latorre et al., 2002). 저항성균의 cyprodinil에 대한 EC50값은 2.9에서 4.84 μg mL−1이었으며, anilinopyrimidine에 속하는 mepanipyrim과 pyrimethanil에 대해서 높은 교차저항성을 보였다.
저항성의 기준이 되는 EC50값을 가지고 지역별 균주를 분석한 결과, 경기, 경남/부산, 그리고 충남에서 저항성 그룹에 속하는 균주의 비율은 28.6, 33.3, 12.8%로 충남 지역 균주에서 저항성 균주의 비율이 가장 낮았다(Fig. 3). 본 연구의 결과 병원균을 분리한 모든 지역에서 이미 mepanipyrimdp 대한 저항성균이 발현되어 있었다. 특히 경남과 부산 지역에서 저항성균의 분리 빈도가 33%를 상회하고 있기 때문에 포장에서 본 살균제를 사용하는데 집중적인 관리가 필요할 것으로 생각한다.
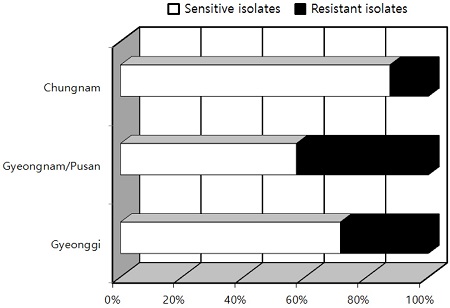
Ratio (%) of high sensitive and resistant group of Botrytis cinerea to mepanipyrim isolated in 2011 (A). Comparison of the percentages of sensitive and resistant isolates (B).
본 실험에 사용한 B. cinerea는 토마토, 딸기, 오이 등 세 가지의 기주식물로부터 분리하였는데, 전체적인 저항성 균주의 분리 빈도가 23.3%이기 때문에 포장에서의 관리가 중요하게 되었다. 칠레의 경우 cyprodinil을 작기 중에 4회씩 2년을 연속 사용한 지역에서 저항성의 발현이 심각하게 나타나는 것을 보면, 국내 시설 채소 지역에서 잿빛곰팡이병을 방제하기 위해서는 다양한 살균제를 적절한 시기에 효과적으로 사용할 수 있는 방제력의 작성이 필요하다. 또한 지역적 저항성 발현의 차이는 지역에서 잿빛곰팡이병을 방제하기 위해서 사용하는 살균제의 종류가 다르기 때문이라고 생각한다. 국내에서는 재배하는 농업인이 살균제의 종류를 선택하기 보다는 판매업자나 공동출하 집단에 따라서 결정되다보니 지역 간 선호 살균제가 나타나며, 살균제 저항성 발현 정도도 다른 원인이 되고 있다고 생각한다.
Pyrimethanil과의 교차 저항성
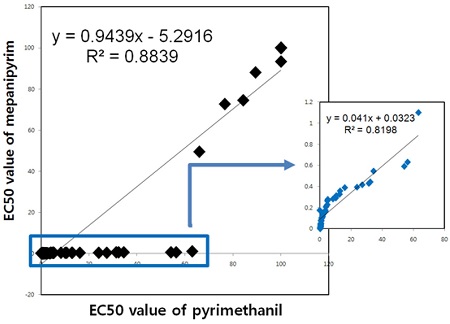
Mepanipyrim에 대해서 감수성 반응을 보인 11-35, 11-94, 11-108는 동일한 계열에 속하는 pyrimethanil에 대해서 감수성 반응을, 저항성 반응을 보였던 11-1, 11-4, 11-26은 저항성 반응을 보여 두 살균제 간에 교차저항성 관계가 있음을 알 수 있었다(Fig. 4). Mepanipyrim의 기작은 병원균인 B. cinerea의 세포벽 분해효소의 분비를 저해하여 기주식물에서 발병을 억제하는 것으로 알려져 있다(Miura et al., 1994). Mepanipyrim과 같이 anilinopyrimidine계에 속하는 pyrimethanil의 경우도 기주식물에서 병원균의 발아와 부착기 형성에 대한 억제보다는, 병원균이 기주식물체를 침입하기 위하여 분비하는 세포벽 분해효소의 분비를 억제함으로써 기주식물체에서 사멸되는 세포 수를 현저히 감소시킴으로 잿빛곰팡이병을 효과적으로 방제하는 살균제이다(Daniels and Lucas, 1995). 따라서 pyrimethanil은 mepanipyrim과 동일한 anilinopyrimidine계에 속하며 동일한 작용기작을 갖는 살균제로서, 약제 간에 뚜렷한 교차 저항성이 나타났다. 본 실험에 사용한 모든 균주의 두 가지 살균제 반응에 대한 상관관계는 Fig. 4에서 보는 것과 같이 R2값이 0.8839인 높은 상관 관계를 보여, 뚜렷한 교차 저항성이 존재하였다. 이러한 교차 저항성은 포도에서 분리한 B. cinerea를 가지고 실험한 Latorre 등(2002)에 의해서도 동일하게 보고된 바 있다. 따라서 포장에서 anilinopyrimidine계에 속하는 mepanipyrim, pyrimethanil, cyprodinil에 대한 잿빛곰팡이병균의 저항성 관리가 절대적으로 필요하며, 한 작기 중에 계속적인 살포가 이루어지지 않도록 주의하여야 한다.
오이 자엽에서 저항성균의 병원성
Mepanipyrim에 대해서 감수성인 11-35, 11-94, 11-108 균주와 저항성인 11-1, 11-4, 11-26 균주를 선발하여, 오이 자엽에 균사와 포자로 접종하였을 때의 병원성 정도를 비교하였다. 살균제에 대한 반응과는 관계없이 모든 감수성과 저항성 균주는 포자나 균사로 접종하였을 때 오이 자엽에서 전형적인 잿빛곰팡이병의 수침상 병반을 형성하였으나, 통계적으로 유의차 없는 병원성을 나타내었다(Fig. 5). Mepanipyrim에 대해서 저항성을 나타내는 B. cinerea가 감수성 균주와 병원성을 비교할 때 전혀 차이를 보이지 않기 때문에 포장에서 적응력도 차이가 없을 것으로 예상되기 때문에, 한 번 발현된 mepanipyrim 저항성균은 포장에서 도태되지 않고 정착하여 서식할 수 있을 것으로 생각한다. 또한 시실리의 포도에서 분리한 B. cinerea 균주를 사용하여 boscalid, carbendazim, fludioxonil, fenhexamid, iprodione, pyrimethanil에 대한 저항성 모니터링 결과, pyrimethanil에 대한 저항성균의 분리비가 30.8%로 가장 높아, 방제에 중요한 영향이 미칠 것으로 생각하였다(Panebianco, et al., 2015). 이러한 결과는 포장에서 anilinopyrimidine계 살균제 저항성이 확산되지 않도록 적극적인 관리가 필요한 이유가 되고 있다.
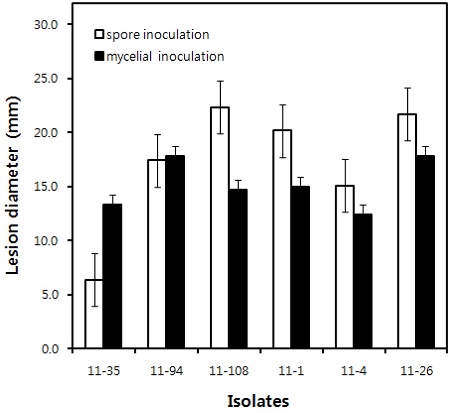
Pathogenicity of Botrytis cinerea isolates obtained from diseased fruits of cucumber, tomato and strawberry, respectively. For the inoculation, 6 isolates of B. cinerea as 3 isolates as 11- 35, 11-94 and 11-108 were sensitive to mepanipyrim and the others as 11-1, 11-4 and 11-26 were resistant to the fungicide. All isolates were inoculated onto cotyledons of cucumber with spore suspension adjusted to 1 × 105 spores mL−1 and mycelial disc (diameter; 3 mm) cut off from the margin of colony incubated for 4 days at 20°C.
살균제 저항성 관리를 위해서는 병원균의 저항성을 판명할 수 있는 정확한 기준이 필요하다. Latorre 등(2002)은 2년 연속 cyprodinil을 여러 번 처리한 포장에서 분리한 26개의 B. cinerea 균주 중에서 10균주의 EC50값은 1-10 μg mL−1 사이였으나, anilinopyrimidine계 살균제를 처리한 적이 없는 포장에서 분리한 15개 균주 중에서 14개 균주의 EC50값은 0.1 μg mL−1 이하로 나타났으며, 포도가 아닌 anilinopyrimidine계 살균제를 처리하지 않았던 다른 원예작물에서 분리한 2균주의 B. cinerea 역시 0.1 μg mL−1 이하의 EC50값을 보였다고 보고하였다. 미국 와싱턴주의 저장 사과에서 발생한 Penicillium expansum에 대한 pyrimethanil의 저항성 정도는 포자 발아 실험을 통하여 포자가 0.5 μg mL−1의 pyrimethanil 처리구에서는 발아를 하지만 10 μg mL−1의 처리구에서는 발아를 하지 못할 경우 저 저항성으로, 10 μg mL−1 처리구에서는 발아를 하고 40 μg mL−1 처리구에서는 발아를 하지 못하였을 때 중 저항성, 40 μg mL−1 처리구에서 발아를 할 경우를 고 저항성으로 분류하기도 하였다(Caiazzo, et al., 2014). 이처럼 감수성의 기준을 결정하는 것은 사용한 모니터링 방법과 균주에 따라서 크게 달라질 수 있다. 만약 감수성 기준을 결정하고자 하는 살균제를 사용하기 전부터 분리하여 가지고 있는 병원균이 있을 경우에는 그 병원균을 감수성인 대표 균주로 사용하여 기준을 결정할 수 있겠지만, 감수성의 기준이 결정되지 않은 상태에서 살균제가 사용되어 왔다면 다수의 균주를 분리하여 살균제에 대한 반응을 검정한 후 감수성과 저항성의 기준을 결정할 수밖에 없다. Fig. 2에서 보면 본 실험에서 사용한 B. cinerea 균주들은 EC50값을 가지고 감수성과 저항성균으로 구분할 수 있으며, 그 값은 1.0 μg mL−1가 타당할 것으로 생각한다. 이는 저항성으로 보고되는 병원균의 EC50값이 Latorre 등(2002)이 보고한 것과 같이 2.0 μg mL−1 이상을 나타내고 있으며, 1.0 μg mL−1 이하의 EC50값을 갖는 병원균들은 오이 자엽 실험에서 mepanipyrim 처리에 의해서 병 발생이 억제되었기 때문에, 1.0 μg mL−1의 EC50값이 감수성과 저항성 균주를 구분하는 기준이 될 수 있을 것으로 생각한다.
Acknowledgments
This work was supported by the research grant of Chungbuk National University in 2013.
Literature Cited
- Agrios, G. N., (2005), Botritis disease, In Plant pathology, 5th, Agrios, G. N. >Ed, Elsevier Academic Press, Burlington, MA, USA, p510-514.
-
Caiazzo, R., Y. K. Kim, and C. L. Xiao, (2014), Occurrence and phenotypes of pyrimethanil resistance in Penicillium expansum from apple in Washington State, Plant Dis, 98, p924-928.
[https://doi.org/10.1094/PDIS-07-13-0721-RE]

-
Daniels, A., and J. A. Lucas, (1995), Mode of action of the anilino-pyrimidine fungicide pyrimethanil. 1. In-vivo activity against Botrytis fabae on broad bean (Vicia faba) leaves, Pesticide Sci, 45, p43-48.
[https://doi.org/10.1002/ps.2780450106]

-
Edlich, W., G. Lorenz, H. Lyr, E. Nega, and E.-H. Pommer, (1989), New aspects on the infection mechanism of Botrytis cinerea Pers, Neth. J. Plant Pathol, 95, p53-62.
[https://doi.org/10.1007/BF01974284]

-
Hwang, S., H.-R. Kim, J. Kim, J.-H. Park, S.-B. Lee, S.-R. Cheong, and H. T. Kim, (2010), Sensitivity of Colletotrichum spp. isolated from grapes in Korea to carbendazim and the mixture of carbendazim plus diethofencarb, Plant Pathol. J, 26, p49-56.
[https://doi.org/10.5423/PPJ.2010.26.1.049]

-
Kim, A. H., S. B. Kim, K. D. Han, and H. T. Kim, (2014), Monitoring for the resistance of strobilurin fungicide against Botrytis cinerea causing gray mold disease, Korean J. Pestic. Sci, 18, p161-167, (in Korean).
[https://doi.org/10.7585/kjps.2014.18.3.161]

-
Kim, J., S. W. Lee, J. Y. Min, Y.-S. Bae, M. U. Shin, S. B. Kim, M. K. Kim, C. R. Yeon, J. Y. Lim, and H. T. Kim, (2007), Development of control system with fungicides against diseases of ginseng plant, Res. Plant Dis, 13, p164-169, (in Korean).
[https://doi.org/10.5423/RPD.2007.13.3.164]

-
Latorre, B. A., I. Spadaro, and M. E. Rioja, (2002), Occurrence of resistant strains of Botrytis cinerea to anilinopyrimidine fungicides in table grapes in Chile, Crop Prot, 21, p957-961.
[https://doi.org/10.1016/S0261-2194(02)00074-1]

- Lee, S. W., J. Kim, J. Y. Min, Y.-S. Bae, and H. T. Kim, (2007), Monitoring for the resistance of Botrytis cinerea causing ginseng gray mold to procymidone and Its multiple resistance with the mixture of carbendazim/diethofencarb, Korean J. Pestic. Sci, 13, p170-176, (in Korean).
-
Leroux, P., (1996), Recent developments in the mode of action of fungicides, Pestic. Sci, 47, p191-197.
[https://doi.org/10.1002/(SICI)1096-9063(199606)47:2<191::AID-PS415>3.0.CO;2-I]

-
Milling, R. J., and C. J. Richardson, (1995), Mode of action of the anilino-pyrimidine fungicide pyrimethanil. 2. Effects on enzyme secretion in Botrytis cinerea, Pesticide Sci, 45, p43-48.
[https://doi.org/10.1002/ps.2780450107]

-
Miura, I., T. Kamakura, S. Maeno, S. Hayashi, and I. Yamaguchi, (1994), Inhibition of enzyme secretion in plant pathogens by mepanipyrim, a novel fungicide, Pest. Biochem. Physiol, 48, p222-228.
[https://doi.org/10.1006/pest.1994.1023]

-
Myresiotis, C. K., G. A. Bardas, and G. S. Karaoglanidis, (2008), Baseline sensitivity of Botrytis cinerea to pyraclostrobin and boscalid and control of anilinopyrimidine- and benzimidazole-resistant strains by these fungicides, Plant Dis, 92, p1427-1431.
[https://doi.org/10.1094/PDIS-92-10-1427]

-
Panebianco, A., I. Castello, G. Cirvilleri, G. Perrone, F. Epifani, M. Ferrara, G. Polizzi, D. R. Walters, and A. Vitale, (2015), Detection of Botrytis cinerea field isolates with multiple fungicide resistance from table grape in Sicily, Crop Prot, 77, p65-73.
[https://doi.org/10.1016/j.cropro.2015.07.010]

-
Staples, R. C., and A. M. Mayer, (1995), Putative virulence factors of Botrytis cinerea acting as a wound pathogen, FEMS Microbiol. Letter, 134, p1-7.
[https://doi.org/10.1111/j.1574-6968.1995.tb07905.x]

-
Takagaki, M., I. Miura, and K. Nagayama, (2004), A Method for monitoring the sensitivity of Botrytis cinerea to mepanipyrim, 29, p369-371.
[https://doi.org/10.1584/jpestics.29.369]